HBV感染已成为世界性的公共卫生问题,2021年WHO发布的数据显示全球慢性HBV感染者已超过2.96亿人,每年大约有82万人死于HBV感染导致的急慢性肝炎、肝硬化、肝细胞肝癌等疾病[1]。我国是乙型肝炎大国,2013年国家疾病预防控制局发布的资料显示,2006年我国有近5亿人感染过HBV,有9 300万例乙型肝炎病毒表面抗原(hepatitis B surface antigen,HBsAg)携带者[2-3],是世界上HBsAg携带人数最多的国家。值得注意的是,临床上存在一种特殊的HBV感染,即感染者血液中HBsAg阴性而肝脏或血液中HBV DNA阳性,通常HBV DNA载量<200 IU/mL[4],此现象称为隐匿性乙型肝炎病毒感染(occult hepatitis B virus infection,OBI)[5]。OBI患者血清中HBsAg用常规的商业化HBsAg试剂盒难以检出,这对临床HBV感染的预防、筛查、治疗和监测及输血安全性带来了巨大隐患[6]。OBI的机制尚未阐明,目前病毒基因组中S区基因突变被广泛认为是造成OBI现象的主要原因之一[7]。OBI患者临床样本中病毒载量低、HBV DNA S区基因片段长,导致PCR成功扩增出目的基因的难度大。探究扩增低载量HBV DNA S区基因的最佳PCR实验条件,对分析造成OBI现象S区基因的突变和氨基酸置换至关重要。本研究探索并自建了一种扩增低载量HBV DNA S区基因的两轮PCR法,并在扩增效率、特异性等方面与传统巢式PCR进行比较,现报告如下。
1 材料和方法 1.1 样本与试剂收集2017年5月至2018年1月经我院检验科筛选获得的28例OBI患者的血清样本(HBsAg检测无反应性,HBV DNA阳性)。HBsAg采用化学发光免疫分析法(Architect i2000SR全自动免疫分析仪,美国雅培公司)定量检测;HBV DNA采用高灵敏HBV DNA检测试剂盒(美国PerkinElmer公司)使用实时定量PCR仪(Lightcycler-480Ⅱ,瑞士罗氏公司)进行检测。高灵敏HBV DNA检测试剂盒的定量检测线性范围为2.0×10~1.0×109 IU/mL,其最低检出限为10 IU/mL。HBV DNA载量>20 IU/mL即为阳性。本研究通过我院医学伦理委员会审批(2018-IRBQYYS-020),因研究的血清样本为经临床检测后的废弃样本,且不涉及泄漏患者的个人信息问题,故予以免知情同意。
1.2 核酸模板制备采用核酸磁珠分离提取试剂盒(美国PerkinElmer公司)提取血清DNA,采用微量紫外分光光度计(NanoDrop 1000,美国ThermoFisher Scientific公司)检测核酸浓度和纯度。
1.3 引物设计从NCBI(National Center for Biotechnology Information)网站(www.ncbi.nlm.nih.gov/nuccore/)下载我国人群广泛流行的HBV基因型(B型和C型)序列,采用Primer 5软件设计巢式PCR引物和两轮PCR引物,引物序列见表 1。巢式PCR引物设计了3对(P1~P3),扩增产物理论上包含整个HBV DNA S区基因。两轮PCR引物设计了3条正向引物、4条反向引物,共计组合12对引物(P4~P15),扩增产物理论上包含整个HBV DNA S区基因。所有引物均由上海华津生物科技有限公司合成。
|
|
表 1 巢式PCR和自建两轮PCR的引物序列 Tab 1 Primer sequences for nested PCR and self-built 2-round PCR |
1.4 巢式PCR扩增反应
第一轮反应:反应体系为20 ng DNA模板、10 μL Taq DNA聚合酶预混合物(TaKaRa Taq Version 2.0 plus dye,包含dNTP)、2 μL引物P1(本研究中所有引物浓度单位均为pmol/μL),补加DEPC水至20 μL。反应条件为预变性98 ℃ 30 s;变性98 ℃ 10 s、退火55 ℃ 30 s和延伸72 ℃ 40 s,循环30次。
第二轮反应:第一轮PCR产物1 μL,引物P2 1 μL,其余条件与第一轮反应相同。
第三轮反应:第二轮PCR产物1 μL(1∶10稀释),引物P3 1 μL,退火58 ℃ 30 s,其余条件与第一轮反应相同。
采用PCR扩增仪(Veriti Thermal Cycler梯度PCR仪,美国ABI公司)进行扩增,然后对PCR扩增产物进行1%琼脂糖凝胶电泳。将DNA Marker 2000(上海翊圣生物科技有限公司)和PCR产物分别加入各泳道中120 V恒压电泳30 min。待电泳结束后将胶块置于凝胶成像仪(ImageQuant LAS4000,美国GE公司)上观察并记录实验结果。
1.5 自建两轮PCR扩增反应第一轮反应:反应体系为20 ng DNA模板、25 μL Taq DNA聚合酶预混合物、2 μL引物,补加DEPC水至50 μL。反应条件为预变性98 ℃ 30 s;变性98 ℃ 10 s、退火55 ℃ 30 s和延伸72 ℃ 65 s,循环30次。
第二轮反应:第一轮PCR扩增产物1 μL(1∶10稀释),引物1 μL,退火62 ℃ 30 s,循环25次,其余条件与第一轮反应相同。
两轮PCR扩增产物的电泳验证过程与上述巢式PCR扩增产物相同。
1.6 PCR产物克隆测序PCR扩增产物经琼脂糖凝胶电泳后切割目的条带凝胶,采用DNA胶回收试剂盒[DiaSpin柱式PCR产物纯化试剂盒,生工生物工程(上海)股份有限公司]进行PCR产物纯化。采用T载体克隆试剂盒(T-Vector pMDTM 18,大连宝日医生物技术有限公司)对纯化后的PCR产物DNA片段与T载体进行连接,然后将连接物转化至DH5α感受态细胞(苏州新赛美科技生物公司),并涂布至含氨苄青霉素的LB琼脂培养平板上,倒置、过夜培养。次日,挑选平板上单个菌落,每个样本挑取5个单克隆菌落接种于含氨苄青霉素的液体LB培养基中,置于37 ℃摇床充分振荡培养。然后将单克隆菌液送至苏州金唯智生物科技有限公司测序(测序仪型号为ABI3730,美国ABI公司)。利用NCBI网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对PCR扩增产物克隆测序结果进行核酸序列BLAST比对。
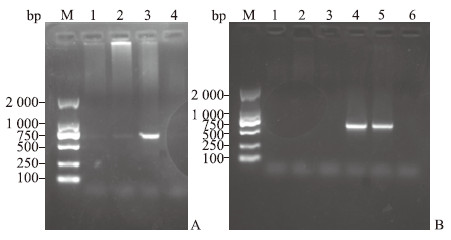
2 结果 2.1 巢式PCR扩增结果先采用两轮巢式PCR引物(P1、P2)及反应体系,挑选经检测HBV DNA载量低的样本(100~200 IU/mL)和阳性对照(HBV DNA载量>1×106 IU/mL)验证巢式PCR引物的特异性和反应条件。结果如图 1A所示,阳性对照经扩增出现清晰的目的条带,低病毒载量样本经两轮巢式PCR扩增产物较少,条带亮度较浅,需进行第三轮巢式PCR扩增。
|
图 1 6例HBV DNA载量较低血清样本的巢式PCR扩增效果 Fig 1 Amplification results of nested PCR in 6 serum samples with low-load HBV DNA A: The agarose gel electrophoresis results for 2 rounds of nested PCR amplification. 1, 2: Low viral load samples; 3: Positive control; 4: Negative control. B: The agarose gel electrophoresis results for 3 rounds of nested PCR amplification. 1-6: Low viral load samples S1-S6. HBV: Hepatitis B virus; PCR: Polymerase chain reaction; M: DL2000 molecular weight marker. |
6例低病毒DNA载量样本分别为S1(123 IU/mL)、S2(165 IU/mL)、S3(104 IU/mL)、S4(147 IU/mL)、S5(197 IU/mL)和S6(195 IU/mL),因两轮巢式PCR达不到本研究实验要求,故使用引物P1~P3按照上述三轮巢式PCR条件进行扩增,结果如图 1B所示。在6例样本中仅有2例扩增出清晰的目的条带(S4和S5),另外4例样本均未出现任何特异性条带,扩增结果的重复性较差。应用这3对引物和优化的巢式PCR条件,对22例更低HBV DNA载量(20~99 IU/mL)的血清样本进行扩增,均未能扩增出HBV DNA S区基因。
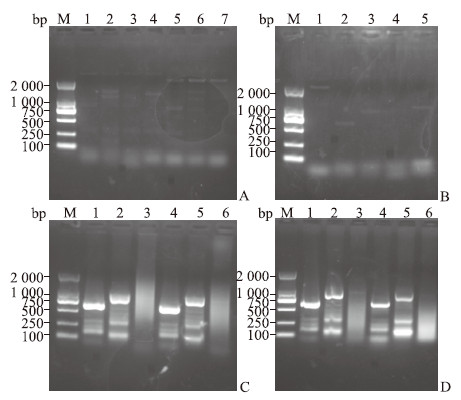
2.2 自建两轮PCR扩增结果针对国内主要HBV感染基因亚型的相对保守位点设计12对引物,选择上述巢式PCR重复多次目的条带均光亮且测序结果正确的S4样本(147 IU/mL)作为DNA模板。使用12对引物P4~P15对S4样本进行第一轮PCR扩增,扩增产物经琼脂糖凝胶电泳(图 2A、2B)显示,引物P4、P5、P6、P7、P8和P9均存在大量的非特异性条带;引物P10和P11第一轮PCR产物条带的位置(>2 000 bp)均为非特异性扩增;引物P14未出现特异性条带;引物P12、P13和P15(目的基因片段大小分别为639、971和1 095 bp)经第一轮PCR,扩增产物条带分别位于700、1 000和1 100 bp左右,扩增片段与目的基因片段大小相似,但条带亮度较淡。切割引物P12、P13和P15目的片段条带胶回收DNA后进行测序分析,因DNA浓度过低无法正常测序。故使用第一轮PCR产物作为模板,分别再次使用相应的引物进行第二轮PCR扩增。引物P12和P13(目的基因片段大小为639和971 bp)扩增后,扩增产物电泳后出现多个亮度不同的条带,但分别在600、900 bp左右位置出现亮度很强的特异性条带,与目的基因条带位置相近(图 2C、2D)。切割引物P12和P13第二轮PCR扩增产物(图 2C中第1和第2泳道条带)胶回收DNA,进行PCR产物直接测序,测序结果经比对确认为HBV DNA S区基因。使用引物P15经第二轮PCR扩增后未出现任何特异性条带,呈弥散现象。对第一轮PCR扩增产物模板进行最适稀释度的选择,结果显示未稀释与1∶10稀释扩增产生的特异性条带的亮度明显强于1∶100稀释(图 2C、2D)。对PCR总反应体系进行选择发现,50 μL总反应体系扩增产生的条带亮度明显强于20 μL反应体系(图 2D)。
|
图 2 自建两轮PCR扩增引物的选择和反应条件的优化 Fig 2 Selection of primers and optimization of reaction conditions of self-built 2-round PCR amplification A: The agarose gel electrophoresis results of 1 round of PCR amplification products using primers P4-P10 for S4 samples. Lanes 1-7 are the results using primers P4-P10, respectively. B: The agarose gel electrophoresis results of 1 round of PCR amplification products using primers P11-P15 for S4 samples. Lanes 1-5 are the results using primers P11-P15, respectively. C: The agarose gel electrophoresis results of 2 rounds of PCR with different dilution of templates using primers P12, P13 and P15 for S4 samples. Lanes 1-3 are the results of 2 rounds of PCR amplification using primers P12, P13 and P15, respectively, and product templates from 1 round of PCR without dilution; lanes 4-6 are using primers P12, P13 and P15, respectively, and product templates from 1 round of PCR with 1∶10 dilution. D: The agarose gel electrophoresis results of 2 rounds of PCR with different amplification system using primers P12, P13 and P15 for S4 samples. Lanes 1-3 are the results of 2 rounds of PCR amplification using primers P12, P13 and P15, respectively, and 1∶100 dilution of 1 round of PCR product templates in 50 μL amplification system; lanes 4-6 are the results of 2 rounds of PCR amplification using primers P12, P13 and P15, respectively, and 1∶100 dilution of 1 round of PCR product templates in 20 μL amplification system. PCR: Polymerase chain reaction; M: DL2000 molecular weight marker. |
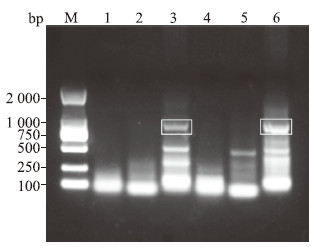
取S1(123 IU/mL)和S2(165 IU/mL)样本,分别使用引物P12、P13和P15进行两轮PCR扩增,进一步验证引物的特异性。两轮PCR扩增的反应体系及条件与上述相同,第二轮PCR扩增中模板为1∶10稀释的第一轮扩增产物。使用引物P15和P12对S1和S2样本的两轮PCR扩增产物经琼脂糖凝胶电泳证实均为非特异性扩增,并出现较多的引物二聚体(图 3)。使用引物P13(目的基因片段大小为971 bp)进行两轮PCR扩增,电泳所示约在1 000 bp的位置出现目的条带(图 3),切割引物P13扩增产物(第3泳道和第6泳道)胶回收后进行DNA测序,因样本核酸浓度过低导致测序失败。进一步将第3和第6泳道条带胶回收后,将DNA与T载体连接,连接物转化至感受态细胞并挑选单克隆菌落进行克隆测序,测序结果经BLAST比对证实为HBV DNA S区基因。引物P13对3例低病毒载量样本(S1、S2、S4样本)的扩增均有较好的特异性,因此选择P13作为最优引物进行后续血清样本HBV DNA S区基因扩增。
|
图 3 选择引物P12、P13和P15的自建两轮PCR扩增结果 Fig 3 Amplification results of self-built 2-round PCR using primers P12, P13 and P15 Lanes 1-3 are the agarose gel electrophoresis results of 2 rounds of PCR using primers P15, P12 and P13 for S1 samples, respectively; lanes 4-6 are the agarose gel electrophoresis results of 2 rounds of PCR using primers P15, P12 and P13 for S2 samples, respectively. The boxes are the gel cut area for recovery. PCR: Polymerase chain reaction; M: DL2000 molecular weight marker. |
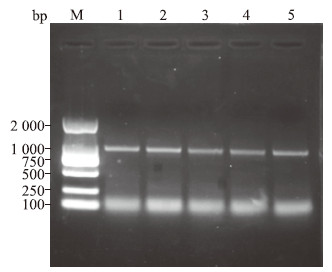
确定两轮PCR使用P13引物及50 μL总反应体系后,随机挑选5例更低HBV DNA载量的OBI血清样本A1(22.8 IU/mL)、A2(36.7 IU/mL)、A3(53.5 IU/mL)、A4(30.5 IU/mL)和A5(28.6 IU/mL)进行进一步的验证。结果如图 4所示,在约1 000 bp的位置均出现目的特异性条带(目的基因片段大小为971 bp),但条带亮度较弱,故切割条带胶回收PCR扩增产物,进行PCR产物克隆测序。测序结果经BLAST比对均为HBV DNA S区基因。
|
图 4 5例更低HBV DNA载量血清样本的自建两轮PCR扩增HBV DNA S基因的验证结果 Fig 4 Validation results of self-built 2-round PCR amplification for HBV DNA S-gene from 5 serum samples with lower-load HBV DNA Lanes 1-5 are the agarose gel electrophoresis results of PCR products for samples A1-A5, respectively. HBV: Hepatitis B virus; PCR: Polymerase chain reaction; M: DL2000 molecular weight marker. |
2.3 28例OBI血清样本HBV DNA S区基因两轮PCR扩增结果
采用自建两轮PCR法对28例OBI血清样本HBV DNA S区基因进行扩增,其中6例低HBV DNA载量的样本均成功扩增出特异性靶序列,扩增产物经克隆测序确认为HBV DNA S区基因。22例更低HBV DNA载量的血清样本中有15例(68.18%)成功扩增出HBV DNA S区基因,且扩增出的目的基因条带清晰可见,经PCR产物克隆测序均证实为HBV DNA S区基因。15例获得成功扩增HBV DNA S区基因的样本中有8例HBV DNA载量<30 IU/mL,最低为20.1 IU/mL。
3 讨论目前我国仍是HBV高感染国家,在实验诊断工作中经常会遇到少见的HBV血清学表现模式,如HBsAg和乙型肝炎表面抗体(hepatitis B surface antibody,HBsAb)同时存在、HBsAg阴性但乙型肝炎e抗体(hepatitis B e antibody,HBeAb)阳性、HBsAg阴性但HBV DNA阳性、仅乙型肝炎核心抗体强阳性等,甚至不同的诊断试剂检测HBsAg结果不一致。这些血清学诊断的少见模式往往与HBV DNA S区基因突变,尤其是“a”决定簇内点突变有关[8]。HBsAg阴性而HBV DNA阳性此种OBI现象的存在对HBV感染血清学诊断指标的检测带来极大挑战,也对临床慢性乙型肝炎的预防和筛查、治疗及输血安全性等带来巨大隐患[6]。探究和分析造成OBI的原因是提高我国HBV感染血清学诊断试剂质量的重要环节,而HBV DNA S区基因测序是必备的研究手段。
由于OBI血清中HBV DNA载量很低,HBV DNA S区基因片段的大小可达680 bp,采用常规PCR技术很难扩增出能供进一步研究分析的S区全长基因片段。对从近万份血清样本中筛选获得的28份OBI血清样本进行HBV DNA S区基因测序分析,必须从血清样本中扩增出S区全长基因片段。本研究决定采用文献中广泛报道的巢式PCR法,这是目前OBI临床样本HBV DNA S区基因扩增的主流方法。综合文献和我国广泛流行的HBV基因型B型和C型序列,本研究设计了3对引物P1~P3用于巢式PCR,并对模板最适浓度、PCR总反应体系、引物总量、退火温度等实验条件进行优化。然而,6例低HBV DNA载量的血清样本中仅2例经巢式PCR扩增出HBV DNA S区基因特异性靶序列,22例更低HBV DNA载量的血清样本也无一例扩增成功。分析认为巢式PCR失败的原因主要存在以下几个方面:(1)因荧光定量PCR检测试剂盒的核酸提取工艺、引物设计存在差异,导致对HBV DNA载量的检测下限有所不同。本研究中采用高灵敏HBV DNA检测试剂盒,检测下限可至10 IU/mL,灵敏度较高。因此,本研究获得的大部分OBI血清样本HBV DNA载量<50 IU/mL,相较大部分文献中OBI样本病毒载量更低,从而导致常规巢式PCR扩增失败。(2)在设计巢式PCR引物时未能很好地考虑HBV基因的多种亚型,本研究中引物的设计主要针对B型和C型序列。(3)采用20 μL PCR反应体系造成目的基因产物偏少。考虑到三轮巢式PCR需多次PCR扩增,还会对测序分析的真实性带来影响,故放弃。
针对以上研究出现的问题,本研究选择国内主要HBV基因亚型相对保守的位点重新设计引物,3条正向引物、4条反向引物,共组合成12对,包含K、R 2个简并碱基。考虑到OBI血清中HBV DNA浓度低,一轮PCR很难扩增出可满足测序或连接克隆载体的靶DNA片段所需的量。因此,将一轮PCR产物作为模板,使用相同的引物再次进行PCR扩增,以增加产物含量。将临床样本S4样本(HBV DNA载量147 IU/mL)DNA作为模板筛选这12对引物扩增的有效性,经过一轮PCR只有引物P12、P13和P15扩增出目的基因,但因目的基因扩增产物较少,无法满足测序和连接载体的要求。使用P12、P13和P15分别对各自一轮PCR扩增的产物再次扩增,两轮PCR扩增后,仅P13扩增出较为明显的特异性条带。继而,以P13为引物,对一轮PCR产物模板浓度、引物的量、退火温度、PCR反应体系等进行了优化,从而确定最佳实验条件。以最佳实验条件对22例更低HBV DNA载量样本和6例低载量的样本进行HBV DNA S区基因扩增,6例低载量的样本全部成功,22例更低HBV DNA载量样本中15例扩增出HBV DNA S区基因,其中最低HBV DNA载量仅20.1 IU/mL,且所有PCR产物均经过测序确认。为了分析7例更低HBV DNA载量血清样本未获得成功扩增的原因,对原始7例样本核酸模板采用高灵敏HBV DNA检测试剂盒进行复检,发现7例复测后均为阴性。我们认为,这或许与前期实验中提取的核酸模板未进行分管保存,在后续实验中存在反复冻融现象引起裸露的DNA分子降解有关,也可能是假阳性。
综上所述,本实验自建的两轮PCR法更适用于低HBV DNA载量样本中HBV DNA S区基因的扩增,引物设计简便、有效,扩增效率和特异性均优于传统的巢式PCR。该方法为进一步研究OBI患者HBV DNA S区基因突变、正确解释HBsAg检测失败现象、深入探究HBsAg突变株与OBI的相关性奠定了良好的方法学基础。同时,多轮PCR方法的思路也可扩展于其他目的DNA低载量时的PCR扩增,为科学研发灵敏度高、特异性高的核酸检测试剂提供了理论依据。
| [1] |
World Health Organization. Hepatitis B[EB/OL]. (2021-07-27)[2021-08-01]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-b.
|
| [2] |
ZHANG K, LIU Y, CHEN R, LI Q, XU Z, SI L, et al. Antigenicity reduction contributes mostly to poor detectability of HBsAg by hepatitis B virus (HBV) S-gene mutants isolated from individuals with occult HBV infection[J]. J Med Virol, 2018, 90: 263-270. DOI:10.1002/jmv.24936 |
| [3] |
疾病预防控制局. 我国控制乙肝成效显著[EB/OL]. (2013-07-26)[2021-03-21]. http://www.nhc.gov.cn/jkj/s3582/201307/518216575e544109b2caca07fca3b430.shtml.
|
| [4] |
PAK K, ORDWAY S, TORRES D. Occult HBV infection: a case series at a military treatment facility[J/OL]. Mil Med, 2020, 185: e795-e798. DOI: 10.1093/milmed/usz379.
|
| [5] |
RAIMONDO G, LOCARNINI S, POLLICINO T, LEVRERO M, ZOULIM F, LOK A S; Taormina Workshop on Occult HBV Infection Faculty Members. Update of the statements on biology and clinical impact of occult hepatitis B virus infection[J]. J Hepatol, 2019, 71: 397-408. DOI:10.1016/j.jhep.2019.03.034 |
| [6] |
ELTOM K, ALBEELY A, EL HUSSEIN ARM, ELKHIDIR I M, ENAN K. Occult hepatitis B virus infection in Sudan: a systematic review and meta-analysis[J]. JGH Open, 2020, 4: 800-807. DOI:10.1002/jgh3.12411 |
| [7] |
MAK L Y, WONG D K, POLLICINO T, RAIMONDO G, HOLLINGER F B, YUEN M F. Occult hepatitis B infection and hepatocellular carcinoma: epidemiology, virology, hepatocarcinogenesis and clinical significance[J]. J Hepatol, 2020, 73: 952-964. |
| [8] |
ZHANG L, CHANG L, LAPERCHE S, JI H, ZHAO J, JIANG X, et al. Occult HBV infection in Chinese blood donors: role of N-glycosylation mutations and amino acid substitutions in S protein transmembrane domains[J]. Emerg Microbes Infect, 2019, 8: 1337-1346. DOI:10.1080/22221751.2019.1663130 |
 2021, Vol. 42
2021, Vol. 42


