2018年全球癌症统计报告显示,作为常见的恶性肿瘤之一,食管癌的发病率和死亡率分别居所有癌症的第7位和第6位[1]。2015年中国癌症统计数据显示,我国食管癌发病率和死亡率分别居所有癌症的第3位和第4位[2]。尽管近年来医疗水平不断提高,但食管癌患者的5年生存率并不理想[3],亟待寻找有效的食管癌治疗靶点以改变食管癌的治疗模式、提高患者生存率。
miRNA是一类18~24个核苷酸组成的非编码RNA,能与靶基因的3′末端非翻译区(3′-untranslated region,3′-UTR)结合调控靶基因的翻译,进而参与调控细胞的增殖、周期、分化等生理过程。同样,在肿瘤的起始与发展过程中miRNA也具有重要作用[4],调控其表达水平可改变下游靶基因的抑癌或致癌作用,在食管癌的诊断和治疗方面有巨大的应用潜力和前景[5]。
本团队前期研究发现,分化抑制因子3(inhibitors of DNA binding/differentiation 3,ID3)在食管鳞状细胞癌的发生和发展中起重要作用,它通过激活下游的ERK/MAPK信号通路调控食管鳞状细胞癌细胞的增殖、迁移、侵袭和上皮间质转化,且其高表达与不良预后有关,这提示ID3是食管鳞状细胞癌的一个重要治疗靶点[6]。目前ID3在食管鳞状细胞癌中的调控机制仍不完全清楚,本研究旨在探索ID3的上游调控机制,为食管癌的靶向治疗提供理论依据。
1 材料和方法 1.1 临床样本、细胞和试剂收集海军军医大学(第二军医大学)长海医院胸外科2020年10-12月收治的12例食管鳞状细胞癌患者的手术切除肿瘤组织样本和肿瘤旁正常食管组织(距肿瘤边缘3~5 cm)样本,用于研究miRNA和ID3在食管癌中的表达水平及两者的关系。纳入标准:(1)术后病理诊断为食管鳞状细胞癌;(2)术前未经放射治疗、化学治疗或免疫治疗等相关治疗;(3)无其他脏器恶性肿瘤;(4)临床及病理资料完整。本研究通过海军军医大学(第二军医大学)长海医院医学伦理委员会审批,所有患者均知情同意。
人食管鳞状细胞癌细胞系Eca109细胞由中国科学院上海分院细胞库提供。用含有10% FBS与1%双抗(青霉素和链霉素)的DMEM培养基贴壁培养细胞,培养箱条件为37 ℃、5% CO2。miRNA-224-5p、miRNA-27a-3p、miRNA-27b-3p、miRNA-515-5p、miRNA-149-5p、miRNA-491-3p、miRNA-561-3p、miRNA-138-5p、miRNA-128-3p、miRNA-340-5p、miRNA-212-5p模拟物(mimic)和抑制剂(inhibitor)及miRNA-340-5p模拟物和抑制剂的阴性对照均购自上海吉玛制药技术有限公司;ID3和GAPDH抗体购自美国Proteintech公司(货号分别为10389-1-AP、10494-1-AP);抗兔IgG购自美国CST公司(货号7074);反转录试剂盒及qRT-PCR试剂盒购自日本TaKaRa公司;Gibco® DMEM培养基、Gibco® FBS、Gibco® 0.25%胰酶、Gibco® Opti-MEM培养基、LipofectamineTM 2000和TRIzol试剂均购自美国ThermoFisher Scientific公司;1%双抗购自美国HyClone/GE公司。
1.2 细胞转染培养Eca109细胞生长至融合度为60%~70%时,按照LipofectamineTM 2000转染试剂盒说明书将miRNA模拟物、miRNA抑制剂及阴性对照(miRNA-NC)分别转入细胞内。培养4 h后更换新鲜培养基,在37 ℃、5% CO2条件下培养24~48 h,收集细胞。
1.3 qRT-PCR按照TRIzol试剂、反转录试剂盒及qRT-PCR试剂盒说明书分别进行总RNA提取、反转录和PCR扩增,具体操作步骤参照文献[7]。引物的设计与合成由上海吉玛制药技术有限公司完成,miRNA-27a-3p正向引物序列为5′-UUCACAGUGGCUAAGUUCCGC-3′,反向引物序列为5′-GGAACUUAGCCACUGUGAAUU-3′;miRNA-27b-3p正向引物序列为5′-UUCACAGUG-GCUAAGUUCUGC-3′,反向引物序列为5′-AGA-ACUUAGCCACUGUGAAUU-3′;miRNA-128-3p正向引物序列为5′-UCACAGUGAACCGGUCUC-UUU-3′,反向引物序列为5′-AGAGACCGGUUC-ACUGUGAUU-3′;miRNA-138-5p正向引物序列为5′-AGCUGGUGUUGUGAAUCAGGCCG-3′,反向引物序列为5′-GCCUGAUUCACAACACCAG-CUUU-3′;miRNA-149-5p正向引物序列为5′-UC-UGGCUCCGUGUCUUCACUCCC-3′,反向引物序列为5′-GAGUGAAGACACGGAGCCAGAUU-3′;miRNA-212-5p正向引物序列为5′-ACCUUGGC-UCUAGACUGCUUACU-3′,反向引物序列为5′-UAAGCAGUCUAGAGCCAAGGUUU-3′;miRNA-224-5p正向引物序列为5′-UCAAGUC- ACUAGUGGUUCCGUUUAG-3′,反向引物序列为5′-AAACGGAACCACUAGUGACUUGAUU-3′;miRNA-340-5p正向引物序列为5′-UUAUAAA-GCAAUGAGACUGAUU-3′,反向引物序列为5′-UCAGUCUCAUUGCUUUAUAAUU-3′;miRNA-491-3p正向引物序列为5′-CUUAUGC-AAGAUUCCCUUCUAC-3′,反向引物序列为5′-AGAAGGGAAUCUUGCAUAAGUU-3′;miRNA-515-5p正向引物序列为5′-UUCUCCAA-AAGAAAGCACUUUCUG-3′,反向引物序列为5′-GAAAGUGCUUUCUUUUGGAGAAUU-3′;miRNA-561-3p正向引物序列为5′-CAAAGUUU-AAGAUCCUUGAAGU-3′,反向引物序列为5′-UUCAAGGAUCUUAAACUUUGUU-3′;内参照基因U6正向引物序列为5′-CTCGCTTCGGCAG- CACA-3′,反向引物序列为5′-AACGCTTCACG-AATTTGCGT-3′。ID3正向引物序列为5′-TGT-CCTGACACCTCCAGAACG-3′,反向引物序列为5′-TCACAGTCCTTCGCTCCTGA-3′;内参照基因GAPDH正向引物序列为5′-GGAGCGAGATCCC-TCCAAAAT-3′,反向引物序列为5′-GGCTGTTG-TCATACTTCTCATGG-3′。
1.4 蛋白质印迹法检测取收集的细胞,依次进行总蛋白质提取、浓度测定、电泳、转膜和显影,具体操作步骤参照文献[7]。一抗ID3和内参照GAPDH抗体稀释比例分别为1∶1 000和1∶5 000,二抗抗兔IgG稀释比例为1∶4 000。
1.5 CCK-8实验将各组的细胞计数后分别接种至96孔板,每孔约5 000个细胞/100 μL,每组设3个复孔,置于37 ℃培养箱培养。将细胞贴壁后的时间点设为0 h,分别于0、24、48、72 h时加入10 μL CCK-8试剂,用酶标仪测定450 nm波长处的光密度(D)值。
1.6 平板克隆形成实验取对数生长期的Eca109细胞,用0.25%胰酶消化并吹打成单细胞悬液,计数后取适量细胞接种在6孔板中,再加入2 mL含10% FBS的DMEM培养基,并转动吹打使细胞分散均匀,置于培养箱中培养10 d。待肉眼可见克隆时终止培养,弃上清,用PBS洗2次后,每孔加入1 mL 4%多聚甲醛液固定细胞15 min。弃多聚甲醛溶液,加1 mL 1%结晶紫溶液染色10 min,晾干后于显微镜下计数并拍照。
1.7 Transwell实验消化各组细胞,离心后用PBS清洗2次,加入无血清培养基重悬细胞并计数。Transwell上室加入300 μL吹打均匀的细胞悬液,下室加入500 μL含10% FBS的DMEM培养基。用无菌镊子将小室放入24孔板里,注意切勿产生气泡。培养24 h后,取出小室弃去培养基,用PBS洗2次,然后用棉签轻轻擦掉上层未迁移的细胞。置入4%多聚甲醛溶液中固定15 min后风干,加入1%结晶紫溶液染色10 min,晾干后于显微镜下拍照。
1.8 双荧光素酶报告实验将ID3基因的3′-UTR野生型和突变型序列插入报告基因载体pmiRGlo,再共转染miRNA-340-5p模拟物至Eca109细胞,测定各组荧光强度并计算相对荧光素酶活力。详细操作步骤参照文献[7]。
1.9 生物信息学分析使用综合性预测和验证miRNA靶基因的数据库miRWalk(http://zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk/micrornapredictedtarget.html)预测miRNA与基因的结合情况。
1.10 统计学处理应用SPSS 24软件进行统计学分析。对于计量资料,首先检测数据是否符合正态分布且方差齐,呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验。相关分析采用Pearson相关性分析。检验水准(α)为0.05。
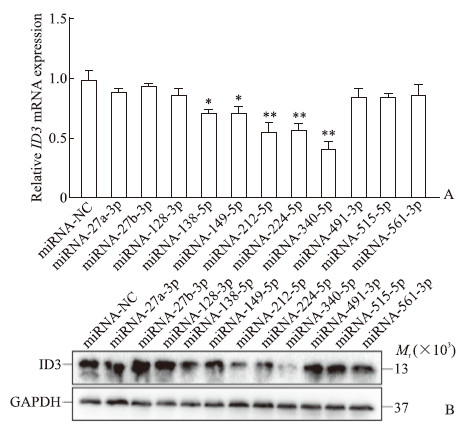
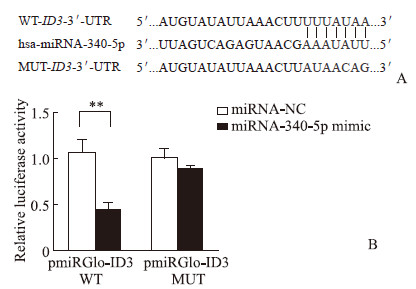
2 结果 2.1 miRNA-340-5p靶向调控ID3表达的筛选和验证通过生物信息学分析筛选能直接调控ID3的miRNA。利用miRWalk数据库预测出11个最有可能(Score class:Very high)与ID3 3′-UTR结合的miRNA,分别为miRNA-224-5p、miRNA-27a-3p、miRNA-27b-3p、miRNA-515-5p、miRNA-149-5p、miRNA-491-3p、miRNA-561-3p、miRNA-138-5p、miRNA-128-3p、miRNA-340-5p、miRNA-212-5p。将相同浓度(80 nmol/L)的11种miRNA模拟物瞬时转染进入Eca109细胞,通过qRT-PCR与蛋白质印迹法检测ID3的表达水平,结果显示miRNA-340-5p在转录和翻译水平均可导致ID3表达最大程度的下降(图 1)。利用TargetScan软件分析miRNA-340-5p与ID3的潜在结合位点,结果如图 2A所示。双荧光素酶报告基因实验结果(图 2B)显示,miRNA-340-5p抑制ID3 3′-UTR野生型质粒转染Eca109细胞的双荧光素酶活性(P<0.01),而对突变型质粒转染细胞的双荧光素酶活性无显著影响,进一步证明了miRNA-340-5p能直接结合ID3基因。
|
图 1 11种miRNA模拟物转染对人食管鳞状细胞癌Eca109细胞中ID3表达水平的影响 Fig 1 Effects of 11 miRNA mimics on ID3 expression levels in human esophageal squamous carcinoma Eca109 cells A: The ID3 mRNA expression was detected using quantitative real-time polymerase chain reaction; B: The ID3 protein expression was detected using Western blotting. *P < 0.05, **P < 0.01 vs miRNA-NC group. n=3, x±s. miRNA: MicroRNA; ID3: Inhibitors of DNA binding/differentiation 3; NC: Negative control; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
|
图 2 miRNA-340-5p与ID3基因的结合位点及双荧光素酶报告基因实验验证结果 Fig 2 Binding sites of miRNA-340-5p to ID3 gene and dual-luciferase reporter assay validation results A: The potential binding site of miRNA-340-5p and ID3 gene; B: The results of dual-luciferase reporter assay. **P < 0.01. n=3, x±s. miRNA: MicroRNA; ID3: Inhibitors of DNA binding/differentiation 3; NC: Negative control; WT: Wild type; 3′-UTR: 3′-untranslated region; hsa: Homo sapiens; MUT: Mutant type. |
2.2 miRNA-340-5p和ID3在食管鳞状细胞癌组织中的表达及相关性
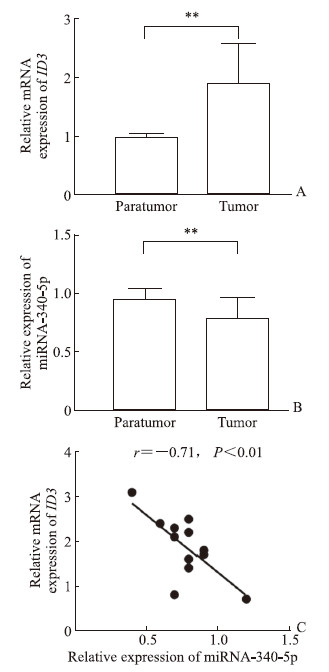
采用qRT-PCR检测12例新鲜食管鳞状细胞癌组织及相应的癌旁正常组织中miRNA-340-5p和ID3 mRNA的表达水平,结果显示,相比癌旁正常组织,ID3 mRNA在食管鳞状细胞癌组织中高表达(P<0.01,图 3A),miRNA-340-5p在食管鳞状细胞癌组织中低表达(P<0.01,图 3B)。Pearson相关性分析显示,食管鳞状细胞癌组织中miRNA-340-5p和ID3 mRNA的表达水平呈负相关(r=-0.71,P<0.01,图 3C)。
|
图 3 食管鳞状细胞癌组织中miRNA-340-5p和ID3的表达及相关性分析 Fig 3 Expression and correlation analysis of miRNA-340-5p and ID3 in esophageal squamous cell carcinoma tissues A: Relative mRNA expression of ID3 in 12 paired tumor and paratumor tissues detected by quantitative real-time polymerase chain reaction; B: Relative expression of miRNA-340-5p in 12 paired tumor and paratumor tissues detected by quantitative real-time polymerase chain reaction; C: Pearson correlation analysis between miRNA-340-5p and ID3 mRNA expression in esophageal squamous cell carcinoma tissues. **P < 0.01. n=12, x±s. miRNA: MicroRNA; ID3: Inhibitors of DNA binding/differentiation 3. |
2.3 miRNA-340-5p抑制Eca109细胞的增殖、迁移与侵袭
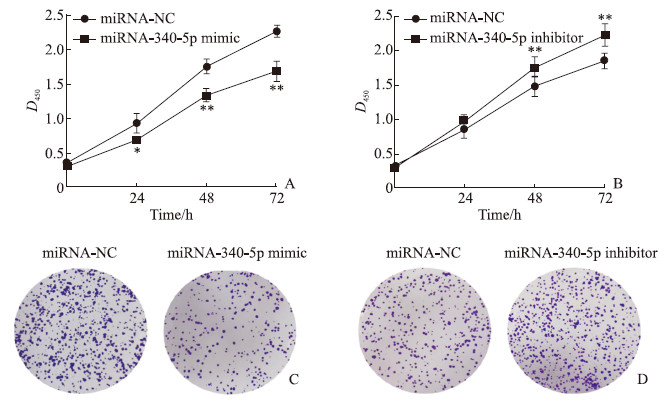
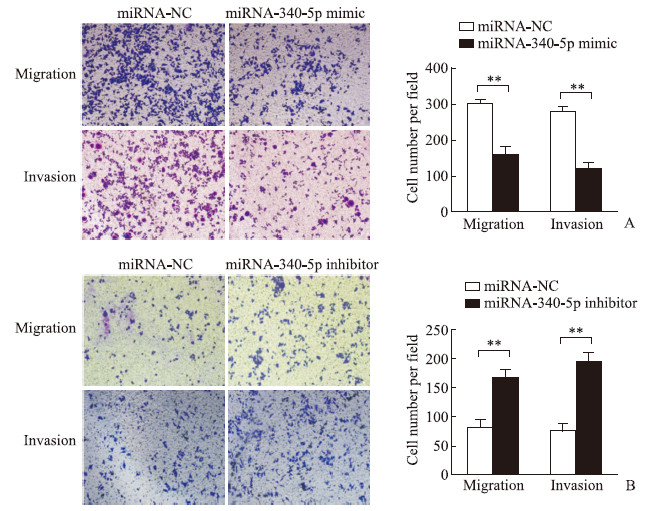
CCK-8检测结果(图 4A、4B)显示,miRNA-340-5p模拟物能抑制Eca109细胞的增殖,在细胞培养24、48、72 h时与对照组相比差异均有统计学意义(P<0.05或P<0.01);miRNA-340-5p抑制剂可促进Eca109细胞的增殖,在细胞培养48、72 h时与对照组相比差异均有统计学意义(P均<0.01)。平板克隆形成实验结果(图 4C、4D)显示,与对照组相比,转染miRNA-340-5p模拟物后Eca109细胞的克隆数减少(89.67±11.90 vs 269.33±11.47,P<0.01),而转染miRNA-340-5p抑制剂后Eca109细胞的克隆数增多(269.00±12.68 vs 125.00±7.79,P<0.01)。Transwell实验结果(图 5)显示,与对照组相比,miRNA-340-5p模拟物能抑制Eca109细胞的迁移与侵袭(P均<0.01),而miRNA-340-5p抑制剂能促进Eca109细胞的迁移与侵袭(P均<0.01)。
|
图 4 miRNA-340-5p抑制人食管鳞状细胞癌Eca109细胞的增殖 Fig 4 miRNA-340-5p inhibiting proliferation of human esophageal squamous carcinoma Eca109 cells A, B: Cell counting kit 8 assay showed that miRNA-340-5p decreased the proliferation ability of Eca109 cells; C, D: Representative pictures (100×) of colony formation assay and the results demonstrated that miRNA-340-5p decreased the colony numbers of Eca109 cells. *P < 0.05, **P < 0.01 vs miRNA-NC group. n=3, x±s. miRNA: MicroRNA; NC: Negative control. |
|
图 5 miRNA-340-5p抑制人食管鳞状细胞癌Eca109细胞的迁移与侵袭 Fig 5 miRNA-340-5p inhibiting migration and invasion of human esophageal squamous carcinoma Eca109 cells A: Representative pictures (200×) of Transwell assay and the analysis results showed that miRNA-340-5p mimics decreased the migratory and invasive abilities of Eca109 cells; B: Representative pictures (200×) of Transwell assay and the analysis results showed that miRNA-340-5p inhibitors increased the migratory and invasive abilities of Eca109 cells. **P < 0.01. n=3, x±s. miRNA: MicroRNA; NC: Negative control. |
3 讨论
食管癌发病隐匿,早期多无症状,超过半数的患者就诊时已进入中晚期,5年生存率不足30%[8]。以手术、放射、化学、靶向和免疫治疗为主的综合治疗是早、中期食管癌的主要治疗手段,但经过治疗的早、中期食管癌5年生存率也仅为30%~50%[3]。经治疗后局部复发和远处转移是影响食管癌患者预后的主要因素之一,这与肿瘤细胞较强的增殖和侵袭能力密切相关。近年来靶向治疗虽在肺癌和乳腺癌等恶性肿瘤治疗中取得了一定进展,但在食管癌治疗中进展较为缓慢。从分子水平上寻找新型靶点以抑制食管鳞状细胞癌细胞的增殖和侵袭、减少肿瘤复发与转移是治疗食管鳞状细胞癌的策略之一[9]。
ID3是分化抑制因子(inhibitors of DNA binding/differentiation,ID)家族中的一员,该家族成员还包括ID1、ID2和ID4。生理条件下,ID蛋白参与调控细胞分化和细胞周期,在组织器官的生长、发育过程中扮演着重要角色。异常表达ID蛋白可能会造成细胞增殖失控,进而导致肿瘤形成,目前已在多种肿瘤中观察到ID蛋白失调[10]。ID1~3在多数肿瘤中被证实为致癌基因,而ID4则被认为是抑癌基因。有关食管癌中ID蛋白的研究较少,本课题组之前报道了ID1和ID4在食管癌中的功能及相关机制[11-12]。本课题组还发现,ID3能够激活Harvery鼠肉瘤病毒癌基因诱导的ERK/MAPK信号通路,促进食管鳞状细胞癌细胞的增殖、迁移、侵袭和上皮间质转化,这提示ID3或许是食管鳞状细胞癌的一个重要治疗靶点[6]。
miRNA是近年来研究较为成熟的一类非编码RNA,参与转录后基因表达调控。它没有开放阅读框,不能编码蛋白质,主要通过调控靶基因的表达发挥功能,若表达失调可能会导致下游靶基因(癌基因或抑癌基因)表达异常,进而导致肿瘤发生与进展,已在多种肿瘤中观察到miRNA表达失调[13]。本研究通过miRWalk数据库筛选出11个可能与ID3基因结合的miRNA,通过qRT-PCR及蛋白质印迹法检测发现miRNA-340-5p所引起的ID3表达下调最为明显,提示miRNA-340-5p最有可能与ID3基因结合,并通过双荧光素酶报告基因实验进一步证实了miRNA-340-5p可直接结合ID3基因的3′-UTR,进而抑制后者的表达。
已有研究证实miRNA-340-5p与肿瘤细胞的增殖、凋亡、迁移、耐药等密切相关,是一个极具潜力的治疗靶点[14]。miRNA-340-5p在乳腺癌、结直肠癌、脑胶质瘤、肝癌、非小细胞肺癌等肿瘤组织中表达下调,发挥抑癌作用;而在少数肿瘤如胃癌、甲状腺癌中表达上调,发挥致癌作用。此外,miRNA-340-5p在部分肿瘤患者血清中稳定表达且与肿瘤的预后关系密切,因此其在临床上具有重要的诊断价值。
有关miRNA-340-5p在食管癌中的研究较少,且目前对于它在食管癌中的功能尚有争议。Wang等[15]研究发现,miRNA-340-5p通过调控靶基因磷酸肌酶-3-激酶3的表达促进食管鳞状细胞癌细胞增殖,提示miRNA-340-5p发挥致癌作用。而与此研究相反,Zhang等[16]和Yan等[17]研究发现miRNA-340-5p通过下调同源盒基因B2和磷酸丝氨酸转氨酶1抑制食管鳞状细胞癌细胞的增殖、迁移和侵袭,从而发挥抑癌作用。本研究结果显示miRNA-340-5p在食管鳞状细胞癌组织中低表达,通过靶向ID3基因抑制Eca109细胞增殖、迁移与侵袭,这提示miRNA-340-5p在食管鳞状细胞癌中发挥抑癌作用,与文献[16-17]报道结果一致,不同的是miRNA-340-5p通过直接靶向ID3发挥抑癌作用。之前本课题组已发现ID3在食管鳞状细胞癌中充当癌基因的作用,以上多项研究结果为进一步完善miRNA-340-5p的抑癌机制提供了理论依据。
近年来,将miRNA作为靶点用于恶性肿瘤治疗是肿瘤研究领域的一大热点。例如,运用纳米颗粒运载针对miRNA的药物可稳定、精确地将药物送到肿瘤部位,有效地休眠或清除肿瘤细胞[18-19]。本研究从体外实验初步证实了miRNA-340-5p在食管鳞状细胞癌治疗方面的有效性。
本研究有一定的局限性。第一,主要在细胞层面探索了miRNA-340-5p在食管鳞状细胞癌中的生物学功能,今后的研究中将加入动物实验进行验证。第二,只选取了12例食管鳞状细胞癌组织验证miRNA-340-5p与ID3的表达情况,尽管已初步证明两者的表达水平相关,但样本量较小,证据性不强。
综上所述,miRNA-340-5p可通过靶向ID3基因抑制食管鳞状细胞癌细胞的增殖、迁移和侵袭,从而延缓食管癌进展,其或许将成为食管鳞状细胞癌的潜在治疗靶点。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
CHEN W, ZHENG R, BAADE P D, ZHANG S, ZENG H, BRAY F, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115-132. DOI:10.3322/caac.21338 |
| [3] |
ALLEMANI C, MATSUDA T, DI CARLO V, HAREWOOD R, MATZ M, NIKŠI M, et al. Global surveillance of trends in cancer survival 2000-14(CONCORD-3): analysis of individual records for 37513025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391: 1023-1075. DOI:10.1016/S0140-6736(17)33326-3 |
| [4] |
RUPAIMOOLE R, SLACK F J. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases[J]. Nat Rev Drug Discov, 2017, 16: 203-222. DOI:10.1038/nrd.2016.246 |
| [5] |
HARADA K, BABA Y, ISHIMOTO T, SHIGAKI H, KOSUMI K, YOSHIDA N, et al. The role of microRNA in esophageal squamous cell carcinoma[J]. J Gastroenterol, 2016, 51: 520-530. DOI:10.1007/s00535-016-1161-9 |
| [6] |
WANG X Y, ZHAO Y, FEI X, LU Q J, LI Y, YUAN Y, et al. LEF1/Id3/HRAS axis promotes the tumorigenesis and progression of esophageal squamous cell carcinoma[J]. Int J Biol Sci, 2020, 16: 2392-2404. DOI:10.7150/ijbs.47035 |
| [7] |
WANG X Y, ZHAO Y, LU Q J, FEI X, LU C J, LI C G, et al. MiR-34a-5p inhibits proliferation, migration, invasion and epithelial-mesenchymal transition in esophageal squamous cell carcinoma by targeting LEF1 and inactivation of the hippo-YAP1/TAZ signaling pathway[J]. J Cancer, 2020, 11: 3072-3081. DOI:10.7150/jca.39861 |
| [8] |
LIU Y, XIONG Z, BEASLEY A, D'AMICO T, CHEN X L. Personalized and targeted therapy of esophageal squamous cell carcinoma: an update[J]. Ann N Y Acad Sci, 2016, 1381: 66-73. DOI:10.1111/nyas.13144 |
| [9] |
YANG Y M, HONG P, XU W W, HE Q Y, LI B. Advances in targeted therapy for esophageal cancer[J/OL]. Signal Transduct Target Ther, 2020, 5: 229. DOI: 10.1038/s41392-020-00323-3.
|
| [10] |
ROSCHGER C, CABRELE C. The Id-protein family in developmental and cancer-associated pathways[J/OL]. Cell Commun Signal, 2017, 15: 7. DOI: 10.1186/s12964-016-0161-y.
|
| [11] |
ZHAO Y, ZHU J, SHI B, WANG X, LU Q, LI C, et al. The transcription factor LEF1 promotes tumorigenicity and activates the TGF-β signaling pathway in esophageal squamous cell carcinoma[J/OL]. J Exp Clin Cancer Res, 2019, 38: 304. DOI: 10.1186/s13046-019-1296-7.
|
| [12] |
WANG X, LU Q, FEI X, ZHAO Y, SHI B, LI C, et al. Expression and prognostic value of Id-4 in patients with esophageal squamous cell carcinoma[J]. Onco Targets Ther, 2020, 13: 1225-1234. DOI:10.2147/OTT.S230678 |
| [13] |
GOODALL G J, WICKRAMASINGHE V O. RNA in cancer[J]. Nat Rev Cancer, 2021, 21: 22-36. DOI:10.1038/s41568-020-00306-0 |
| [14] |
HUANG Z, XU Y S, WAN M P, ZENG X X, WU J M. miR-340:a multifunctional role in human malignant diseases[J]. Int J Biol Sci, 2021, 17: 236-246. DOI:10.7150/ijbs.51123 |
| [15] |
WANG X B, GU M, JU Y J, ZHOU J Y. PIK3C3 acts as a tumor suppressor in esophageal squamous cell carcinoma and was regulated by miR-340-5p[J/OL]. Med Sci Monit, 2020, 26: e920642. DOI: 10.12659/MSM.920642.
|
| [16] |
ZHANG Z, LIANG X, REN L, ZHANG S, LI S, WAN T, et al. LINC00662 promotes cell viability and metastasis in esophageal squamous cell carcinoma by sponging miR-340-5p and upregulating HOXB2[J]. Thorac Cancer, 2020, 11: 2306-2315. DOI:10.1111/1759-7714.13551 |
| [17] |
YAN S, JIANG H, FANG S, YIN F, WANG Z, JIA Y, et al. MicroRNA-340 inhibits esophageal cancer cell growth and invasion by targeting phosphoserine aminotransferase 1[J]. Cell Physiol Biochem, 2015, 37: 375-386. DOI:10.1159/000430361 |
| [18] |
GIBORI H, ELIYAHU S, KRIVITSKY A, BEN-SHUSHAN D, EPSHTEIN Y, TIRAM G, et al. Amphiphilic nanocarrier-induced modulation of PLK1 and miR-34a leads to improved therapeutic response in pancreatic cancer[J/OL]. Nat Commun, 2018, 9: 16. DOI: 10.1038/s41467-017-02283-9.
|
| [19] |
TIRAM G, SEGAL E, KRIVITSKY A, SHREBERK-HASSIDIM R, FERBER S, OFEK P, et al. Identification of dormancy-associated microRNAs for the design of osteosarcoma-targeted dendritic polyglycerol nanopolyplexes[J]. ACS Nano, 2016, 10: 2028-2045. DOI:10.1021/acsnano.5b06189 |
 2021, Vol. 42
2021, Vol. 42


