2. 海军军医大学(第二军医大学)海军医学系舰船辐射医学防护教研室, 上海 200433;
3. 海军军医大学(第二军医大学)长海医院内分泌科, 上海 200433
2. Department of Marine Radiation Medicine, Faculty of Naval Medicine, Naval Medical University(Second Military Medical University), Shanghai 200433, China;
3. Department of Endocrinology, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China
随着核能在军事、医疗和能源等领域的广泛应用,电离辐射对人类健康的影响越来越引起人们的关注。国际癌症研究机构全球癌症观测站报告,2018年全球新增癌症病例总数超过1 800万(https://gco.iarc.fr/)。有50%~60%的癌症患者需要应用放射治疗[1]。由于医学成像和图像引导干预的需要,美国的电离辐射总暴露剂量从1980年到2014年增加了6倍[2]。男性生殖系统对电离辐射极为敏感,即使是非常低的剂量也会对精原细胞造成显著的损伤[3-4]。目前对于男性生殖系统电离辐射损伤还缺乏良好的辐射防护措施[5],寻找安全、有效的辐射防护剂对于防护男性生殖系统电离辐射损伤具有重要意义。
H2是自然状态下最小的气体分子,无色、无味且无毒。由于人体内缺乏代谢H2的酶,H2在医学领域一直被认为是一种惰性气体。2007年,Ohsawa等[6]报道H2通过选择性清除羟自由基和硝基过氧化物阴离子,可有效减轻氧化应激导致的损伤。之后陆续有研究发现,H2在缺血/再灌注损伤、器官移植、代谢综合征、炎症和急性放射病等领域发挥了保护性作用。其中,H2的辐射防护效应已经在多项体内、外研究中得到证实,尤其值得关注[7]。本课题组前期研究也表明,富H2溶液在动物水平和细胞水平都有较好的辐射防护效果[8-9]。本研究以小鼠精原细胞系GC-1细胞为研究对象,观察在细胞培养系统中添加H2对GC-1细胞的辐射防护效果,探讨H2的辐射防护作用机制,为H2在辐射防护方面的研究提供理论和实验基础。
1 材料和方法 1.1 细胞、试剂与仪器小鼠精原细胞系GC-1细胞购自通派(上海)生物科技有限公司,培养类型为贴壁培养。
CCK-8试剂盒购自美国MCE公司(货号:59920),膜联蛋白Ⅴ-FITC细胞凋亡试剂盒购自美国BD公司(货号:0027279),2’, 7’-二氯二氢荧光素二乙酸酯(2’, 7’-dichlorodihydrofluoresceindiacetate,DCFH-DA)荧光探针和线粒体膜电位JC-1荧光探针试剂盒购自武汉伊莱瑞特生物科技股份有限公司(货号:E-CK-A301和E-BC-K138-F),β-actin和细胞色素c(cytochrome c,Cyt-c)抗体购自美国Proteintech公司(货号:66009-I-Ig和10993-1-AP),B淋巴细胞瘤相关蛋白x(B-cell lymphoma-associated protein x,Bax)抗体购自美国ABclone公司(货号:A12009),cleaved-caspase 3(caspase 3活化产物)抗体购自美国Affinity公司(货号:AF7022),抗兔IgG购自武汉赛维尔生物科技有限公司(货号:GB23303),BCA蛋白浓度测定试剂盒购自杭州碧云天生物技术有限公司(货号:P0010S)。
SynergyNeo2型酶标仪(美国BioTek公司),CytoFlex型流式细胞仪(美国Beckman Counter公司),Axio Vert.A1型荧光显微镜(德国ZEISS公司)。辐射源为海军军医大学(第二军医大学)海军医学系舰船辐射医学防护教研室辐照中心60Co辐射源。
1.2 细胞处理与照射将GC-1细胞分为4组:对照组、H2组、照射组和照射加H2组。照射组和照射加H2组细胞予60Co γ射线单次照射,累积辐射剂量为8 Gy(剂量率为0.897 Gy/min)。H2组和照射加H2组细胞在照射前使用自行设计的H2细胞培养系统(75% H2、20% O2和5% CO2,图 1)培养1 h。照射后将GC-1细胞放入不含H2的细胞培养箱中继续培养,并进行后续实验。

|
图 1 H2细胞培养系统 Fig 1 H2 cell culture system |
1.3 CCK-8法检测细胞活力
照射前24 h,将状态良好的对数生长期GC-1细胞铺于4块96孔板中,每组1块96孔板,设5个复孔,每孔接种5 000个细胞。照射后24 h更换为100 µL含10 µL CCK-8试剂的培养基。继续在细胞培养箱内孵育2 h,用酶标仪检测450 nm波长处的光密度(D)值。
1.4 流式细胞术检测细胞凋亡采用膜联蛋白Ⅴ-FITC/PI双染流式细胞术检测GC-1细胞凋亡情况。照射前24 h,将状态良好的对数生长期GC-1细胞铺于4块6孔板中,每组1块6孔板,设3个复孔,每孔接种3×105个细胞。照射后24 h,用不含EDTA的胰酶消化细胞,用原细胞培养基终止消化。采用预冷的PBS洗涤细胞3次,加入100 µL预冷的结合缓冲液重悬细胞。加入膜联蛋白Ⅴ-FITC和PI各5 µL,室温避光孵育20 min。加入400 µL预冷的结合缓冲液,上流式细胞仪检测。
1.5 细胞活性氧(reactive oxygen species,ROS)检测采用DCFH-DA荧光探针法检测GC-1细胞内ROS水平。照射前24 h,将状态良好的对数生长期GC-1细胞铺于4块24孔板中,每组1块24孔板,设3个复孔,每孔接种5×104个细胞。照射后2 h弃培养基,用PBS洗涤1次,加入500 μL的DCFH-DA(10 μmol/L)染液,置于细胞培养箱内孵育20 min。用清洗液清洗2次,加入1 mL细胞培养基,在显微镜下拍照分析。
1.6 细胞线粒体膜电位检测采用JC-1荧光探针法检测细胞线粒体膜电位。当线粒体膜电位较高时,JC-1聚集在线粒体的基质中形成聚合物(JC-1 aggregate),产生红色荧光;当线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,为单体(JC-1 monomer),产生绿色荧光。照射前24 h,将状态良好的对数生长期GC-1细胞铺于4块24孔板中,每组1块24孔板,设3个复孔,每孔接种5×104个细胞。照射后2 h弃培养基,用PBS洗涤1次,加入500 μL JC-1工作液,置于细胞培养箱内孵育20 min。用JC-1染色缓冲液清洗2次,加入1 mL细胞培养基,在显微镜下拍照分析。
1.7 蛋白质印迹法照射前24 h,将状态良好的对数生长期GC-1细胞铺于4块6孔板中,每组1块6孔板,每孔接种5×104个细胞。照射后24 h于冰上用含0.1%蛋白酶抑制剂和磷酸酶抑制剂的蛋白质裂解液裂解细胞,超声破碎细胞后离心,得到细胞蛋白。采用BCA蛋白浓度测定试剂盒测蛋白浓度后,依次上样、电泳、电转膜、封闭、标记一抗、洗膜、标记二抗和洗膜,最后加HRP标记的显影液,曝光分析。
1.8 统计学处理应用SPSS 13.0软件进行统计学分析,应用GraphPad Prism 8.0软件绘图。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 H2升高照射后GC-1细胞活力CCK-8检测结果显示,照射组GC-1细胞的活力[(93.00±2.03)%]较对照组[(100.00±3.49)%]降低(P<0.01),照射加H2组细胞活力[(102.76±4.93)%]较照射组升高(P<0.01)。结果表明H2对电离辐射导致的GC-1细胞活力降低有防护作用。
2.2 H2缓解照射后GC-1细胞凋亡率升高流式细胞术检测结果(图 2)显示,照射组GC-1细胞凋亡率[(27.54±1.68)%]较对照组[(16.90±0.08)%]升高(P<0.01),照射加H2组细胞凋亡率[(21.10±0.40)%]较照射组降低(P<0.01)。结果表明H2对电离辐射导致的GC-1细胞凋亡率升高有防护作用。
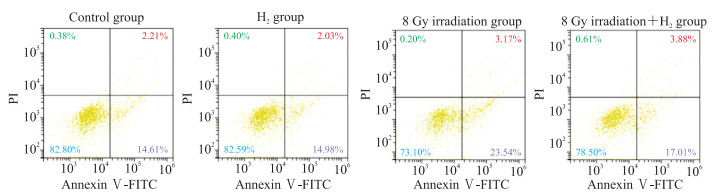
|
图 2 流式细胞术检测小鼠精原细胞GC-1的凋亡率 Fig 2 Apoptosis rate of mouse spermatogonia GC-1 detected by flow cytometry PI: Propidium iodide; FITC: Fluorescein isothiocyanate. |
2.3 H2缓解照射后GC-1细胞内ROS水平的升高
DCFH-DA荧光探针法检测结果(图 3)显示,照射组GC-1细胞内ROS水平(灰度值219.41±10.44)较对照组(灰度值80.46±14.43)升高(P<0.01),照射加H2组细胞内ROS水平(灰度值143.37±10.26)较照射组降低(P<0.01)。结果表明H2能缓解电离辐射后GC-1细胞内ROS水平的升高。
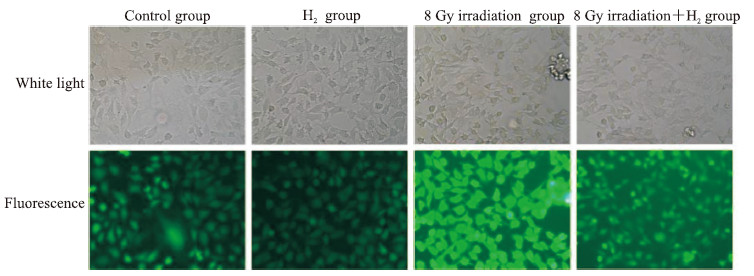
|
图 3 DCFH-DA荧光探针法检测小鼠精原细胞GC-1内ROS水平(200×) Fig 3 ROS level in mouse spermatogonia GC-1 detected by DCFH-DA fluorescence probe (200×) DCFH-DA: 2', 7'-dichlorodihydrofluorescein diacetate; ROS: Reactive oxygen species. |
2.4 H2缓解照射后GC-1细胞内线粒体膜电位降低
JC-1荧光探针法检测结果(图 4)显示,照射组GC-1细胞内线粒体膜电位(JC-1聚合物/单体1.50±0.05)较对照组(JC-1聚合物/单体2.17±0.10)降低(P<0.01),照射加H2组细胞内线粒体膜电位(JC-1聚合物/单体1.65±0.04)较照射组升高(P<0.05)。结果表明H2能缓解电离辐射诱导的GC-1细胞内线粒体膜电位降低。
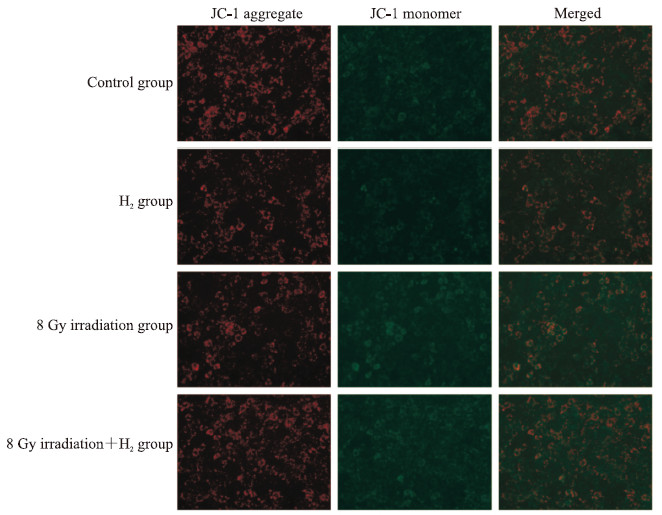
|
图 4 JC-1荧光探针法检测小鼠精原细胞GC-1内线粒体膜电位(200×) Fig 4 Mitochondrial membrane potential of mouse spermatogonia GC-1 detected by JC-1 fluorescence probe (200×) |
2.5 H2缓解照射后GC-1细胞中线粒体凋亡通路蛋白的表达升高
蛋白质印迹法检测结果(图 5)显示,照射组GC-1细胞中Bax、Cyt-c和cleaved-caspase 3的表达水平(分别为0.49±0.03、0.49±0.03、0.76±0.04)均高于对照组(分别为0.26±0.03、0.11±0.02、0.24±0.02,P均<0.01),而照射加H2组细胞中Bax、Cyt-c和cleaved-caspase 3的表达水平(分别为0.40±0.03、0.33±0.03、0.53±0.02)均低于照射组(P<0.05或P<0.01)。结果表明H2能缓解电离辐射后GC-1细胞中线粒体凋亡通路蛋白的表达水平升高。
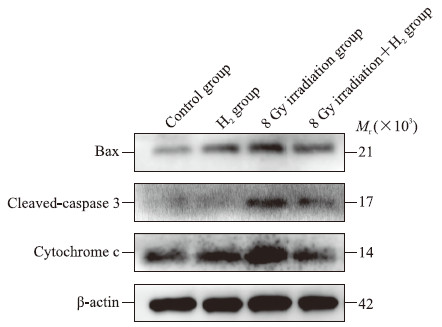
|
图 5 蛋白质印迹法检测小鼠精原细胞GC-1中线粒体凋亡通路蛋白的表达 Fig 5 Expression of mitochondrial apoptosis pathway proteins in mouse spermatogonia GC-1 detected by Western blotting Bax: B-cell lymphoma-associated protein x. |
3 讨论
本研究结果发现,H2对8 Gy γ射线照射后GC-1细胞有防护效应。CCK-8检测结果显示,照射加H2组于照射后24 h细胞活力相较照射组升高(P<0.01)。膜联蛋白Ⅴ-FITC/PI双染流式细胞术检测结果显示,照射加H2组于照射后24 h细胞凋亡率相较照射组降低(P<0.01)。这些结果表明,H2可以增加辐射后GC-1细胞的活力、降低辐射后的细胞凋亡率、减轻细胞的辐射损伤。
电离辐射对机体的损伤分为直接效应和间接效应,其中后者占据主导地位。间接辐射损伤的核心机制是电离使生物体内的水分子发生辐射分解反应,产生诸如超氧阴离子(O2-)、过氧化氢、羟自由基(•OH)及一氧化氮等ROS或活性氮自由基,进而攻击生物大分子。线粒体是细胞生存、死亡和信号转导所必需的细胞器,是产生ROS的主要细胞器之一,同时也是ROS的损伤靶点[10]。在正常的生理条件下,由线粒体产生的ROS被细胞的抗氧化防御系统清除。一旦ROS产生过度,就会导致过量自由基积累,从而损害线粒体和细胞[11]。在细胞凋亡过程中,外部刺激如辐射也可导致线粒体膜孔形成,降低线粒体膜电位。线粒体膜电位的降低是线粒体功能障碍的主要表现,会导致线粒体电子传递链的缺陷和ATP合成障碍[12]。线粒体膜电位降低也是细胞凋亡早期的特征,会导致促凋亡蛋白Cyt-c释放,诱导细胞凋亡。本研究结果表明,H2可以降低照射后GC-1细胞内ROS的水平、抑制线粒体膜电位的降低,对细胞内线粒体起保护作用。
目前,公认的细胞凋亡通路主要有3条,分别是以Fas介导的caspase 8激活为标志的死亡受体通路、以caspase 9和caspase 3激活为标志的线粒体通路及内质网通路[13-15]。细胞受到凋亡刺激(如γ射线、ROS过高)后会引起Bax与B淋巴细胞瘤2同源拮抗剂(B-cell lymphoma 2 antagonist/killer,Bak)形成低聚物复合体,插入到线粒体外膜孔隙,导致线粒体渗透压改变、跨膜电位丢失,促使Cyt-c从线粒体释放到细胞质。Cyt-c与细胞凋亡激活因子1结合形成凋亡复合体,活化caspase 9前体,从而激活caspase 3和caspase 7引发caspase级联反应,进而诱发细胞凋亡[16]。本研究结果表明,H2可以抑制照射后GC-1细胞内Bax和Cyt-c的表达、抑制caspase 3的激活,最终抑制线粒体凋亡通路的激活,发挥电离辐射损伤防护效应。
综上所述,H2对GC-1细胞具有较好的辐射防护作用,作用机制与其清除ROS、保护线粒体膜电位、抑制线粒体凋亡通路有关,在辐射防护方面有广泛的应用前景。
| [1] |
ROSENBLATT E, IZEWSKA J, ANACAK Y, PYNDA Y, SCALLIET P, BONIOL M, et al. Radiotherapy capacity in European countries: an analysis of the Directory of Radiotherapy Centres (DIRAC) database[J/OL]. Lancet Oncol, 2013, 14: e79-e86. DOI: 10.1016/S1470-2045(12)70556-9.
|
| [2] |
FAZEL R, GERBER T C, BALTER S, BRENNER D J, CARR J J, CERQUEIRA M D, et al. Approaches to enhancing radiation safety in cardiovascular imaging: a scientific statement from the American Heart Association[J]. Circulation, 2014, 130: 1730-1748. DOI:10.1161/CIR.0000000000000048 |
| [3] |
DE FELICE F, MARCHETTI C, MARAMPON F, CASCIALLI G, MUZII L, TOMBOLINI V. Radiation effects on male fertility[J]. Andrology, 2019, 7: 2-7. DOI:10.1111/andr.12562 |
| [4] |
FUKUNAGA H, BUTTERWORTH K T, YOKOYA A, OGAWA T, PRISE K M. Low-dose radiation-induced risk in spermatogenesis[J]. Int J Radiat Biol, 2017, 93: 1291-1298. DOI:10.1080/09553002.2017.1355579 |
| [5] |
DEL-POZO-LÉRIDA S, SALVADOR C, MARTÍNEZ-SOLER F, TORTOSA A, PERUCHO M, GIMÉNEZ-BONAFÉ P. Preservation of fertility in patients with cancer (Review)[J]. Oncol Rep, 2019, 41: 2607-2614. |
| [6] |
OHSAWA I, ISHIKAWA M, TAKAHASHI K, WATANABE M, NISHIMAKI K, YAMAGATA K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13: 688-694. DOI:10.1038/nm1577 |
| [7] |
HU Q, ZHOU Y, WU S, WU W, DENG Y, SHAO A. Molecular hydrogen: a potential radioprotective agent[J/OL]. Biomed Pharmacother, 2020, 130: 110589. DOI: 10.1016/j.biopha.2020.110589.
|
| [8] |
CHUAI Y, SHEN J, QIAN L, WANG Y, HUANG Y, GAO F, et al. Hydrogen-rich saline protects spermatogenesis and hematopoiesis in irradiated BALB/c mice[J]. Med Sci Monit, 2012, 18: BR89-BR94. |
| [9] |
CHUAI Y, GAO F, LI B, ZHAO L, QIAN L, CAO F, et al. Hydrogen-rich saline attenuates radiation-induced male germ cell loss in mice through reducing hydroxyl radicals[J]. Biochem J, 2012, 442: 49-56. DOI:10.1042/BJ20111786 |
| [10] |
GOTTLIEB R A. Mitochondria and apoptosis[J]. Biol Signals Recept, 2001, 10(3/4): 147-161. |
| [11] |
ZOROV D B, FILBURN C R, KLOTZ L O, ZWEIER J L, SOLLOTT S J. Reactive oxygen species (ROS)-induced ROS release: a new phenomenon accompanying induction of the mitochondrial permeability transition in cardiac myocytes[J]. J Exp Med, 2000, 192: 1001-1014. DOI:10.1084/jem.192.7.1001 |
| [12] |
VAYSSIERE J L, PETIT P X, RISLER Y, MIGNOTTE B. Commitment to apoptosis is associated with changes in mitochondrial biogenesis and activity in cell lines conditionally immortalized with Simian virus 40[J]. PNAS, 1994, 91: 11752-11756. DOI:10.1073/pnas.91.24.11752 |
| [13] |
LI X, FANG F, GAO Y, TANG G, XU W, WANG Y, et al. ROS induced by KillerRed Targeting Mitochondria (mtKR) enhances apoptosis caused by radiation via Cyt c/caspase-3 pathway[J/OL]. Oxid Med Cell Longev, 2019, 2019: 4528616. DOI: 10.1155/2019/4528616.
|
| [14] |
OBEXER P, AUSSERLECHNER M J. X-linked inhibitor of apoptosis protein-a critical death resistance regulator and therapeutic target for personalized cancer therapy[J/OL]. Front Oncol, 2014, 4: 197. DOI: 10.3389/fonc.2014.00197.
|
| [15] |
MA L, WEI J, WAN J, WANG W, WANG L, YUAN Y, et al. Low glucose and metformin-induced apoptosis of human ovarian cancer cells is connected to ASK1 via mitochondrial and endoplasmic reticulum stress-associated pathways[J/OL]. J Exp Clin Cancer Res, 2019, 38: 77. DOI: 10.1186/s13046-019-1090-6.
|
| [16] |
XIONG S, MU T, WANG G, JIANG X. Mitochondria-mediated apoptosis in mammals[J]. Protein Cell, 2014, 5: 737-749. DOI:10.1007/s13238-014-0089-1 |
 2021, Vol. 42
2021, Vol. 42


