外科医师在甲状腺病变手术中常使用快速冷冻切片获得术中病理诊断,指导甲状腺手术方式及确定手术范围[1]。甲状腺组织的血供及细胞极为丰富且常伴有囊肿,又由于其滤泡腔内含有黏液样胶质,这些因素在组织速冻(-25~-20 ℃)的条件下极易影响冷冻切片的制片质量,进而影响术中病理诊断的时限性及准确性。甲状腺组织的速冻与回暖方法目前尚无统一的标准,相关研究也较少。本研究通过比较不同速冻与回暖方法处理的甲状腺组织冷冻切片制片质量的差异,旨在寻找一种较佳的甲状腺组织速冻与回暖方法,以更好地为其术中病理诊断与临床手术服务。
1 资料和方法 1.1 研究资料收集2020年1月至2020年6月我院病理科的非微小甲状腺结节(结节最大径>1 cm)冷冻切片标本90例。90例患者的年龄为22~68岁,中位年龄为43岁。本研究通过我院伦理委员会审批。
1.2 主要设备Thermo CryoStsr NX50型冷冻切片机(美国ThermoFisher Scientific公司)及配置冰锤。DAKEWE型全自动染色机(中国达科为医疗设备有限公司)。一种自制病理冰冻切片冰锤组件(ZL 2013 2 0590429.1)。自制的病理冰冻切片冰锤组件由套筒及冰锤组成(图 1)。其中,套筒为圆柱形,壁厚0.3 cm,外壁光滑,内壁设有螺纹,底部至上延伸形成2个对称的观察窗;冰锤与套筒相吻合,外侧面设有外螺纹,顶部设有手柄,通过旋转手柄可使冰锤的高度沿套筒轴向上下移动。使用时,将套筒固定在放有组织的托头上方,冰锤套置于套筒内,观察组织的厚度后手动旋转冰锤手柄,调整冰锤上下移动至适当的高度,接触组织块,速冻。

|
图 1 自制病理冰冻切片冰锤组件 A:组装前;B:组装后.①套筒;②冰锤. |
1.3 实验前准备与取材
设置冷冻切片机的温度(夹头-17 ℃,冷冻台-25 ℃),制作备用"冰垫"托头(将少量包埋剂加在金属托头上速冻)。选取已完成快速术中病理诊断后剩余的新鲜甲状腺组织,每例切取质地与用于诊断的组织相近、大小约为1.5 cm×1.5 cm×0.3 cm的组织。以下实验中所述组织均按该标准获取。
1.4 不同速冻方法甲状腺组织冷冻切片制备选取新鲜甲状腺组织标本50例,每例标本切取3块组织立即置于预先制备的"冰垫"托头上,添加适量的冷冻切片包埋剂,将托头连同组织放置于冷冻切片机的冷冻台,并随机分为A、B、C 3组。A组组织直接放置于冷冻切片机的冷冻台上进行速冻(不加盖冰锤);B组组织放置于冷冻台上后,加盖冷冻切片机配置的冰锤加快速冻;C组组织放置于冷冻台上后,加盖专利冰锤组件加快速冻。对3组速冻后的组织均进行厚度为6 μm冷冻切片,切片后立即放入95%乙醇内固定30 s,然后使用DAKEWE型全自动染色机进行H-E染色。比较不同速冻方法处理的甲状腺组织冷冻切片的速冻时效及制片质量。染色步骤参考贾双双等[2]的研究方法,甲状腺组织冷冻切片的速冻时效定义为将组织标本放置于冷冻切片机冷冻台上至刚冻成冻块的时间。
1.5 不同回暖方法甲状腺组织冷冻切片的制备选取新鲜的甲状腺组织标本40例,每例标本切取组织4块随机设为D、E、F、G 4组,并将组织置于事先准备的"冰垫"托头上,加包埋剂后置于冷冻台并于组织上方加盖专利冷冻冰锤。速冻后组织分别按如下实验步骤进行回暖:D组的冻块移至-17~-14 ℃的平台上回暖30 s;E组的冻块用戴手套的手指温暖切面1~2 s;F组的冻块不回暖直接切片;G组的冻块移至冷冻切片机外常温回暖30 s。然后对D、E、F、G 4组组织分别进行切片,切片后立即放入95%乙醇固定30 s,采用DAKEWE型全自动染色机进行H-E染色,吹干后树胶封固,显微镜下观察甲状腺组织冷冻切片的无裂隙、无冰晶得分情况。
1.6 冷冻切片制片质量观察指标(1) 冷冻切片质量评分标准:镜下切片的组织结构完整、无裂隙、无冰晶各计10分;组织结构略不完整、裂隙及冰晶无或少见,尚不影响镜下观察,各减1~2分;组织结构较不完整、裂隙及冰晶较多见,一定程度上影响镜下观察,各减3~6分;组织结构不完整、裂隙及冰晶多见,严重影响镜下观察,各减7~10分。由2名质控师进行双盲阅片,以得分均值为每项指标的数据。
(2) 细胞核及细胞质形态变化评分标准:镜下切片的细胞核或细胞质形态是否受速冻影响而发生形态挤压变形。影响率(%)=累计受影响数/各组切片数×100%。
1.7 诊断符合率由2名副主任及以上职称的病理医师分别对各实验组制备的冰冻切片进行双盲阅片,每个病例以该病例的常规石蜡切片诊断为标准,计算诊断符合率。诊断符合率(%)=2名医师诊断符合的病例总数/2名医师阅片的总病例数×100%。
1.8 统计学处理应用SPSS 20.0软件进行统计学分析。计量资料以x±s表示,任意两组间比较采用配对t检验;计数资料以例数和百分数表示,比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 不同速冻方法对甲状腺组织冷冻切片的影响 2.1.1 速冻时效A、B、C组速冻时效分别为(101.7±0.3)、(62.3±0.3)、(61.7±0.3)s,B、C组速冻时效均短于A组(P均<0.01)。
2.1.2 切片质量评分A、B、C组冷冻切片的质量评价结果见表 1、图 2。B组组织完整评分最低,与A、C组比较差异均有统计学意义(P均<0.01);A组无冰晶评分、无裂隙评分均低于B、C组,差异均有统计学意义(P均<0.01)。
|
|
表 1 不同速冻方法制作的甲状腺组织冷冻切片质量评分 |
|
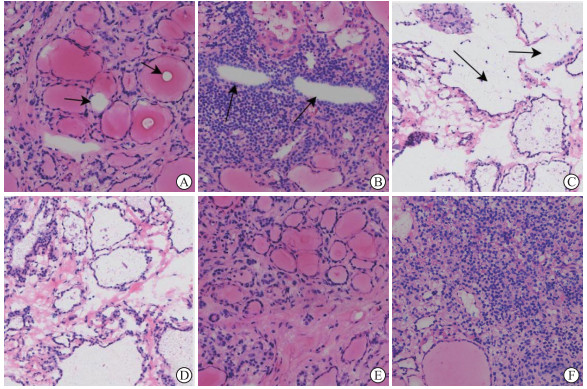
图 2 不同速冻方法制作的甲状腺组织冷冻切片苏木精-伊红染色结果(200×) A:A组冷冻切片有冰晶(箭头所示);B:A组冷冻切片有裂隙(箭头所示);C:B组冷冻切片组织完整性欠佳(箭头所示);D:C组冷冻切片组织完整性较好;E:C组冷冻切片组织冰晶少见;F:C组冷冻切片组织裂隙少见.A组:不加冰锤组;B组:加盖冷冻切片机自带冰锤组;C组:加盖专利冰锤组. |
2.1.3 切片细胞形态
A、B、C组冷冻切片的细胞核影响率均为0(0/50),细胞质影响率分别为0(0/50)、10%(5/50)、0(0/50)。其中B组细胞质影响率与A、C组比较差异均有统计学意义(P均<0.05)。
2.2 不同回暖方法对甲状腺组织冷冻切片质量的影响D、E、F、G组甲状腺组织冷冻切片的无冰晶评分分别为(8.7±0.2)、(7.2±0.2)、(8.5±0.2)、(8.0±0.2)分,无裂隙评分分别为(9.2±0.2)、(9.4±0.1)、(8.7±0.1)、(8.8±0.2)分。E、G组无冰晶评分均低于D组(P<0.01、P<0.05),F组无裂隙评分低于D组(P<0.05)。
2.3 不同回暖方法对甲状腺组织冷冻切片诊断准确性的影响以常规石蜡切片诊断为标准,D、E、F、G组的诊断符合率分别为100.0%(80/80)、91.2%(73/80)、95.0%(76/80)、93.8%(75/80)。D组的诊断符合率高于E、F、G组(P均<0.05)。
3 讨论随着超声引导下细针穿刺活检技术的应用及推广,全球甲状腺癌的发病率呈明显上升趋势[3],特别是甲状腺微小乳头状癌[4]。冷冻切片是一种快速诊断未固定新鲜组织的技术,高质量的冷冻制片是保证术中快速病理诊断准确性、可靠性的重要前提[5-6]。研究表明,有多种因素影响病理冷冻切片的制片质量,如取材、冷冻温度、冷冻时间、切片技术、固定与染色等[7-8],为了提高甲状腺术中冷冻切片病理诊断的准确率,优化甲状腺组织冷冻切片的制片技术和制片质量至关重要。
目前,冷冻切片机已被广泛应用于各大医疗单位的病理技术及相关实验室,各实验室的冷冻切片制片质量也有所差异,这不仅与设备的速冻性能有关,还与操作者的操作习惯密切相关。在日常工作中,笔者发现由于设备速冻性能的下降和术中快速冷冻例数的迅速增加,为了尽快制片、完成术中病理诊断、缩短患者术中的等候时间,病理技术人员常利用冷冻切片机自带冰锤压于组织表面进行速冻。冷冻切片机速冻性能差或组织取材过厚易导致速冻时间过长,造成切片显微镜下冰晶和裂隙形成较多见;冷冻切片机自带冰锤由于其设计缺陷,置于组织上后容易倾斜,从而使组织挤压变形,导致切片在显微镜下观察时组织结构不全,同时在一定程度上影响细胞的形态。因为甲状腺滤泡上皮细胞的细胞质较丰富,本实验中冷冻切片机自带冰锤的使用在一定程度上使细胞质受到挤压,暂未发现其对细胞核的影响。为了解决以上2个缺陷,笔者使用一种病理冷冻切片冰锤组件,该专利冰锤优点如下:(1)套筒及冰锤使用的是比热容合适的材质,能较快加速组织速冻;(2)组合使用时,套筒上的可视窗可直观冰锤下降的距离,依组织厚度调整冰锤的高度,在有效缩短速冻时间的同时不挤压组织,不影响细胞质及细胞核的形态,使用后组织切片在显微镜下观察时冰晶及裂隙情况大大改善。
日常工作中,笔者还发现冻块回暖环节常被忽视。低温下组织易受冰晶与细胞脱水2种因素的损伤,为了提高速冻效率、减少冰晶形成,切取的新鲜甲状腺组织通常是在-25 ℃以下的冷冻台被冻成冻块。-25 ℃以下的甲状腺组织质地极脆,将甲状腺组织冻块移至-17~-14 ℃的平台上回暖30 s,可使组织的表面硬度下降,继而脆性也会降低,这样能显著消除或减少甲状腺冷冻切片裂隙的出现,也能避免回温过高再形成新的冰晶。而如果改为用戴手套的手指温暖组织切面1~2 s后再进行切片,虽也能减少冷冻切片裂隙的产生,但由于手指的温度高于细胞内外水分的结冰点,被回温的这些水分由固态恢复至液态,然后又从液态被冷冻至固态,如此反复冻融显著增加了冰晶的形成[9]。而如果不回暖直接进行切片,由于甲状腺冻块表面硬度过高,易形成显著的切片裂隙。此处,将甲状腺组织冻块移至冷冻切片机外常温回暖,虽能改善冷冻切片的裂隙现象,但也会由于细胞内外的水分被反复冻融而显著增加冰晶的形成,尤为影响冷冻切片的质量及病理诊断。
本实验中使用的专利冰锤制作成本低,值得推广。工作中,笔者发现该专利冰锤在微小甲状腺结节的制片中作用突出,但这一点还需进一步实验证实。对于某些病理实验室使用自带冰锤的冷冻切片机,建议在可疑微小甲状腺结节的冷冻切片制片过程中谨慎选用,以防止冰锤倾斜使组织挤压变形,从而影响可疑微小结节的诊断。
综上所述,在快速术中病理诊断的冷冻切片制作中,使用笔者团队设计的冰锤组件对甲状腺组织加快速冻,且冻成冻块后放至-17~-14 ℃的平台上回暖30 s后进行制片,能够显著提高制片效率、制片质量与病理诊断准确率。
| [1] |
MENON S S, TANDON P, RAMASWAMY B, PUJARY K. A retrospective study to assess the role of using fine needle aspiration cytology and frozen section in the diagnosis of thyroid swelling[J]. Indian J Otolaryngol Head Neck Surg, 2018, 70: 471-476. DOI:10.1007/s12070-018-1503-4 |
| [2] |
贾双双, 邢莉, 张勇. 全自动冷冻切片染色机在病理科的应用[J]. 诊断病理学杂志, 2018, 25: 591-592. |
| [3] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [4] |
PRICE A K, RANDLE R W, SCHNEIDER D F, SIPPEL R S, PITT S C. Papillary thyroid microcarcinoma: decision-making, extent of surgery, and outcomes[J]. J Surg Res, 2017, 218: 237-245. DOI:10.1016/j.jss.2017.05.054 |
| [5] |
ARCEGA R S, WOO J S, XU H. Performing and cutting frozen sections[M]//YONG W H. Biobanking: methods and protocols. Springer; New York, NY, USA, 2019: 279-288.
|
| [6] |
魏雪, 冯翠云, 李颖, 巩雪, 章如松, 饶秋, 等. 脑组织术中快速制片技术在病理诊断中的应用与体会[J]. 诊断病理学杂志, 2020, 27: 516-518. |
| [7] |
STOCKL T, KWAN L, BRADFORD L S, ZWEIZIG S, SELOVE W, LIU Y. Accuracy of frozen section in the diagnosis of gynecological tumors: 5 years of experience from a tertiary center[J/OL]. Gynecol Oncol, 2015, 139: 598. DOI: 10.1016/j.ygyno.2015.09.066.
|
| [8] |
SELOVE W, BRADFORD L S, LIU Y. Assessing residents' frozen section skills for endometrial cancer[J]. Int J Gynecol Pathol, 2016, 35: 402-409. |
| [9] |
KOZLOWSKI T, NARTOWSKA E. Unfrozen water content in representative bentonites of different origin subjected to cyclic freezing and thawing[J/OL]. Vadose Zone J, 2013, 12(1). DOI: 10.2136/vzj2012.0057.
|
 2021, Vol. 42
2021, Vol. 42


