2. 上海交通大学医学院附属新华医院崇明分院超声科, 上海 202150;
3. 上海市杨浦区控江医院超声科, 上海 200082;
4. 上海健康医学院附属嘉定区中心医院超声科, 上海 201800
2. Department of Ultrasound, Chongming Branch of Xinhua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 202150, China;
3. Department of Ultrasound, Kongjiang Hospital of Yangpu District, Shanghai 200082, China;
4. Department of Ultrasound, Jiading Central Hospital, Shanghai University of Medicine & Health Science, Shanghai 201800, China
经腹胃超声(以下简称胃超声)检查的临床研究应用已有近40年历史[1],随着口服超声造影剂的研发与胃超声检查应用经验的不断积累,胃癌的诊断准确性进一步提高,国家卫生健康委员会颁布的《胃癌诊疗规范(2018年版)》将超声检查列为胃癌的常规检查方法之一[2]。但是,迄今临床上对胃超声检查的诊断价值仍未达成共识,这一定程度上限制了胃超声检查简便安全、经济有效、受检者依从性高等技术优势的发挥。本研究基于一组由胃超声首诊检出胃部病灶,并经外科术后和/或胃镜胃黏膜活检病理组织学证实为胃癌的患者资料,总结分析胃超声和胃镜检查结果,进一步探讨和认知胃超声检查在胃癌诊断中的临床应用价值。
1 资料和方法 1.1 研究对象回顾性收集2010年1月至2020年5月,上海交通大学医学院附属新华医院崇明分院(118例)、上海市杨浦区控江医院(5例)和上海健康医学院附属嘉定区中心医院(6例)诊治的129例胃癌患者资料。所有患者均因年龄较大或症状轻微等,不愿意行胃镜检查而首选胃超声检查,在胃超声首诊发现病变后再行胃镜检查,并均经外科术后和/或胃镜胃黏膜活检病理组织学检查确诊胃癌。本研究通过上海交通大学医学院附属新华医院崇明分院伦理委员会审批(LLWYH-2016-14)。
1.2 胃超声检查采用美国Siemens Sequioa 512、美国GE Logiq E9等型号超声诊断仪,探头频率为3.5~5.0 MHz。患者检查前禁食、禁水8 h,检查时饮胃窗声学造影剂(杭州胡庆余堂药业有限公司)500~700 mL。常规采用站立位和平卧位检查,必要时增加左侧卧位和右侧卧位。检查者在胃体表投影区进行连续横断面、矢状面或冠状面等多切面扫查,依次观察贲门、胃底部、胃体部、胃角部、胃窦部、幽门等,重点检测有无胃壁增厚、凹陷性和/或隆起性病变[3-4],并分析胃壁层次结构等。若检出胃部病变则进行局部放大或使用高频探头观察胃壁的层次结构和病灶的形态、大小及与邻近脏器的关系等。
1.3 胃镜检查采用日本OLYMPUS QIF-XQ240型电子胃镜,检查包括贲门、胃底、胃体小弯与大弯侧、胃角和胃窦等在内的全胃[5-6],观察病灶的位置和大小,并行胃黏膜活检术。
1.4 胃癌诊断标准(1) 胃超声胃癌诊断依据:胃壁增厚≥5 mm、层次结构显示不清[7]和胃壁黏膜隆起性或凹陷性病变;病灶累及范围广时包绕胃腔,呈"假肾征";胃周脂肪层回声增高等征象[8]。(2)胃镜胃癌诊断依据:胃黏膜糜烂或溃疡、边缘不规则;局部隆起充血水肿、黏膜色泽改变、皱襞粗糙;胃壁僵硬、蠕动消失和肿物质脆,触之易出血等表现[9]。
1.5 统计学处理应用SPSS 26.0软件进行统计学分析。计量资料以x±s表示,计数资料以例数和百分数表示。采用McNemar方法比较胃镜和胃超声检查的提示性病灶检出率、总体定性诊断准确率和胃不同部位定性诊断准确率。检验水准(α)为0.05。
2 结果 2.1 患者基本资料129例患者中男90例、女39例;年龄为38~94岁,平均年龄为(71.4±10.9)岁;首发临床表现为腹痛腹胀49例,上腹部不适15例,腹部肿块5例,余60例患者因体检或其他原因就诊。
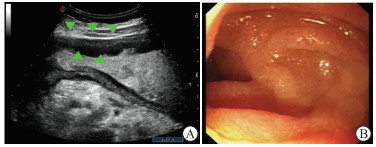
2.2 胃超声和胃镜对病灶的检出结果分析129例胃癌患者共确诊129枚病灶,包括胃窦癌60例(46.5%)、胃体癌31例(24.0%)、胃角癌19例(14.7%)、胃底癌8例(6.2%)、贲门癌6例(4.7%)和残胃癌5例(3.9%);其中进展期胃癌120例(93.0%)、早期胃癌9例(7.0%)。以最终病理组织学诊断为金标准,胃超声检查无假阳性病例,病灶检出率为100.0%(129/129);胃镜检出胃部病灶128例,检出率为99.2%(128/129)。1例胃镜未检出病灶的患者,胃超声检查显示胃窦部胃壁显著增厚,而胃镜检查显示胃黏膜充血水肿及粗大皱褶,未发现其他明显异常(图 1),但术后病理证实为低分化腺癌。129枚胃癌病灶中,胃超声声像图表现为胃壁增厚性病变有60枚(46.5%),胃壁凹陷性病变53枚(41.1%),胃壁隆起性病变16枚(12.4%)。胃超声检查提示,129枚病灶的胃壁最大厚度为5~33 mm,平均最大厚度为(13.5±5.1)mm;病灶长径为25~200 mm,平均长径为(56.8±24.9)mm。
|
图 1 胃窦部低分化腺癌的胃超声和胃镜检查 A:胃超声检查示胃窦部胃壁显著增厚伴层次结构显示不清(三角形所示),黏膜皱褶粗大,胃蠕动减弱;B:胃镜检查示胃窦部黏膜充血水肿、粗大黏膜皱襞,胃蠕动欠佳. |
2.3 胃超声和胃镜对胃癌的诊断准确性分析
以最终病理组织学诊断为金标准,胃超声和胃镜检查对胃癌的诊断准确率分别为74.4%(96/129)和82.2%(106/129),两者差异无统计学意义(P>0.05);胃超声和胃镜检查对胃窦癌、胃体癌、胃角癌、胃底癌、贲门癌、残胃癌的诊断准确率差异均无统计学意义(P均>0.05)。胃超声和胃镜检查诊断准确率最高的部位分别为胃体癌(93.5%)和胃角癌(94.7%),诊断准确率最低的部位分别为胃角癌(47.4%)和胃底癌(62.5%)。见表 1。
|
|
表 1 胃超声和胃镜检查对不同部位胃癌的诊断准确率 |
3 讨论
临床上,胃镜胃黏膜活检是胃癌诊断的金标准。但是,胃镜是有创性检查技术,操作相对复杂,且在没有麻醉配合时患者的依从性和耐受性较差[10]。本组胃癌患者均因年龄较大或症状轻微等不愿意接受胃镜检查而首选胃超声检查,经胃超声检查发现胃壁病变后再行胃镜检查,然后由胃镜胃黏膜活检和/或手术病理组织学检查确诊,表明胃超声检查患者的依从性较高,有效发挥了对胃癌的初筛或先导预警作用。全组129例患者共计129枚病灶,与最终病理组织学诊断对比,胃超声检查无假阳性病例,这提示胃超声有良好的胃壁病变检出能力,即胃超声检查发现胃壁病变时,胃壁存在病变的可信度较高。本组胃超声病灶检出率为100.0%(129/129),胃镜病灶检出率为99.2%(128/129),两者检出率相似。同时,在本组胃超声首诊检出的胃壁病灶中,早期胃癌占7.0%(9/129),结果与国内胃镜早期胃癌的检出率[11]相近。因此,如果患者不具备实施胃镜检查的主客观条件时,适度放宽胃超声检查的适应证并积极推广应用,有望进一步提高临床胃癌检出率。但是,需要指出的是,本组病例的胃癌病灶均较大,以进展期胃癌为主(93.0%),且均为胃超声检出胃壁病灶的病例,因此尚不能认为胃超声对病灶的检出率能达到或等同于胃镜的检出结果。
本组胃癌患者的胃超声检查显示病变胃壁的最大厚度为5~33 mm,平均最大厚度为(13.5±5.1)mm;病灶长径为25~200 mm,平均长径为(56.8±24.9)mm。其中,胃壁增厚性病变占46.5%(60/129),胃壁凹陷性病变占41.1%(53/129),两者合计占87.6%(113/129),胃壁隆起性病变仅占12.4%(16/129),这一结果提示进展期胃癌的声像图表现除了胃壁较厚、病灶较大外,以胃壁增厚性和凹陷性病变为主。本组胃癌病例的胃镜诊断准确率优于胃超声,但差异无统计学意义(P>0.05)。值得关注的是,胃超声检查对胃底癌的诊断准确性稍优于胃镜检查。对此,我们认为胃超声检查胃底部病变时多采取平卧位,此时胃底位置较低,造影剂充盈良好[12-13],声像图中胃底显示较为清晰,有助于检出胃底部病灶。同时,胃超声检查是一项断面成像技术,可动态、多切面、清晰地显示胃壁各层的形态、结构变化特点[14-15],能用于检测胃黏膜和黏膜下病变。因此,对于胃黏膜下病变胃超声检查可发挥其独特优势,弥补胃镜检查的不足[16]。本组1例患者胃超声检出胃窦部胃壁显著增厚,随后的胃镜检查仅显示胃黏膜充血水肿及粗大皱褶,未发现其他明显异常,但术后病理证实为低分化腺癌,可能原因是该例病变以黏膜下浸润为主导致胃镜漏诊。
综上所述,胃超声检查具有简便安全、经济有效和受检者依从性高等优点,在不具备实施胃镜检查的主客观条件时,积极推广应用胃超声检查可进一步提高胃癌的检出率。胃超声和胃镜检查的诊断价值互补,联合应用能进一步提高胃癌的诊断准确率。本研究的主要局限性为回顾性分析,病例收集时间跨度较大、部分病例数据缺失,且未纳入胃超声检查为阴性的病例资料等,这难免导致结果存在偏倚等,胃超声在胃癌诊断中的临床应用价值仍有待进一步验证。
| [1] |
张晨燕, 王惠. 实时超声显像诊断胃部肿瘤的探讨[J]. 实用内科杂志, 1985, 5: 595. |
| [2] |
国家卫生健康委员会. 胃癌诊疗规范(2018年版)[J/CD]. 中华消化病与影像杂志(电子版), 2019, 9: 118-144.
|
| [3] |
SCHLEMPER R J, HIRATA I, DIXON M F. The macroscopic classification of early neoplasia of the digestive tract[J]. Endoscopy, 2002, 34: 163-168. DOI:10.1055/s-2002-19855 |
| [4] |
Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma: 3rd English edition[J]. Gastric Cancer, 2011, 14: 101-112. DOI:10.1007/s10120-011-0041-5 |
| [5] |
BANKS M, GRAHAM D, JANSEN M, GOTODA T, CODA S, DI PIETRO M, et al. British Society of Gastroenterology guidelines on the diagnosis and management of patients at risk of gastric adenocarcinoma[J]. Gut, 2019, 68: 1545-1575. DOI:10.1136/gutjnl-2018-318126 |
| [6] |
BISSCHOPS R, AREIA M, CORON E, DOBRU D, KASKAS B, KUVAEV R, et al. Performance measures for upper gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) quality improvement initiative[J]. Endoscopy, 2016, 48: 843-864. DOI:10.1055/s-0042-113128 |
| [7] |
LIU Z, GUO J, LI J, WANG S, TANG S, XIE L, et al. Gastric lesions: demonstrated by transabdominal ultrasound after oral administration of an echoic cellulose-based gastric ultrasound contrast agent[J]. Ultraschall Med, 2016, 37: 405-411. |
| [8] |
XUE H, GE H Y, MIAO L Y, WANG S M, ZHAO B, WANG J R, et al. Differential diagnosis of gastric cancer and gastritis: the role of contrast-enhanced ultrasound (CEUS)[J]. Abdom Radiol (NY), 2017, 42: 802-809. |
| [9] |
蔡升, 周建波, 桑建忠, 宋奇峰, 杨倩倩, 黄戬, 等. 早期胃癌检出情况及其内镜下特征分析(附43例报道)[J]. 中国内镜杂志, 2018, 24: 94-99. |
| [10] |
ZHENG X Z, ZHANG L J, WU X P, LU W M, WU J, TAN X Y. Oral contrast-enhanced gastric ultrasonography in the assessment of gastric lesions: a large-scale multicenter study[J]. J Ultrasound Med, 2017, 36: 37-47. |
| [11] |
吴云林, 毛峻岭, 吴巍, 黄天生, 陆敏, 陈晓敏, 等. 2013年上海嘉定地区胃镜筛查胃癌漏诊的临床研究[J]. 诊断学理论与实践, 2014(4): 383-387. |
| [12] |
李义红, 李献亮, 韩文峰, 郑亚珍. 胃超声造影诊断食管裂孔疝的价值[J/CD]. 中华医学超声杂志(电子版), 2012, 9: 525-528.
|
| [13] |
马李军, 赵国金. 胃脂肪瘤二例报告[J]. 腹部外科, 2001, 14: 33. |
| [14] |
OKANOBU H, HATA J, HARUMA K, HARA M, NAKAMURA K, TANAKA S, et al. Giant gastric folds: differential diagnosis at US[J]. Radiology, 2003, 226: 686-690. DOI:10.1148/radiol.2263012080 |
| [15] |
LIU Z, GUO J, WANG S, ZHAO Y, LI J, REN W, et al. Evaluation of transabdominal ultrasound after oral administration of an echoic cellulose-based gastric ultrasound contrast agent for gastric cancer[J/OL]. BMC Cancer, 2015, 15: 932. DOI: 10.1007/s00261-013-0059-8.
|
| [16] |
LIU Z, REN W, GUO J, ZHAO Y, SUN S, LI Y, et al. Preliminary opinion on assessment categories of stomach ultrasound report and data system (Su-RADS)[J]. Gastric Cancer, 2018, 21: 879-888. |
 2021, Vol. 42
2021, Vol. 42


