2. 海军军医大学(第二军医大学)长海医院呼吸科, 上海 200433;
3. 海军军医大学(第二军医大学)长海医院病理科, 上海 200433
2. Department of Respiratory Medicine, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China;
3. Department of Pathology, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China
患者女,56岁,因"口腔溃疡伴盗汗、体重减轻近1个月、全身多发淋巴结肿大1周"于2019年8月1日入住海军军医大学(第二军医大学)长海医院血液科。患者于2019年6月初无明显诱因出现口腔黏膜溃疡,伴盗汗、体重减轻,无发热、皮疹、关节痛、胸闷、吞咽困难等不适。2019年6月21日于外院就诊,予地塞米松片口服、碳酸氢钠溶液和康复新液漱口、开喉剑喷雾剂外用,口腔溃疡无好转。2019年7月22日行PET-CT检查示全身多发淋巴结肿大,腹膜后为甚(累及双侧膈角),肠系膜多发结节、肿块,18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)代谢异常增高,淋巴瘤待排除;上、下牙龈FDG代谢增高。为求进一步诊治于2019年8月1日入住海军军医大学(第二军医大学)长海医院血液科。入院后体格检查:口唇红肿,两侧颊黏膜多发散在溃疡灶,表面有白苔覆盖,舌缘有切迹;心、肺、腹未见异常。患者近1个月体重减轻5 kg,其父亲肺癌去世,母亲自然死亡。入院后完善相关检查,查血常规未见明显异常。血生物化学检查示乳酸脱氢酶为197 U/L、β2微球蛋白为2.29 mg/L。巨细胞病毒IgG阳性、EB病毒IgG阳性。乙型肝炎表面抗体、e抗体、核心抗体均阳性,丙型肝炎病毒、梅毒螺旋体和HIV均阴性。自身免疫抗体检查示抗线粒体抗体M2亚型弱阳性、抗多发性肌炎/硬皮病(polymyositis/scleroderma,PM-Scl)抗体弱阳性、抗可提取性核抗原(extractable nuclear antigen,ENA)抗体-SS-A弱阳性,CRP为5.36 mg/L,降钙素原为0.062 ng/L,红细胞沉降率为63 mm/1 h;结核分枝杆菌T细胞斑点试验阴性,脑钠肽、心肌酶、心电图、超声心动图检查均未见异常,腹部及浅表淋巴结超声检查示腹膜后实性包块,大小约为10.4 cm×3.1 cm;肝囊肿。胸部CT检查示右上肺磨玻璃结节,右下肺陈旧灶,心膈角、小网膜囊及腹膜后多发淋巴结肿大。2019年7月30日行CT引导下腹膜后病灶穿刺活检术,术后免疫组织化学染色示CD20(+)、CD5(背景淋巴细胞+)、细胞周期蛋白D1(-)、转录因子T-Bet(个别+)、CD19(+)、CD4(背景淋巴细胞+)、性别决定区Y框蛋白11(sex-determining region of Y-related HMG-box 11,SOX11)(-)、B细胞特异性转录因子抗体(B-cell oct-binding protein 1,Bob.1)(+)、CD8(背景淋巴细胞+)、γ干扰素诱导蛋白16(gamma-interferon-inducible protein 16,IFI16/MNDA)(-)、CD10(-)、配对盒基因5(paired box domain gene 5,Pax5)(+)、CD43(背景淋巴细胞+)、淋巴增强因子1(lymphoid enhancer factor 1,LEF-1)(个别+)、EB病毒潜伏膜蛋白1(Epstein-Barr virus-encoded latent membrane protein 1,LMP-1)(-)、Bcl-2(部分+)、CD15(-)、多发性骨髓瘤基因1(multiple myeloma oncogene 1,MUM1)(少量+)、Bcl-6(+)、CD30(少量+)、程序性细胞死亡受体1(programmed cell death 1,PD-1)(少量+)、zeste同源物增强子2重组蛋白(recombinant enhancer of zeste homolog 2,EZH2)(局灶60%)、CD3(背景淋巴细胞+)、CD23(少量+)、Ki-67(+,局灶60%),诊断为外周B细胞淋巴瘤,考虑为高级别滤泡性淋巴瘤。骨髓活检未见淋巴瘤细胞,EB病毒阴性。
明确诊断后,予R-CHOP-21方案(利妥昔单抗600 mg第0天、环磷酰胺1.2 g第1天、多柔比星脂质体40 mg第1天、长春地辛4 mg第1天、地塞米松15 mg第1~5天)化学治疗3个疗程。疗程中期行PET-CT检查示淋巴瘤化学治疗后,肠系膜根部及腹膜后片絮状软组织密度影,FDG轻度不均匀摄取(最大标准摄取值为2.8)。评估淋巴瘤基本达到完全缓解。化学治疗过程中患者口腔溃疡进行性加重(图 1A),伴明显疼痛,影响进食,请皮肤科会诊后考虑肿瘤相关,予丙种球蛋白20 g每天1次、连续5 d冲击治疗,辅以康复新液湿敷等对症治疗,口腔溃疡无好转。2019年9月20日患者出现发热,体温最高达40 ℃,并逐渐出现胸闷、气喘,9月27日行胸部CT检查示双肺炎症。予抗感染治疗后患者体温得到控制,支气管肺泡灌洗液检查未见明显异常,但口腔溃疡及胸闷、气喘均无好转。通过查阅文献及全科病例讨论后考虑滤泡性淋巴瘤合并副肿瘤性天疱疮和闭塞性细支气管炎。10月5日血气分析结果示pH为7.413,氧分压为61.50 mmHg(1 mmHg=0.133 kPa),二氧化碳分压为46.30 mmHg,实际碳酸氢盐浓度为28.90 mmol/L,标准碳酸氢盐浓度为27.40 mmol/L,功能性氧饱和度为91.80%;复查胸部CT示双肺炎症较前好转、右中肺不张。建议患者行支气管镜下肺组织活检以明确诊断,患者及家属拒绝。遂予吸氧,甲泼尼龙(40 mg每天2次)、丙种球蛋白(20 g每天1次、连续5 d)冲击治疗,阿奇霉素(0.25 g每天1次)口服,以及碳酸氢钠溶液、粒细胞-巨噬细胞集落刺激因子和康复新液治疗口腔溃疡。之后患者口腔溃疡逐渐好转(图 1B),但胸闷、气喘仍无改善。
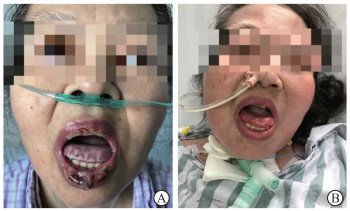
|
图 1 患者口腔溃疡在治疗后好转 A:化学治疗过程中患者口腔溃疡加重;B:患者口腔溃疡经治疗后好转. |
2019年11月5日复查血气分析示pH为7.452,氧分压为45.80 mmHg,二氧化碳分压为51.40 mmHg,实际碳酸氢盐浓度为35.10 mmol/L,标准碳酸氢盐浓度为32.10 mmol/L,功能性氧饱和度为85.00%;再次行胸部CT检查示右肺中叶、左肺下叶实变影,其中可见支气管充气征(图 2)。11月8日予R2方案(利妥昔单抗600 mg第1天、来那度胺25 mg第1~21天)治疗淋巴瘤,同时继续予糖皮质激素、丙种球蛋白冲击治疗。患者胸闷、气喘逐渐加重,肺部影像学异常未见改善。12月18日行支气管镜下左肺下叶外后基底段穿刺活检术,术后出现张力性气胸和皮下气肿,予紧急处理后转入呼吸科ICU治疗,予气管切开、气管插管无创呼吸机辅助通气,其间患者出现感染、呼吸衰竭、心肌损伤等并发症,经积极抗感染(伏立康唑、莫西沙星、亚胺培南西司他丁钠、万古霉素)、营养心肌、纤维支气管镜下检查+肺泡灌洗等治疗后病情得到控制。左肺下叶外后基底段穿刺活检病理结果回报示支气管扩张、管壁增厚、小呼吸道炎症细胞浸润、肉芽组织和纤维组织增生、细支气管旁炎症和纤维化,细支气管腔内充满机化的含有单核细胞和纤维蛋白的渗出液及含有成纤维细胞的肉芽组织(图 3A);免疫组织化学染色示肺泡上皮低分子量细胞角蛋白(low molecular weight cytokeratin,CAM5.2)(+)、细胞角蛋白7(cytokeratin 7,CK7)(+)(图 3B)、NAPSIN A天冬氨酸肽酶重组蛋白(recombinant NAPSIN-A aspartic peptidase,napsin A)(+)、甲状腺转录因子1(thyroid transcription factor 1,TTF1)(+)、Ki-67(-),淋巴细胞CD20(-)、CD3(个别+)、CD4(个别+)、CD8(+)(图 3C)、CD38(-)、Ki-67(-),其他组织中平滑肌肌动蛋白(smooth muscle actin,SMA)(平滑肌+)、CD34(血管+);诊断(左肺下叶,穿刺):符合闭塞性细支气管炎伴纤维蛋白性肺泡炎。2020年1月17日患者再次出现右侧张力性气胸,行右侧胸腔闭式引流术。1月27日再次出现高热、血压不稳,血培养示鲍曼不动杆菌阳性,降钙素原持续升高,诊断为感染性休克、败血症,予积极抗感染治疗效果不佳。1月31日患者出现血压、血氧饱和度进行性下降,最终因感染性休克、呼吸衰竭死亡。

|
图 2 患者胸部计算机断层扫描结果 右肺中叶、左肺下叶实变影,其中可见支气管充气征.A:肺窗;B:纵隔窗. |
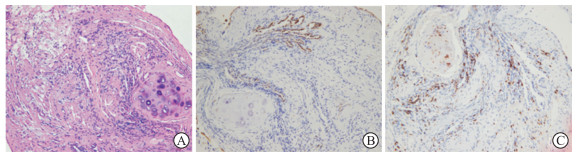
|
图 3 患者左肺下叶外后基底段穿刺活检病理结果(200×) A:苏木精-伊红染色结果示细支气管腔内充满机化的含有单核细胞和纤维蛋白的渗出液及含有成纤维细胞的肉芽组织;B:免疫组织化学染色示肺泡上皮细胞角蛋白7呈阳性;C:免疫组织化学染色示淋巴细胞CD8呈阳性. |
2 讨论
1990年,Anhalt等[1]报道副肿瘤性天疱疮的主要临床特点是痛性黏膜糜烂,伴有多发性皮肤病变、棘层松解症或基底液化变性导致的苔藓样皮炎。副肿瘤性天疱疮临床较为罕见,多为个案报道,其临床表现多样,除皮肤黏膜损害外,可累及多个器官,极易漏诊和误诊。与实体瘤患者相比,多数(84%)血液肿瘤患者伴副肿瘤性天疱疮[1],Morikawa等[2]报道伴副肿瘤性天疱疮的非霍奇金淋巴瘤患者中89%为B细胞淋巴瘤,其中慢性淋巴细胞白血病占43%,滤泡性淋巴瘤占27%,惰性B细胞淋巴瘤占7%,未明确的B细胞淋巴瘤占7%,弥漫性大B细胞淋巴瘤占5%。结果表明副肿瘤性天疱疮在惰性淋巴瘤中发病率较高。本例患者诊断为滤泡性淋巴瘤,是相对较多伴发副肿瘤性天疱疮的肿瘤之一。
口腔黏膜炎通常为副肿瘤性天疱疮的首发临床表现,伴有广泛且顽固的痛性糜烂性溃疡,通常整个嘴唇及唇周均有红肿、糜烂或结痂,舌外侧缘也经常受累,双侧颊黏膜可发生糜烂[3-5]。一项多中心临床研究结果显示,副肿瘤性天疱疮患者的黏膜病变可发生于口腔(82/88,93%)、眼部(33/81,41%)、鼻部(9/77,12%)、生殖器(28/79,35%),其中27%(24/88)的患者仅出现黏膜病变[4]。本例患者首先出现副肿瘤性天疱疮相关临床症状,1个多月后病理检查才确诊滤泡性淋巴瘤。这可能因为滤泡性淋巴瘤属于惰性淋巴瘤,病程发展缓慢、缺乏特异性临床表现,从而使早期诊断较为困难。本例患者在接受3个疗程R-CHOP-21方案化学治疗后,滤泡性淋巴瘤基本达到完全缓解。
除皮肤黏膜受累外,约30%的副肿瘤性天疱疮患者可出现闭塞性细支气管炎[6],滤泡性淋巴瘤同时合并副肿瘤性天疱疮和闭塞性细支气管炎极为罕见。滤泡性淋巴瘤肺部受累的典型临床表现是呼吸困难和低氧血症,胸部影像学表现为双肺多发支气管扩张及其内可见支气管充气征,肺功能检查可见不可逆性阻塞性肺通气功能障碍[7-8]。气道炎症和纤维化被认为是闭塞性细支气管炎的主要病理特征[9]。其可能的发病机制一方面为IgG或补体沉积于支气管柱状上皮,支气管上皮细胞诱导角化不全的上皮细胞脱离并迁移到较小的气道中[3],随后发生的炎症通过CD68+ T细胞促使发生不可逆的纤维化和阻塞[10-11];另一方面,对副肿瘤性天疱疮合并闭塞性细支气管炎的患者进行尸体解剖发现,其肺组织中有CD8+ T细胞和自然杀伤细胞浸润,提示T细胞介导的细胞毒性作用可能参与肺损伤[11]。但闭塞性细支气管炎的诊断较为困难,通常因患者伴有严重呼吸困难、不能耐受支气管镜等有创检查而难以获得病理学诊断证据[12]。闭塞性细支气管炎是副肿瘤性天疱疮的严重并发症,预后极差[7, 13]。2017年Lee等[14]报道了5例滤泡性淋巴瘤合并副肿瘤性天疱疮和闭塞性细支气管炎,其中4例在诊断闭塞性细支气管炎后1~10个月死亡,1例患者获得了目前报道的最长生存期(27个月)。本例患者病程中出现呼吸困难,血气分析提示氧分压降低、二氧化碳分压升高,胸部CT检查示右肺中叶、左肺下叶实变影,其内见间质支气管充气征,符合闭塞性细支气管炎的影像学表现。此外,本例患者经支气管镜下左肺下叶外后基底段穿刺活检病理学诊断为闭塞性细支气管炎伴纤维蛋白性肺泡炎,进一步证实闭塞性细支气管炎的诊断。
副肿瘤性天疱疮的发病机制目前尚不清楚。Vezzoli等[15]研究认为副肿瘤性天疱疮的发生原因可能是肿瘤细胞直接产生自身抗体或间接激活自身抗体,T细胞和自然杀伤细胞也可能在其中发挥作用。目前对于副肿瘤性天疱疮的诊断尚无共识。确立诊断主要取决于特异性临床表现结合直接免疫荧光、ELISA和免疫印迹/免疫沉淀法证实存在针对斑蛋白(plakin)家族抗原的自身抗体。有研究发现副肿瘤性天疱疮患者中分别有100%和64%存在脱氧精胍素1和3抗体,并证实这些抗体与诱导水泡形成有关[16]。由于副肿瘤性天疱疮具有异质性,分别有约50%和25%病例的直接免疫荧光和血清学抗体检测呈阴性,因此这些抗体结果阴性并不能排除副肿瘤性天疱疮[5]。本例患者因仅有口腔黏膜损伤,而无其他典型皮损,且口腔黏膜炎持续难以愈合,伴明显疼痛,影响进食,如行唇部皮肤病理活检,将可能因溃疡与伤口愈合困难而严重影响患者生活质量,故与患者及家属沟通后未行唇部皮肤病理活检。本例患者在治疗过程中应用了糖皮质激素和丙种球蛋白,血清抗体易出现假阴性,故未行针对副肿瘤性天疱疮的血清抗体检测。本例患者发病先后顺序呈现副肿瘤性天疱疮-淋巴瘤-闭塞性细支气管炎的临床三联征,且肺部影像学和肺组织病理活检结果支持闭塞性细支气管炎的诊断,故综合考虑后明确诊断为滤泡性淋巴瘤合并副肿瘤性天疱疮和闭塞性细支气管炎。
目前尚无针对副肿瘤性天疱疮的标准治疗方法。通过查阅文献发现,对此类患者的处理目前主要是针对原发肿瘤、皮肤黏膜病变和/或闭塞性细支气管炎的治疗。副肿瘤性天疱疮治疗的关键之一在于完整切除伴发实体瘤或控制相关恶性血液肿瘤。手术切除或控制伴发肿瘤后皮肤黏膜损害可得到改善[17]。在药物治疗方面,一线治疗是大剂量全身性糖皮质激素和免疫抑制剂(如硫唑嘌呤、环磷酰胺、霉酚酸酯、环孢素A等)应用[18]。此外,通过Ig冲击治疗和血浆置换可有效降低副肿瘤性天疱疮患者血清中自身抗体的滴度,从而降低闭塞性细支气管炎的发生率[19]。有报道称利妥昔单抗和阿仑单抗治疗效果满意,利妥昔单抗可有效治疗潜在的恶性肿瘤和B细胞产生的副肿瘤性天疱疮自身抗体;阿仑单抗是一种CD52单克隆抗体,可同时抑制T细胞和B细胞,从而诱导细胞死亡和延长淋巴细胞减少时间[20]。有文献报道了5例接受阿仑单抗联合泼尼松和静脉注射Ig治疗的B细胞淋巴瘤伴副肿瘤性天疱疮患者,患者皮肤黏膜病变在治疗2周内开始好转,并在6~12周后完全缓解[19]。本例患者在接受标准R-CHOP-21方案化学治疗的同时,应用了大剂量甲泼尼龙和Ig冲击治疗,淋巴瘤控制后口腔黏膜炎明显好转,但闭塞性细支气管炎对治疗无反应。
副肿瘤性天疱疮由于临床表现与其他较常见的疾病相似,鉴别诊断较为困难,经常被误诊或一经诊断即为晚期,因此,早期诊断和快速行免疫抑制治疗对预后极其重要。淋巴瘤伴副肿瘤性天疱疮预后差,病死率为75%~90%,平均生存期不到1年,如合并闭塞性细支气管炎预后更差,病死率极高,肺移植是唯一有效的治疗方法[21]。本例患者最终在诊断闭塞性细支气管炎后4个月后因感染性休克、呼吸衰竭死亡。
综上所述,对于临床特征符合副肿瘤性天疱疮-淋巴瘤-闭塞性细支气管炎临床三联征时,应高度考虑淋巴瘤合并副肿瘤性天疱疮和闭塞性细支气管炎,早期行病变黏膜活检、直接免疫荧光和免疫共沉淀等检测以明确诊断,并根据患者的临床表现和伴发肿瘤进行个体化治疗。
| [1] |
ANHALT G J, KIM S C, STANLEY J R, KORMAN N J, JABS D A, KORY M, et al. Paraneoplastic pemphigus. An autoimmune mucocutaneous disease associated with neoplasia[J]. N Engl J Med, 1990, 323: 1729-1735. DOI:10.1056/NEJM199012203232503 |
| [2] |
MORIKAWA K, TSUJI T, YAMASAKI H, EGASHIRA S, KAGUCHI A, KIDO M, et al. Paraneoplastic pemphigus occurs most commonly in indolent B cell lymphoma[J]. Acta Haematol, 2014, 132: 73-74. DOI:10.1159/000357109 |
| [3] |
NGUYEN V T, NDOYE A, BASSLER K D, SHULTZ L D, SHIELDS M C, RUBEN B S, et al. Classification, clinical manifestations, and immunopathological mechanisms of the epithelial variant of paraneoplastic autoimmune multiorgan syndrome: a reappraisal of paraneoplastic pemphigus[J]. Arch Dermatol, 2001, 137: 193-206. |
| [4] |
OHZONO A, SOGAME R, LI X, TEYE K, TSUCHISAKA A, NUMATA S, et al. Clinical and immunological findings in 104 cases of paraneoplastic pemphigus[J]. Br J Dermatol, 2015, 173: 1447-1452. DOI:10.1111/bjd.14162 |
| [5] |
CHOI Y, NAM K H, LEE J B, LEE J Y, IHM C W, LEE S E, et al. Retrospective analysis of 12 Korean patients with paraneoplastic pemphigus[J]. J Dermatol, 2012, 39: 973-981. DOI:10.1111/j.1346-8138.2012.01655.x |
| [6] |
HASHIMOTO T. Immunopathology of paraneoplastic pemphigus[J]. Clin Dermatol, 2001, 19: 675-682. DOI:10.1016/S0738-081X(00)00192-9 |
| [7] |
LANE J E, WOODY C, DAVIS L S, GUILL M F, JERATH R S. Paraneoplastic autoimmune multiorgan syndrome (paraneoplastic pemphigus) in a child: case report and review of the literature[J/OL]. Pediatrics, 2004, 114: e513-e516. DOI: 10.1542/peds.2004-0436.
|
| [8] |
陈丹, 林澄昱, 韩潇, 陈博, 卢朝辉, 常晓燕, 等. 滤泡淋巴瘤合并副肿瘤性自身免疫多器官综合征一例报告并文献复习[J]. 中华血液学杂志, 2016, 37: 1049-1053. DOI:10.3760/cma.j.issn.0253-2727.2016.12.008 |
| [9] |
ESTENNE M, HERTZ M I. Bronchiolitis obliterans after human lung transplantation[J]. Am J Respir Crit Care Med, 2002, 166: 440-444. DOI:10.1164/rccm.200201-003PP |
| [10] |
CZERNIK A, CAMILLERI M, PITTELKOW M R, GRANDO S A. Paraneoplastic autoimmune multiorgan syndrome: 20 years after[J]. Int J Dermatol, 2011, 50: 905-914. DOI:10.1111/j.1365-4632.2011.04868.x |
| [11] |
TAKAHASHI M, SHIMATSU Y, KAZAMA T, KIMURA K, OTSUKA T, HASHIMOTO T. Paraneoplastic pemphigus associated with bronchiolitis obliterans[J]. Chest, 2000, 117: 603-607. DOI:10.1378/chest.117.2.603 |
| [12] |
张晓岩, 林江涛, 贾玉萍, 甘世保, 笪冀平, 于明安. 淋巴瘤继发副肿瘤性天疱疮相关性闭塞性细支气管炎一例并文献复习[J]. 中国呼吸与危重监护杂志, 2019, 18: 71-75. |
| [13] |
ANHALT G J. Paraneoplastic pemphigus[J]. J Investig Dermatol Symp Proc, 2004, 9: 29-33. DOI:10.1111/j.1087-0024.2004.00832.x |
| [14] |
LEE S, YAMAUCHI T, ISHII N, HASHIMOTO T, KINOSHITA K, IMAMURA S, et al. Achievement of the longest survival of paraneoplastic pemphigus with bronchiolitis obliterans associated with follicular lymphoma using R-CHOP chemotherapy[J]. Int J Hematol, 2017, 106: 852-859. DOI:10.1007/s12185-017-2305-2 |
| [15] |
VEZZOLI P, BERTI E, MARZANO A V. Rationale and efficacy for the use of rituximab in paraneoplastic pemphigus[J]. Expert Rev Clin Immunol, 2008, 4: 351-363. DOI:10.1586/1744666X.4.3.351 |
| [16] |
PAOLINO G, DIDONA D, MAGLIULO G, IANNELLA G, DIDONA B, MERCURI S R, et al. Paraneoplastic pemphigus: insight into the autoimmune pathogenesis, clinical features and therapy[J/OL]. Int J Mol Sci, 2017, 18: 2532. DOI: 10.3390/ijms18122532.
|
| [17] |
ZHANG J, QIAO Q L, CHEN X X, LIU P, QIU J X, ZHAO H, et al. Improved outcomes after complete resection of underlying tumors for patients with paraneoplastic pemphigus: a single-center experience of 22 cases[J]. J Cancer Res Clin Oncol, 2011, 137: 229-234. DOI:10.1007/s00432-010-0874-z |
| [18] |
MILTENYI Z, TOTH J, GONDA A, TAR I, REMENYIK E, ILLES A. Successful immunomodulatory therapy in castleman disease with paraneoplastic pemphigus vulgaris[J]. Pathol Oncol Res, 2009, 15: 375-381. DOI:10.1007/s12253-008-9133-x |
| [19] |
MARUTA C W, MIYAMOTO D, AOKI V, CARVALHO R G R, CUNHA B M, SANTI C G. Paraneoplastic pemphigus: a clinical, laboratorial, and therapeutic overview[J]. An Bras Dermatol, 2019, 94: 388-398. DOI:10.1590/abd1806-4841.20199165 |
| [20] |
HOHWY T, BANG K, STEINICHE T, PETERSLUND N A, D'AMORE F. Alemtuzumab-induced remission of both severe paraneoplastic pemphigus and leukaemic bone marrow infiltration in a case of treatment-resistant B-cell chronic lymphocytic leukaemia[J]. Eur J Haematol, 2004, 73: 206-209. DOI:10.1111/j.1600-0609.2004.00280.x |
| [21] |
OUEDRAOGO E, GOTTLIEB J, DE MASSON A, LEPELLETIER C, JACHIET M, DE CHOU C S, et al. Risk factors for death and survival in paraneoplastic pemphigus associated with hematologic malignancies in adults[J]. J Am Acad Of Dermatol, 2019, 80: 1544-1549. DOI:10.1016/j.jaad.2018.03.043 |
 2021, Vol. 42
2021, Vol. 42

