2. 海军军医大学(第二军医大学)长海医院泌尿外科, 上海 200433
2. Department of Urology, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China
泌尿外科内镜微创手术大大降低了患者手术创伤反应,明显加快了患者的康复速度。然而,术后尿脓毒症仍然是泌尿外科内镜手术的严重并发症[1]。经皮肾镜取石术(percutaneous nephrolithotomy,PCNL)较其他泌尿外科内镜手术具有更高的感染风险,尿脓毒症是PCNL患者围手术期死亡最常见的原因[2-3]。相比于腹部或肺部感染引起的术后脓毒症,尿脓毒症发病迅速,且常以脓毒性休克为首发症状[4]。这种严重危及生命的紧急情况需要围手术期多学科团队的协作处理。
感染性结石患者行PCNL时,结石和肾盂内的细菌裂解产物或毒素可随冲洗液进入肾间质内的淋巴和静脉通路[5]。这些病原相关分子模式(pathogen-associated molecular pattern,PAMP)进入体内后可诱发先天免疫反应,引发严重的炎症级联瀑布反应,进而导致患者多脏器功能损伤[6]。预防尿脓毒症的发生一直是提高泌尿外科内镜手术患者围手术期安全的难点。尽管术前抗生素治疗一定程度上降低了泌尿系统内细菌负荷,然而抗生素治疗诱发的内毒素释放可能加重炎症反应,导致脓毒症和脓毒性休克的发生[7-8]。因此,术前抗生素治疗是否有助于降低术后尿脓毒症或尿脓毒性休克的发生仍存在争论[9]。预防性使用糖皮质激素可以减轻大手术[10-12]或植入物[13]引起的无菌性炎症。根据PCNL尿脓毒症特殊的发病机制,我们推测抗炎治疗可能是预防尿脓毒症的有效方法。然而鉴于糖皮质激素在脓毒症中使用存在争议[14],目前有关糖皮质激素预防脓毒症发生的临床研究还未见报道。
本研究中,我们选择具有尿脓毒症高危因素的PCNL患者,观察预防性使用甲泼尼龙(methylprednisolone,METH)对此类患者术后尿脓毒症、尿脓毒性休克、全身炎症反应综合征(system inflammatory response syndrome,SIRS)发生率的影响及围手术期血浆中炎症标志物水平的变化,初步探讨METH预防尿脓毒症发生的机制。
1 资料和方法 1.1 研究对象选择2018年6月至2019年12月在海军军医大学(第二军医大学)长海医院泌尿外科接受PCNL的患者为筛查对象。纳入标准:年龄≥18岁,并至少有一项尿脓毒症的危险因素(结石性肾盂肾炎病史,术前中段尿培养阳性,术前中段尿白细胞计数≥500/μL)。排除标准:对METH过敏的患者;术前1个月使用任何糖皮质激素或接受免疫抑制剂治疗的患者;消化道活动性溃疡或未得到控制的糖尿病患者;急诊手术患者;妊娠期妇女;未获得知情同意的患者。剔除标准:手术方式改变;在确定或排除尿脓毒症诊断前使用了试验用药之外的糖皮质激素;患者出现干扰尿脓毒症诊断的临床情况,如术后严重出血,双J管、肾造瘘管堵塞或移位造成术后发热等。本研究符合《赫尔辛基宣言》原则[15],并通过海军军医大学(第二军医大学)长海医院伦理委员会审批(CHEC 2018-060)。
1.2 研究设计本研究为单中心、前瞻性、随机、双盲、安慰剂对照试验。由1位独立的统计学专家用计算机创建按患者性别分层的随机序列,并用密封的不透明信封将其分配到各组。2位专职护士负责准备和给予试验药物或安慰剂,不参与试验的其他事项。在揭盲前,患者、相关的麻醉科医师、泌尿外科医师及其他研究人员均对治疗分组不知情。
1.3 治疗流程术前尿培养阳性的患者接受敏感抗生素治疗5~7 d,尿培养阴性的患者预防性给予抗生素治疗3 d(第二代头孢或左旋氧氟沙星)。患者入手术室后常规监测,按照标准方案给予麻醉诱导,麻醉维持采用丙泊酚-瑞芬太尼持续静脉输注。手术开始前患者随机分为两组:METH组和对照组。METH组患者在手术开始前静脉推注40 mg METH(溶于2 mL生理盐水),而对照组患者静脉推注等体积的生理盐水。患者先取截石位,放置输尿管导管,之后取俯卧位经超声引导肾脏穿刺,用经皮扩张器建立F22标准肾镜通道进行钬激光碎石。手术结束后,留置F6或F7双J管2~4周,留置F18~F20肾造瘘管2~4 d。患者术后接受标准的监护治疗。尿脓毒症的治疗依据最新指南进行,包括加强抗生素治疗、液体复苏和器官功能支持等措施。
1.4 数据收集患者术前基本资料包括性别、年龄、BMI、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、合并疾病、肾脏积水、术前接受的泌尿系统减压操作、累积结石直径及尿脓毒症的危险因素。术中记录手术时间,术后记录患者的生命体征和实验室检查结果、结石残余情况及术后住院时间。
1.5 尿脓毒症、尿脓毒性休克和SIRS的诊断标准术后2、24、48、72 h评价患者是否符合尿脓毒症、尿脓毒症休克、SIRS的诊断。根据脓毒症3.0版定义,尿脓毒症为确认或怀疑尿路感染引起的序贯器官衰竭评估(sequential organ failure assessment,SOFA)评分超过基线值2分及以上[16]。尿脓毒性休克定义为尿脓毒症充分容量复苏后持续性低血压状态,需要血管收缩剂维持平均动脉压65 mmHg(1 mmHg=0.133 kPa)以上,且血清乳酸水平高于2 mmol/L[16]。SIRS判断标准为符合下述指标中的2项或以上:体温>38 ℃或<36 ℃;心率>90 min-1;呼吸>20 min-1或动脉血二氧化碳分压(partial pressure of carbon dioxide in artery,PaCO2)<32 mmHg;血白细胞计数>12×109/L或<4×109/L。
1.6 血浆炎症标志物检测分别于术前和术后2 h、24 h抽血检测血浆炎症标志物。使用Beckman Coulter Immage 800免疫分析仪测定血浆中CRP水平。使用Roche Cobas e602免疫化学分析仪测定血浆中降钙素原(procalcitonin,PCT)水平。使用Siemens Immulite 1000全自动化学发光免疫分析系统检测血浆中细胞因子IL-1β、TNF-α、IL-6和IL-10水平。如果血浆中炎症标志物的浓度超出测量范围,则将其值记为测量范围的最小值或最大值进行统计分析。
1.7 统计学处理回顾性分析本中心预防性使用METH和未使用METH的高危患者,其PCNL术后尿脓毒症发生率分别为5.0%(1/20)和28.6%(4/14)。设定Ⅰ类错误为0.05,检验效能为80%,行双侧检验时每组需要样本例数为36例。假设有10%脱落率,则样本量每组40例。正态分布的数据以x±s表示,非正态分布数据以中位数(四分位数间距)表示,分类变量以例数和百分数表示。连续变量比较采用独立样本t检验或Mann-Whitney U检验,分类变量比较采用χ2检验或Fisher精确概率法。检验水准(α)为0.05。
2 结果 2.1 患者基线资料本研究筛查了236例接受择期PCNL的成年(≥18岁)患者,其中非高危因素患者153例、高危因素患者83例。因3例高危因素患者符合排除标准,最终纳入有高危因素的患者80例并随机分组,每组40例。6例患者因不符合试验方案被剔除:METH组中2例患者改变手术方式,1例术中给予地塞米松预防术后恶心呕吐;对照组中1例患者改变手术方式,1例术中因支气管痉挛而给予氢化可的松,1例因术后出血性休克而行肾动脉栓塞术。最终74例患者进入统计分析(每组37例)。两组患者的基线值差异无统计学意义(表 1)。
|
|
表 1 两组患者基线资料比较 Tab 1 Comparison of baseline characteristics of patients in the two groups |
2.2 两组患者尿脓毒症、尿脓毒性休克、SIRS发生率及最大SOFA评分等
术后11例患者诊断为尿脓毒症,其中METH组2例(5.4%,2/37),均为女性;对照组9例(24.3%,9/37),男2例、女7例;两组尿脓毒症发生率的差异有统计学意义(P=0.042)。除对照组1例尿脓毒症患者是在术后48 h明确诊断外,其余10例均在术后24 h明确诊断。对照组有4例(10.8%,4/37)患者诊断为尿脓毒性休克,均为女性,而METH组无尿脓毒性休克病例,两组尿脓毒性休克发生率的差异无统计学意义(P=0.115)。对照组尿脓毒性休克患者中,1例术后2 h即发生严重低血压,另外3例在术后5~6 h出现严重低血压。术后26例患者诊断为SIRS,其中METH组7例(18.9%,7/37),男2例、女5例;对照组19例(51.4%,19/37),男7例、女12例;两组SIRS发生率的差异有统计学意义(P=0.003)。METH组2例及对照组10例SIRS患者在术后2 h确诊,其余SIRS患者均在术后24 h明确诊断。
术后2~72 h METH组最大SOFA评分为0、1、2、3、4、≥5分的患者分别有26、9、1、1、0、0例,而对照组分别有19、9、4、1、1、3例,METH组患者最大SOFA评分低于对照组[0(1)分vs 0(1.5)分],差异有统计学意义(P=0.043)。METH组2例术后尿脓毒症患者的最大SOFA评分为2分和3分,而对照组9例尿脓毒症患者中有5例最大SOFA评分≥3分,且有3例患者接受术后气管插管呼吸机支持治疗。METH组患者术后住院天数为4(1)d,对照组为5(2)d,两组比较差异无统计学意义(P>0.05)。两组尿脓毒症患者预后良好,出院前受损器官功能均恢复至术前水平。
2.3 两组患者血浆炎症标志物变化大部分患者血浆中IL-1β水平均低于检测限值,两组差异无统计学意义(数据未显示)。两组患者术前血浆中炎症因子水平相似。术后2 h和24 h时血浆中CRP、PCT和TNF-α水平在两组间差异均无统计学意义(P均>0.05);对照组术后24 h时血浆中IL-6水平高于METH组[34.4(46.5)pg/mL vs 20.7(15.8)pg/mL,P<0.01];METH组术后2 h时血浆中IL-10水平高于对照组[26.3(149.5)pg/mL vs 5.0(3.6)pg/mL,P<0.01],而术后24 h时低于对照组[<5.0(1.5)pg/mL vs 5.9(13.8)pg/mL,P<0.05]。见图 1。
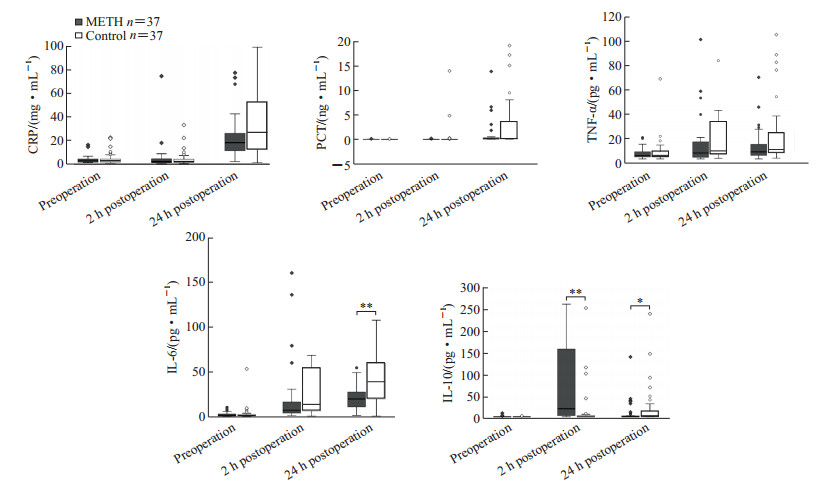
|
图 1 不同时间点两组患者血浆炎症标志物水平的比较 Fig 1 Comparison of plasma levels of inflammatory markers between the two groups at different time points The plasma levels of inflammatory markers were shown as the median, with boxes representing the lower quartile and upper quartile, and error bars showing minimum and maximum values. *P < 0.05, **P < 0.01. The outliers are also shown in the figures. ● and ○ represent mild outliers. ◆ and ◇ represent extreme outliers. CRP: C reactive protein; PCT: Procalcitonin; TNF-α: Tumor necrosis factor α; IL: Interleukin. |
3 讨论
本研究首次观察了METH预防PCNL术后尿脓毒症的疗效,结果显示预防性使用METH可以降低高危患者PCNL术后尿脓毒症[5.4%(2/37)vs 24.3%(9/37),P<0.05]和SIRS[18.9%(7/37)vs 51.4%(19/37),P<0.01]的发生率。此外,METH组患者术后2 h时血浆中IL-10水平较对照组升高[26.3(149.5)pg/mL vs 5.0(3.6)pg/mL,P<0.01],术后24 h时患者血浆中IL-6水平较对照组下降[20.7(15.8)pg/mL vs 34.4(46.5)pg/mL,P<0.01],提示预防性给予METH可能在炎症反应起始阶段促进了免疫细胞释放IL-10,从而抑制后续的过度炎症反应。
泌尿外科内镜手术后尿脓毒症是一种特殊类型脓毒症[6]。首先,与常见的术后腹部或肺部感染引起的脓毒症不同,尿脓毒症起病急,并可迅速恶化为脓毒性休克,发现和处理不及时会造成患者死亡[1-4]。其次,泌尿外科内镜手术操作虽然诱发了尿脓毒症,但这些操作缓解了肾盂扩张,更好地引流感染性尿液,从而阻止了尿液中感染成分再次进入循环[17-18]。感染源被去除或停止吸收后,尿脓毒症预后往往良好。最后,抗生素治疗和激光碎石过程中产生的细菌裂解产物在术中进入循环系统是尿脓毒症发生的直接原因[5]。McAleer等[19]的研究显示尿脓毒症患者的肾脏结石、肾盂尿及血浆中可检测出高浓度的内毒素,而这些标本在做细菌培养时往往呈阴性。在泌尿外科内镜手术前预防性使用抗生素,尽管可降低泌尿系统细菌负荷、减少术后发热及SIRS的发生率,但严重脓毒症和脓毒休克的发生率并未降低[20]。这些研究提示细菌裂解产物(包括内毒素等)而非活细菌是诱发尿脓毒症炎症反应的PAMP。因此,在发病机制上泌尿外科内镜手术后尿脓毒症与实验性内毒素血症模型相似。本研究结果显示预防性给予METH术后尿脓毒症的发生率下降4倍以上,证实抗炎治疗对预防尿脓毒症的发生有效。
腹部大手术和体外循环心脏手术前给予糖皮质激素,患者术后早期血浆中IL-10水平升高,而后期血浆中IL-6水平降低[10-12]。这些研究中引起炎症反应的因子主要是损伤相关分子模式(danger-associated molecular pattern,DAMP)[10-12],不同于本研究的PAMP,但是本研究观察到METH对血浆中IL-10和IL-6水平具有相似的调节作用。本研究结果及文献[10-12]报道结果均提示,糖皮质激素预处理能在炎症反应诱发阶段促进抗炎因子IL-10的释放,从而有利于抑制后续的炎症级联瀑布反应,避免过度炎症反应导致的免疫紊乱。此外,给予METH的时机不同,其对炎症的调节作用也可能不同。Huang等[21]的研究显示,在严重烧伤患者急性期给予METH,其血浆中IL-10水平较对照组降低,而未见升高。该研究中患者免疫系统已被激活,此时给予METH产生了不同的免疫调节作用。在已确诊的脓毒症患者中使用糖皮质激素存在较大争议的一个重要原因就是给予糖皮质激素时患者免疫状态存在异质性,从而导致糖皮质激素的作用不一致[14]。本研究在炎症反应诱发前给予METH,保证了患者免疫状态基本一致。本研究结果显示METH组患者血浆中炎症标志物CRP、PCT和TNF-α水平在术后较对照组有降低趋势,但差异无统计学意义,可能与样本量有关。
既往许多探讨尿脓毒症危险因素的研究常把SIRS作为尿脓毒症的诊断标准,实践中这些危险因素在预测更具临床意义的严重尿脓毒症(引起器官功能损伤的SIRS)和尿脓毒性休克时的特异性不高[22]。2016年脓毒症3.0版定义采用SOFA评分进行尿脓毒症的诊断,据此诊断标准,通过回顾性分析我们筛选出PCNL术后尿脓毒症的特异风险因素[23]。本研究以尿脓毒症高危患者为研究对象,治疗措施针对性更强,并且避免了非高危患者对研究结果的干扰。本研究筛选的非高危患者在PCNL术后没有出现尿脓毒症,但该人群术后SIRS发生率仍高达17.6%(27/153),从侧面反映出本研究采用的尿脓毒症危险因素具有较高的特异性。
通常来说脓毒症在男性中发病率较高,但尿脓毒症在女性中更常见[24],这可能与女性尿路感染发生率高有关[25]。我们之前的一项研究就发现14例尿脓毒性休克患者中女性有13例[4]。本研究通过以性别因素分层随机抽样从而确保两组患者性别比相同,对照组患者女性和男性尿脓毒症发生率分别为35.0%(7/20)和11.8%(2/17),且尿脓毒性休克患者全部为女性;而METH组2例尿脓毒症患者也皆为女性。结果提示相对于男性患者,METH预防女性患者PCNL术后尿脓毒症的意义更大。
本研究存在一定的局限性。首先,我们没有设计其他剂量组探讨METH预防尿脓毒症的量效关系,因此本试验结果不能推荐预防性使用METH的最佳剂量。其次,有报道称患者结石成分与术后尿脓毒症发生具有一定相关性[22]。本研究中大部分患者结石成分分析结果缺失,因此不能确定两组患者是否存在偏倚。最后,METH作用机制复杂,本研究仅探讨了METH预处理对几种血浆炎症标志物表达的影响,而其他一些未检测的炎症介质变化还不清楚,同时本研究也未观察免疫细胞数量和功能的改变,因此METH确切的免疫调节机制需要进一步研究。
总之,PCNL术后尿脓毒症特殊的发病机制为其预防提供了可行性。预防性给予METH可降低高危患者PCNL术后尿脓毒症和SIRS的发生率,这种保护作用可能与METH预处理促进炎症反应起始阶段IL-10的释放从而阻止炎症级联放大反应有关。
| [1] |
BONKAT G, CAI T, VEERATTERAPILLAY R, BRUYÈRE F, BARTOLETTI R, PILATZ A, et al. Management of urosepsis in 2018[J]. Eur Urol Focus, 2019, 5: 5-9. DOI:10.1016/j.euf.2018.11.003 |
| [2] |
DE LA ROSETTE J, ASSIMOS D, DESAI M, GUTIERREZ J, LINGEMAN J, SCARPA R, et al. The Clinical Research Office of the Endourological Society Percutaneous Nephrolithotomy Global Study: indications, complications, and outcomes in 5 803 patients[J]. J Endourol, 2011, 25: 11-17. DOI:10.1089/end.2010.0424 |
| [3] |
WOLLIN DA, PREMINGER G M. Percutaneous nephrolithotomy: complications and how to deal with them[J]. Urolithiasis, 2018, 46: 87-97. DOI:10.1007/s00240-017-1022-x |
| [4] |
刘毅, 倪文, 王晓琳, 孟岩, 万晓健, 李金宝, 等. 泌尿腔内手术患者术后尿脓毒症休克发生的相关因素及临床特征分析[J]. 中华麻醉学杂志, 2012, 32: 724-726. DOI:10.3760/cma.j.issn.0254-1416.2012.06.022 |
| [5] |
STENBERG A, BOHMAN S O, MORSING P, MÜLLER-SUUR C, OLSEN L, PERSSON A E. Back-leak of pelvic urine to the bloodstream[J]. Acta Physiol Scand, 1988, 134: 223-234. DOI:10.1111/j.1748-1716.1988.tb08483.x |
| [6] |
WAGENLEHNER F M, TANDOGDU Z, BJERKLUND JOHANSEN T E. An update on classification and management of urosepsis[J]. Curr Opin Urol, 2017, 27: 133-137. DOI:10.1097/MOU.0000000000000364 |
| [7] |
PRINS J M, VAN AGTMAEL M A, KUIJPER E J, VAN DEVENTER S J, SPEELMAN P. Antibiotic-induced endotoxin release in patients with gram-negative urosepsis: a double-blind study comparing imipenem and ceftazidime[J]. J Infect Dis, 1995, 172: 886-891. DOI:10.1093/infdis/172.3.886 |
| [8] |
LUCHI M, MORRISON D C, OPAL S, YONEDA K, SLOTMAN G, CHAMBERS H, et al. A comparative trial of imipenem versus ceftazidime in the release of endotoxin and cytokine generation in patients with gram-negative urosepsis. Urosepsis Study Group[J]. J Endotoxin Res, 2000, 6: 25-31. DOI:10.1177/09680519000060010401 |
| [9] |
LAI W S, ASSIMOS D. The role of antibiotic prophylaxis in percutaneous nephrolithotomy[J]. Rev Urol, 2016, 18: 10-14. |
| [10] |
SRINIVASA S, KAHOKEHR A A, YU T C, HILL A G. Preoperative glucocorticoid use in 11 major abdominal surgery: systematic review and meta-analysis of randomized trials[J]. Ann Surg, 2011, 254: 183-191. DOI:10.1097/SLA.0b013e3182261118 |
| [11] |
WEIS F, BEIRAS-FERNANDEZ A, SCHELLING G, BRIEGEL J, LANG P, HAUER D, et al. Stress doses of hydrocortisone in high-risk patients undergoing cardiac surgery: effects on interleukin-6 to interleukin-10 ratio and early outcome[J]. Crit Care Med, 2009, 37: 1685-1690. DOI:10.1097/CCM.0b013e31819fca77 |
| [12] |
FILLINGER M P, RASSIAS A J, GUYRE P M, SANDERS J H, BEACH M, PAHL J, et al. Glucocorticoid effects on the inflammatory and clinical responses to cardiac surgery[J]. J Cardiothorac Vasc Anesth, 2002, 16: 163-169. DOI:10.1053/jcan.2002.31057 |
| [13] |
DE LA MOTTE L, KEHLET H, VOGT K, NIELSEN C H, GROENVALL J B, NIELSEN H B, et al. Preoperative methylprednisolone enhances recovery after endovascular aortic repair: a randomized, double-blind, placebo-controlled clinical trial[J]. Ann Surg, 2014, 260: 540-548. DOI:10.1097/SLA.0000000000000895 |
| [14] |
LONG B, KOYFMAN A. Controversies in corticosteroid use for sepsis[J]. J Emerg Med, 2017, 53: 653-661. DOI:10.1016/j.jemermed.2017.05.024 |
| [15] |
World Medical Association General Assembly. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects[J]. J Int Bioethique, 2004, 15: 124-129. DOI:10.3917/jib.151.0124 |
| [16] |
SINGER M, DEUTSCHMAN C S, SEYMOUR C W, SHANKAR-HARI M, ANNANE D, BAUER M, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315: 801-810. DOI:10.1001/jama.2016.0287 |
| [17] |
ASTROZA G M, SARRAS M, SALVADO J A, MAJERSON A, NEIRA R, DOMINGUEZ J. Early ureteroscopic treatment in patients with urosepsis associated with ureteral calculi is a safe approach. A pilot study[J]. Cent European J Urol, 2019, 72: 163-168. |
| [18] |
PIETROPAOLO A, HENDRY J, KYRIAKIDES R, GERAGHTY R, JONES P, ABOUMARZOUK O, et al. Outcomes of elective ureteroscopy for ureteric stones in patients with prior urosepsis and emergency drainage: prospective study over 5 yr from a tertiary endourology centre[J]. Eur Urol Focus, 2020, 6: 151-156. DOI:10.1016/j.euf.2018.09.001 |
| [19] |
MCALEER I M, KAPLAN G W, BRADLEY J S, CARROLL S F, GRIFFITH D P. Endotoxin content in renal calculi[J]. J Urol, 2003, 169: 1813-1814. DOI:10.1097/01.ju.0000061965.51478.79 |
| [20] |
MARIAPPAN P, SMITH G, MOUSSA S A, TOLLEY D A. One week of ciprofloxacin before percutaneous nephrolithotomy significantly reduces upper tract infection and urosepsis: a prospective controlled study[J]. BJU Int, 2006, 98: 1075-1079. DOI:10.1111/j.1464-410X.2006.06450.x |
| [21] |
HUANG G, LIANG B, LIU G, LIU K, DING Z. Low dose of glucocorticoid decreases the incidence of complications in severely burned patients by attenuating systemic inflammation[J/OL]. J Crit Care, 2015, 30: 436.e7-11. DOI: 10.1016/j.jcrc.2014.09.016.
|
| [22] |
KREYDIN E I, EISNER B H. Risk factors for sepsis after percutaneous renal stone surgery[J]. Nat Rev Urol, 2013, 10: 598-605. DOI:10.1038/nrurol.2013.183 |
| [23] |
PENG Y, ZHANG W, XU Y, LI L, YU W, ZENG J, et al. Performance of SOFA, qSOFA and SIRS to predict septic shock after percutaneous nephrolithotomy[J/OL]. World J Urol, 2020. DOI: 10.1007/s00345-020-03183-2.
|
| [24] |
VAN VUGHT L A, SCICLUNA B P, WIEWEL M A, HOOGENDIJK A J, KLOUWENBERG P M C, ONG D S Y, et al. Association of gender with outcome and host response in critically ill sepsis patients[J]. Crit Care Med, 2017, 45: 1854-1862. DOI:10.1097/CCM.0000000000002649 |
| [25] |
FOXMAN B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs[J]. Am J Med, 2002, 113(Suppl 1A): 5S-13S. |
 2021, Vol. 42
2021, Vol. 42


