肝细胞癌是世界范围内发病率最高的恶性肿瘤之一,具有高复发、高转移的特点[1]。流行病学调查显示,肝细胞癌在男性癌症相关死亡原因中高居第2位,在女性中位居第6位[2]。近年来,外科手术、化疗和放疗技术的发展极大改善了肝细胞癌患者的预后,但是对晚期肝细胞癌患者有效的治疗手段仍十分有限。肝细胞癌的发生、发展是一个复杂的多因素过程,挖掘肝细胞癌发生过程中的关键分子、明确其调控机制对肝细胞癌的早期诊断和治疗具有重要意义。
泛素结合酶E2C(ubiquitin-conjugating enzyme E2C,UBE2C)是泛素结合酶E2家族成员,可通过与细胞周期后期促进复合物特异性结合参与蛋白的泛素化降解途径,进而在生命活动调控中发挥重要作用[3]。基于肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)数据库和基因型-组织表达(Genotype-Tissue Expression,GTEx)数据库的生物信息学研究显示,UBE2C在乳腺癌、结直肠癌、肺癌及肝细胞癌等27种肿瘤中的表达均升高,且与患者的不良预后密切相关[4-5]。UBE2C异常表达能增加染色体不稳定性,促进包括胃癌、非小细胞肺癌和黑素瘤在内多种肿瘤的发生、发展[6-8]。Wei等[9]研究发现,相比癌旁组织和正常肝细胞系,UBE2C在肝癌组织和肝癌细胞系中表达上调且提示不良预后。以上研究结果提示,UBE2C是一个重要的癌基因,参与肝癌等多种肿瘤的发生、发展。但目前人们对UBE2C促癌作用的研究仍不够深入,对具体分子机制及其参与调控的信号通路的认识仍十分有限。本研究拟通过Halotag共沉淀实验鉴定肝癌细胞中UBE2C特异性结合的底物蛋白,并考察UBE2C与其底物蛋白的相互作用对肝癌细胞的影响,为UBE2C作为生物标志物应用于肝癌的诊断和治疗提供依据。
1 材料和方法 1.1 细胞与试剂人肝癌细胞系Huh-7、人高转移肝癌细胞系HCCLM3、人胚胎肾细胞系HEK293T均购自中国科学院上海细胞库,由本实验室保存。DMEM高糖培养液和FBS均购自美国Gibco公司,青霉素、链霉素、蛋白质印迹分析所需试剂均购自上海博光生物科技有限公司,脂质体3000试剂和反转录试剂均购自美国Invitrogen公司,RNA抽提试剂TRIzol RNAiso购自日本TaKaRa公司,双荧光素酶报告基因检测试剂盒购自美国Promega公司,亚细胞蛋白质组抽提试剂盒购自美国Merck Millipore公司,β-微管蛋白、组蛋白H3、细胞周期蛋白D1(cyclin D1,CCND1)、JNK抗体均购自美国CST公司,β-联蛋白抗体购自上海泊湾生物科技有限公司,GAPDH抗体购自美国Santa Cruz公司。
1.2 细胞培养及过表达UBE2C的稳转细胞系的构建细胞用含10% FBS的DMEM培养液,置于37 ℃、5% CO2、饱和湿度的培养箱中培养。向接种到6孔板同等数量并且长到60%~80%融合度的Huh-7细胞中加入嘌呤霉素(美国ThermoFisher Scientific公司),浓度分别为0、1.5、2、2.5、3 μg/mL,3 d后观察到致Huh-7细胞全部死亡的最低浓度为2 μg/mL。UBE2C过表达慢病毒及对照慢病毒均购于上海吉玛制药技术有限公司,分别命名为LV-UBE2C和LV-Control。侵染病毒前1 d,将3×105个细胞接种到6孔板,保证侵染时细胞融合度为50%~70%并处于对数生长期。转染时换新鲜培养液,向每孔细胞中加入30 μL病毒和1 μL病毒增强剂,24 h后换液,侵染细胞3 d后加入嘌呤霉素,及时更换培养液,去除死细胞并传代,1周后利用qRT-PCR和蛋白质印迹实验验证转录水平及蛋白水平的过表达效率。验证好的细胞一部分置于液氮中冻存,一部分用于后续实验。
1.3 Halotag下拉实验与质谱分析分别用编码UBE2C-Halotag融合蛋白和Halotag标签的质粒转染HCCLM3。转染72 h后用预冷的PBS重悬细胞,在4 ℃下2 000×g离心5 min,弃掉PBS;在-80 ℃存放30 min后,将细胞沉淀用哺乳动物裂解液(美国Promega公司)裂解。Halolink树脂用TBS洗涤3次后,将裂解物与树脂在4 ℃孵育过夜,然后将结合蛋白复合物用TBST洗涤3次,进行SDS-PAGE和银染;切取特异性条带,并用质谱仪(美国ProTech公司)进行分析。
1.4 qRT-PCR检测相关基因的表达使用TRIzol试剂提取总RNA。按照反转录试剂盒操作说明合成cDNA,以cDNA为模板,使用SYBR Real-time PCR试剂盒在StepOnePlus实时荧光定量PCR系统(美国Applied Biosystems公司)中进行扩增。引物序列如下:微管蛋白正向引物5'-AAGATCCGAGAAGAATACCCTGA-3',反向引物5'-CTACCAACTGATGGACGGAGA-3';UBE2C正向引物5'-TCAGACAACCTTTTCAAAT GGGT-3',反向引物5'-AGCGAGAGCTTATACCTCAGG-3';JNK正向引物5'-TCCAAGTGCCGAAAAAGGAAG-3',反向引物5'-CGAGTTCTGAGCTT TCAAGGT-3';CCND1正向引物5'-CAATGACCCCGCACGATTT C-3',反向引物5'-CATGGAGGGCGGATTGGAA- 3';基质金属蛋白酶7(matrix metallopeptidase 7,MMP7)正向引物5'-GAGTGAGCTACAGTGGGA ACA-3',反向引物5'-CTATGACGCGGGAGTTTA ACAT-3';β-肌动蛋白正向引物5'-CTGGTGCC TGGGGCG-3',反向引物5'-AGCCTCGCCTTTGCC GA-3'。每个样本重复3次。采用2-ΔΔCt法对目标基因表达水平进行相对定量分析。
1.5 蛋白质印迹法检测相关蛋白表达收集细胞,置于冰上,加入200 μL RIPA蛋白裂解液和2 μL蛋白酶抑制剂PMSF,4 ℃摇床放置5 min后刮下细胞,收集细胞悬液,4 ℃ 17 000×g离心8 min,取上清用BCA法检测蛋白浓度。取等量蛋白上样,行SDS-PAGE,200 mA恒流转膜,用5%脱脂奶粉溶液室温封闭1 h后分别加入β-微管蛋白、组蛋白H3、CCND1、JNK、β-联蛋白、GAPDH抗体于4 ℃下孵育过夜。用TBST洗涤后加入相应二抗,室温避光孵育1 h后用TBST洗3次。利用Odyssey红外荧光扫描成像系统检测蛋白荧光强度,并对目的蛋白的表达水平进行半定量分析。
1.6 细胞免疫荧光化学染色将UBE2C过表达的Huh-7细胞和阴性对照Huh-7细胞铺在基质胶预处理的盖玻片上,细胞生长12 h后去除上清,用PBS清洗,然后在室温下用4%多聚甲醛溶液固定细胞30 min,弃去甲醛,PBS清洗3遍。加入400 μL打孔液室温孵育10 min后,弃去打孔液,加入400 μL封闭液室温封闭2 h。加入抗β-微管蛋白单克隆抗体(1:50稀释)4 ℃孵育过夜。弃去液体,PBS洗涤3次后,用Alexa Fluor® 555标记的山羊抗兔IgG抗体(美国Invitrogen公司,1:2 000稀释)孵育细胞2 h。弃去液体,用0.1% Triton-PBS清洗1次,加入DAPI室温孵育10 min。去除DAPI,用0.1% Triton-PBS清洗3次,每次10 min。使用Carl Zeiss显微镜观察结果并拍照。
1.7 双荧光素酶报告基因实验带有TOP Flash和FOP Flash质粒的TCF报告基因质粒试剂盒购自美国Upstate Cell Signaling Solutions公司。将细胞接种到96孔板,转染时细胞融合度为70%并处于对数生长期。为了测定β-联蛋白的转录活性,用脂质体3000将含有诱导型(TOP Flash)或突变型(FOP Flash)TCF反应性萤火虫荧光素酶的报告载体和pReceiver-M02-UBE2C质粒(美国GeneCopoeia公司)的混合物瞬时转染HEK293T细胞。为了监测转染效率,将每个样品与表达海肾荧光素酶的phRL-TK对照质粒(美国Promega公司)共转染细胞。转染6 h后,换新鲜完全培养液。质粒共转染48 h后,弃去培养液,用100 μL PBS洗1次,倾斜96孔板,吸干剩余的PBS。用双荧光素酶报告基因检测系统测定裂解物中萤火虫和海肾荧光素酶的活性,相对荧光素酶活性利用海肾荧光素酶活性进行标准化。所有实验重复3次。
1.8 亚细胞蛋白质组提取用亚细胞蛋白质组抽提试剂盒分别提取Huh-7 LV-UBE2C克隆和Huh-7 LV-Control的细胞质蛋白和细胞核蛋白质组。
1.9 统计学处理应用GraphPad Prism 6软件进行数据分析和绘图。数据以x±s表示,组间比较采用独立样本t检验,检验水准(α)为0.05。
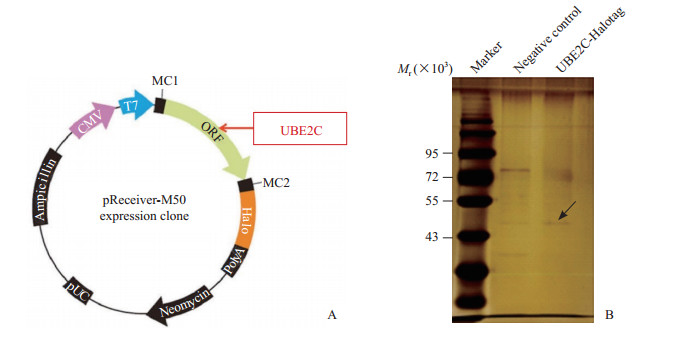
2 结果 2.1 肝癌细胞中β-微管蛋白是UBE2C特异性结合的底物蛋白通过双酶切,获得UBE2C与Halotag标签融合表达质粒(图 1A)。银染结果(图 1B)显示,UBE2C融合表达组与空质粒组共沉淀产物的电泳结果存在差异条带。差异条带质谱分析结果(表 1)显示,β-微管蛋白与UBE2C存在特异性结合。进一步的生物信息学分析结果(表 2)显示,β-微管蛋白存在多个泛素化修饰位点。以上结果提示,β-微管蛋白是UBE2C特异性结合的底物蛋白。
|
图 1 UBE2C与Halotag标签融合表达质粒示意图和蛋白电泳结果 Fig 1 Schematic diagram of UBE2C expression plasmid fused with Halotag and results of protein electrophoresis A: Schematic diagram of the Halotag-labelled UBE2C plasmid structure; B: Silver-stained SDS-PAGE gel of proteins immunoprecipitated from HCCLM3 cells extracted by Halotag-labelled UBE2C and negative control protein. The arrow indicates the region of the gel excised for mass spectrometry determination by the liquid chromatography dual mass spectrometry method. Marker: A mixture of prestained protein ladder; Negative control: Empty plasmid group. UBE2C: Ubiquitin-conjugating enzyme E2C; CMV:Cytomegalovirus; ORF: Open reading frame; MC: Monoclonal site; pUC: pBR322 plasmid vector derivatives first constructed in University of California; SDS-PAGE: Sodium dodecyl sulphate-polyacrylamide gel electrophoresis. |
|
|
表 1 质谱鉴定结果 Tab 1 Mass spectrometry results |
|
|
表 2 生物信息学分析显示β-微管蛋白的泛素化修饰位点 Tab 2 Ubiquitination modification sites of β-tubulin showed by bioinformatics analysis |
2.2 UBE2C与β-微管蛋白相互作用对β-微管蛋白表达的影响
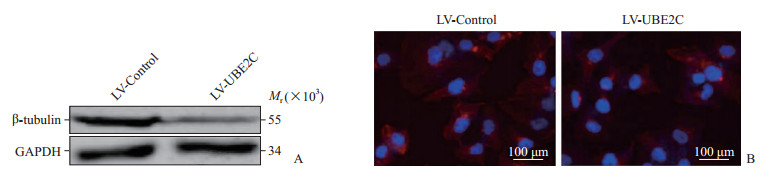
qRT-PCR检测结果显示,在过表达UBE2C的Huh-7细胞中β-微管蛋白在mRNA水平的表达与对照组比较差异无统计学意义(1.03±0.09 vs 1.00±0.10,P=0.81);蛋白质印迹分析检测结果(图 2A)显示,相较于对照组,过表达UBE2C降低了Huh-7细胞中β-微管蛋白的表达,与对照组比较差异有统计学意义(0.49±0.09 vs 1.00±0.06,P<0.01);细胞免疫荧光结果(图 2B)显示,相较于对照组,过表达UBE2C减少了β-微管蛋白在Huh-7细胞胞质中的分布。以上结果提示,肝癌细胞中UBE2C可以降解其底物蛋白β-微管蛋白,影响β-微管蛋白在细胞中的分布。
|
图 2 过表达UBE2C对β-微管蛋白表达及其在细胞中分布的影响 Fig 2 Effect of overexpression of UBE2C on β-tubulin expression and cell distribution A: Expression of β-tubulin in Huh-7 cells after overexpression of UBE2C detected by Western blotting; B: Immunofluorescence staining showing distribution of β-tubulin in Huh-7 cells (β-tubulin was stained with red fluorescence). LV: Lentivirus; UBE2C: Ubiquitin-conjugating enzyme E2C; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
2.3 UBE2C对β-微管蛋白相关的Wnt/β-联蛋白信号通路的影响
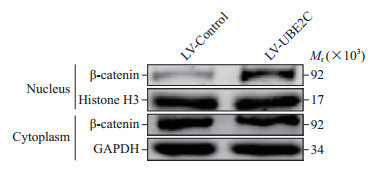
蛋白质印迹分析结果(图 3)显示,过表达UBE2C的Huh-7细胞胞质中β-联蛋白表达水平与对照组比较差异无统计学意义(0.86±0.04 vs 1.00±0.12,P=0.31),而细胞核中β-联蛋白的表达水平升高,与对照组比较差异有统计学意义(3.27±0.18 vs 1.00±0.07,P<0.05),表明过表达UBE2C可以促进β-联蛋白入核。TOP flash/FOP flash荧光素酶报告基因实验结果显示,过表达UBE2C的Huh-7细胞荧光素酶活性较对照组增强,差异有统计学意义(2.03±0.09 vs 1.00±0.12,P<0.01),证明UBE2C对Wnt信号通路有激活作用。
|
图 3 过表达UBE2C可促进Huh-7细胞中β-联蛋白入核 Fig 3 Overexpression of UBE2C can promote β-catenin to enter the nucleus of Huh-7 cells LV: Lentivirus. UBE2C: Ubiquitin-conjugating enzyme E2C; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
2.4 UBE2C对Wnt/β-联蛋白信号通路下游基因表达的影响
qRT-PCR实验结果(图 4A)显示,过表达UBE2C后Huh-7细胞中JNK、CCND1和MMP7在mRNA水平的表达均较对照组上调,差异均有统计学意义(P均<0.05)。蛋白质印迹分析结果(图 4B)显示,过表达UBE2C的Huh-7细胞中JNK、CCND1和MMP7在蛋白质水平的表达均较对照组上调,差异均有统计学意义(1.57±0.11 vs 1.00±0.06,1.90±0.07 vs 1.00±0.05,2.53±0.08 vs 1.00±0.02,P均<0.05)。以上结果表明UBE2C可以促进Huh-7细胞中Wnt信号通路下游基因的表达。

|
图 4 过表达UBE2C促进Huh-7细胞中JNK、CCND1和MMP7基因转录和翻译 Fig 4 Expression of JNK, CCND1 and MMP7 increased with the overexpression of UBE2C in Huh-7 cells A: mRNA expression detected by quantitative real-time polymerase reaction; B: Protein expression detected by Western blotting. *P < 0.05, **P < 0.01 vs LV-Control group. n=3, x±s. LV: Lentivirus; UBE2C: Ubiquitin-conjugating enzyme E2C; JNK: c-Jun N-terminal kinase; CCND1: Cyclin D1; MMP7: Matrix metallopeptidase 7; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. |
3 讨论
泛素化作为一种重要的蛋白翻译后修饰,参与细胞周期调控、细胞凋亡、DNA修复、转录调控、自噬作用等多个重要的胞内反应,对于细胞更新胞内蛋白、清除衰老蛋白及维持内环境稳定具有重要意义。近年来,大量研究表明泛素化过程紊乱与多种疾病特别是肿瘤的发生、发展密切相关[10-13]。泛素化过程依赖E1泛素激活酶、E2泛素结合酶和E3泛素连接酶的协同作用,明确参与肿瘤发生的关键泛素化酶并阐明其作用的具体分子机制已成为肿瘤研究的热点。Jia等[14]的研究显示,E3泛素连接酶家族成员肽基脯氨酰异构酶(亲环蛋白)样2[peptidyl-prolyl isomerase(cyclophilin)-like 2,PPIL2]可以通过特异性结合上皮间质转化的关键分子锌指转录因子SNAI1,促进SNAI1泛素化途径依赖的降解,进而抑制乳腺癌的转移。相似的,E3泛素连接酶3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMG-CoA)在肺癌组织中的表达高于正常组织,HMG-CoA过表达将提高抑癌基因NAD依赖性组蛋白去乙酰化酶2(NAD-dependent histone deacetylase sirtuin 2,SIRT2)的泛素化水平,从而促进肺癌的发生、发展[15]。
本实验关注了E2泛素结合酶家族中重要的癌胚分子UBE2C。考虑到UBE2C分子结构的复杂性,在筛选肝癌细胞中UBE2C相互作用分子时采用了Halotag共沉淀技术。将共沉淀产物进行SDS-PAGE后,银染结果显示,UBE2C融合表达组的沉淀中存在特异性条带,质谱分析结果表明β-微管蛋白是差异条带的主要组成成分。生物信息学分析结果显示β-微管蛋白中存在多个潜在的泛素化位点,由此推测β-微管蛋白可能是UBE2C在肝癌细胞中特异性结合的底物分子。为了验证UBE2C对β-微管蛋白表达是否存在调控作用,我们在肝癌细胞Huh-7中过表达UBE2C。蛋白质印迹分析结果表明,过表达UBE2C降低了肝癌细胞中β-微管蛋白在蛋白水平的表达;qRT-PCR检测结果显示,β-微管蛋白在mRNA水平的表达没有显著改变。以上研究结果提示,肝癌细胞中UBE2C可以通过与β-微管蛋白的特异性结合促进β-微管蛋白的降解。
β-微管蛋白是微管蛋白家族的重要成员之一,它与α-微管蛋白紧密结合形成微管蛋白异二聚体,参与细胞骨架构成、形态维持、细胞收缩、有丝分裂及信号转导等重要生命活动过程。肿瘤细胞处于一种异常增殖的状态,较之于正常细胞,肿瘤细胞的细胞周期调控出现异常且有丝分裂更加频繁,微管蛋白的解聚和组合加快。有研究显示,促进肝癌细胞中β-微管蛋白的释放将抑制Wnt/β-联蛋白信号通路,从而延缓肝癌的发生、发展[16]。因此,我们推测UBE2C通过降解β-微管蛋白激活Wnt/β-联蛋白信号通路,从而参与肝癌的进展。荧光素酶报告基因测定实验和亚细胞蛋白质抽提实验结果显示,在肝癌细胞中过表达UBE2C可促进β-联蛋白入核,提高β-联蛋白在细胞核中的表达,激活Wnt/β-联蛋白信号通路。同时,qRT-PCR和蛋白质印迹分析结果显示,过表达UBE2C提高了Wnt信号通路下游基因JNK、CCND1和MMP7的转录和翻译。
综上所述,在肝癌细胞中β-微管蛋白是UBE2C的底物蛋白,且UBE2C通过介导β-微管蛋白的降解促进β-联蛋白入核,激活Wnt信号通路及其下游基因表达。本实验筛选到肝癌中UBE2C结合的底物蛋白,加深了对泛素化酶在肝癌进展中作用的认识,为UBE2C在肝癌诊断和治疗中的应用提供了新的依据。
| [1] |
ARZUMANYAN A, REIS H M, FEITELSON M A. Pathogenic mechanisms in HBV- and HCV-associated hepatocellular carcinoma[J]. Nat Rev Cancer, 2013, 13: 123-135. DOI:10.1038/nrc3449 |
| [2] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [3] |
CHANG L, ZHANG Z, YANG J, MCLAUGHLIN S H, BARFORD D. Atomic structure of the APC/C and its mechanism of protein ubiquitination[J]. Nature, 2015, 522: 450-454. DOI:10.1038/nature14471 |
| [4] |
VAN REE J H, JEGANATHAN K B, MALUREANU L, VAN DEURSEN J M. Overexpression of the E2 ubiquitin-conjugating enzyme UbcH10 causes chromosome missegregation and tumor formation[J]. J Cell Biol, 2010, 188: 83-100. DOI:10.1083/jcb.200906147 |
| [5] |
OKAMOTO Y, OZAKI T, MIYAZAKI K, AOYAMA M, MIYAZAKI M, NAKAGAWARA A. UbcH10 is the cancer-related E2 ubiquitin-conjugating enzyme[J]. Cancer Res, 2003, 63: 4167-4173. |
| [6] |
ZHANG J, LIU X, YU G, LIU L, WANG J, CHEN X, et al. UBE2C is a potential biomarker of intestinal-type gastric cancer with chromosomal instability[J/OL]. Front Pharmacol, 2018, 9: 847. DOI: 10.3389/fphar.2018.00847.
|
| [7] |
GUO J, WU Y, DU J, YANG L, CHEN W, GONG K, et al. Deregulation of UBE2C-mediated autophagy repression aggravates NSCLC progression[J/OL]. Oncogenesis, 2018, 7: 49. DOI: 10.1038/s41389-018-0054-6.
|
| [8] |
LIU G, ZHAO J, PAN B, MA G, LIU L. UBE2C overexpression in melanoma and its essential role in G2/M transition[J]. J Cancer, 2019, 10: 2176-2184. DOI:10.7150/jca.32731 |
| [9] |
WEI Z, LIU Y, QIAO S, LI X, LI Q, ZHAO J, et al. Identification of the potential therapeutic target gene UBE2C in human hepatocellular carcinoma: an investigation based on GEO and TCGA databases[J]. Oncol Lett, 2019, 17: 5409-5418. |
| [10] |
MANSOUR M A. Ubiquitination: friend and foe in cancer[J]. Int J Biochem Cell Biol, 2018, 101: 80-93. DOI:10.1016/j.biocel.2018.06.001 |
| [11] |
POPOVIC D, VUCIC D, DIKIC I. Ubiquitination in disease pathogenesis and treatment[J]. Nat Med, 2014, 20: 1242-1253. DOI:10.1038/nm.3739 |
| [12] |
VADASZ I, WEISS C H, SZNAJDER J I. Ubiquitination and proteolysis in acute lung injury[J]. Chest, 2012, 141: 763-771. DOI:10.1378/chest.11-1660 |
| [13] |
BRAZEE P, DADA L A, SZNAJDER J I. Role of linear ubiquitination in health and disease[J]. Am J Respir Cell Mol Biol, 2016, 54: 761-768. DOI:10.1165/rcmb.2016-0014TR |
| [14] |
JIA Z, WANG M, LI S, LI X, BAI X Y, XU Z, et al. U-box ubiquitin ligase PPIL2 suppresses breast cancer invasion and metastasis by altering cell morphology and promoting SNAI1 ubiquitination and degradation[J/OL]. Cell Death Dis, 2018, 9: 63. DOI: 10.1038/s41419-017-0094-4.
|
| [15] |
LIU L, YU L, ZENG C, LONG H, DUAN G, YIN G, et al. E3 ubiquitin ligase HRD1 promotes lung tumorigenesis by promoting sirtuin 2 ubiquitination and degradation[J/OL]. Mol Cell Biol, 2020, 40: e00257-19. DOI: 10.1128/MCB.00257-19.
|
| [16] |
MAO J, WANG D, WANG Z, TIAN W, LI X, DUAN J, et al. Combretastatin A-1 phosphate, a microtubule inhibitor, acts on both hepatocellular carcinoma cells and tumor-associated macrophages by inhibiting the Wnt/β-catenin pathway[J]. Cancer Lett, 2016, 380: 134-143. DOI:10.1016/j.canlet.2016.06.020 |
 2021, Vol. 42
2021, Vol. 42


