2. 空军军医大学基础医学院微生物学教研室, 西安 710032
2. Department of Microbiology, College of Basic Medical Sciences, Air Force Medical University, Xi'an 710032, Shannxi, China
黄热病毒(yellow fever virus,YFV)属于黄病毒科黄病毒属成员,是一类有包膜的正义单链RNA病毒[1],其感染引起的黄热病目前主要在非洲和南美洲等热带地区流行[2-3]。黄热病患者临床表现为高热、黄疸、出血、肝功能衰竭等[4],目前尚无有效的治疗药物,临床上仅给予对症和支持治疗[3, 5-6]。尽管YFV疫苗在一定程度上降低了黄热病的发病率,但由于疫苗覆盖率低,非洲、美洲等地仍出现周期性的黄热病暴发[7],并且随着全球化进程YFV感染范围不断扩大,已有多个国家和地区报道过黄热病输入病例,我国也有输入性病例的报道[8]。据统计,全球每年YFV感染人数高达20万,死亡人数超过6万[9],严重威胁人类的生命健康。鉴于YFV感染多发于热带地域,其防控研究对于中非合作和“一带一路”建设非常重要。
利福平是临床常用的抗结核分枝杆菌药物,抗菌机制主要是选择性抑制结核分枝杆菌DNA依赖的RNA聚合酶,阻碍mRNA转录[10-11],目前尚未见到其具有抗病毒活性的报道。我们前期从美国FDA小分子药物库中筛选出10 μmol/L利福平能有效抑制YFV感染,本研究对其抗YFV感染的效果及机制进行了初步研究。
1 材料和方法 1.1 细胞培养与病毒制备人肝癌细胞Huh-7、非洲猴肾细胞Vero由海军军医大学(第二军医大学)海军医学系生物医学防护教研室保存,用含10% FBS、非必需氨基酸、100 U/mL青链霉素双抗和2 mmol/L L-谷氨酰胺的DMEM培养液培养,培养条件为37 ℃、5% CO2。YFV疫苗株(YFV-17D)在Vero细胞内增殖,待出现明显细胞病变后收集上清,分装后存储在-80 ℃冰箱。将病毒上清倍比稀释后,加入提前接种有Vero细胞的24孔板,通过空斑形成实验检测滴度。
1.2 药物与试剂利福平(批号:HY-B0272,纯度为98.07%)购自美国MCE公司。CCK-8细胞活性检测试剂盒购自日本同仁化学研究所。DMEM培养基、Opti-MEM Ⅰ培养基、FBS、胰蛋白酶、EDTA均购自美国Gibco公司。小鼠Alexa Fluor® 488二抗、DAPI、TRIzol试剂、DMSO、荧光标记的霍乱毒素B亚基(cholera toxin B,CTB)、转铁蛋白(transferrin,TF)购自美国Invitrogen公司,小鼠抗YFV多克隆抗体为本实验室用甲醛灭活的全病毒免疫小鼠制备。
1.3 CCK-8细胞活性检测Huh-7细胞接种于96孔板中培养过夜。第2天将不同浓度(0.04、0.2、1、5、25、125、625 μmol/L)的利福平加入96孔板中,以DMSO作为对照。继续培养24 h后吸弃上清,每孔加入10% CCK-8试剂孵育1 h,随后用酶标仪测定450 nm波长处的光密度(D)值,计算不同浓度药物处理下的细胞活性,评价利福平的细胞毒性并计算其细胞半数毒性浓度(50% cytotoxic concentration,CC50)。
1.4 YFV感染活性检测Huh-7细胞提前1晚接种于96孔板中。第2天加入YFV(感染复数为1)感染6h,同时分别加入0.04、0.2、1、5、25 μmol/L的利福平,以DMSO作为对照。药物作用6 h后,弃上清,补加含10% FBS的DMEM培养液100 μL,37 ℃孵育24 h,吸弃上清。甲醇溶液固定后依次加入小鼠抗YFV多克隆抗体、抗小鼠Alexa Fluor® 488二抗、DAPI,用细胞成像及分析系统(BioTek Cytation 5 Imaging Reader)进行免疫荧光检测并计数阳性克隆,评价利福平抗YFV感染的剂量效应,并计算IC50。
1.5 利福平抗YFV感染时效检测Huh-7细胞提前1晚接种于96孔板中。第2天加入YFV(感染复数为1)感染6h,同时加入5 μmol/L利福平分别作用2、4、8、12和24 h,以DMSO作为对照。药物作用结束后,弃上清,补加含10% FBS的DMEM培养液100 μL,37 ℃孵育24 h,吸弃上清,部分孔中加入10% CCK-8试剂孵育1 h,随后用酶标仪测定450 nm波长处的D值,评价利福平的细胞毒性;部分孔中加入甲醇溶液固定后依次加入小鼠抗YFV多克隆抗体、抗小鼠Alexa Fluor® 488二抗、DAPI,用细胞成像及分析系统进行免疫荧光检测并计数阳性克隆,评价利福平抗YFV感染的时间效应。
1.6 YFV感染的动力时间窗实验Huh-7细胞提前1晚接种于96孔板中。第2天,分别于加入YFV感染前2h、加入病毒同时、病毒感染后2、4、6、8、10、12 h加入利福平(25 μmol/L),利福平作用时间为2 h(病毒感染12 h后加入利福平的作用时间段为12~24 h),病毒感染2 h。以DMSO作为对照。药物处理结束后换含10% FBS的DMEM培养液100 μL继续培养24 h,甲醇溶液固定后依次加入小鼠抗YFV多克隆抗体、抗小鼠Alexa Fluor® 488二抗、DAPI,用细胞成像及分析系统进行免疫荧光检测,计算靶细胞感染病毒的情况。
1.7 YFV结合靶细胞的影响Huh-7细胞提前1晚接种于96孔板和24孔板中。第2天将YFV与靶细胞在冰上孵育,使病毒结合在细胞表面,同时加入利福平(25μmol/L)处理2 h。以DMSO作为对照。药物处理后吸弃上清,用预冷PBS清洗2次。96孔板中补加含10% FBS的DMEM培养液100 μL,继续培养24 h后用细胞成像及分析系统进行免疫荧光检测;24孔板直接加入TRIzol试剂裂解细胞,抽提总RNA,用qRT-PCR检测结合在靶细胞表面的YFV RNA水平。
1.8 利福平对YFV内吞入靶细胞的影响Vero细胞提前1晚接种于96孔板中。第2天将标记了荧光的内吞试剂CTB/TF与利福平(25μmol/L)同时加入96孔板。以DMSO作为对照。37 ℃孵育6 h后吸弃上清,甲醇溶液固定后,用细胞成像及分析系统进行免疫荧光检测。
1.9 统计学处理应用GraphPad Prism 7软件进行数据处理和统计学分析。实验数据以x±s表示,利福平处理组与对照组(DMSO组)之间差异的比较采用双因素方差分析。检验水准(α)为0.05。
2 结果 2.1 利福平细胞毒性较低,且能抑制YFV感染靶细胞CCK-8检测结果显示,利福平对Huh-7细胞的毒性较低,当浓度达到625μmol/L时才表现出一定毒性(图 1A),其CC50为176.9 μmol/L。利福平对YFV的感染具有抑制作用,且呈浓度梯度依赖性(图 1B、1C),药物浓度达到25 μmol/L时利福平对YFV抑制率达99%。计算得利福平IC50为1.868 μmol/L,选择指数(SI值)为94.7。
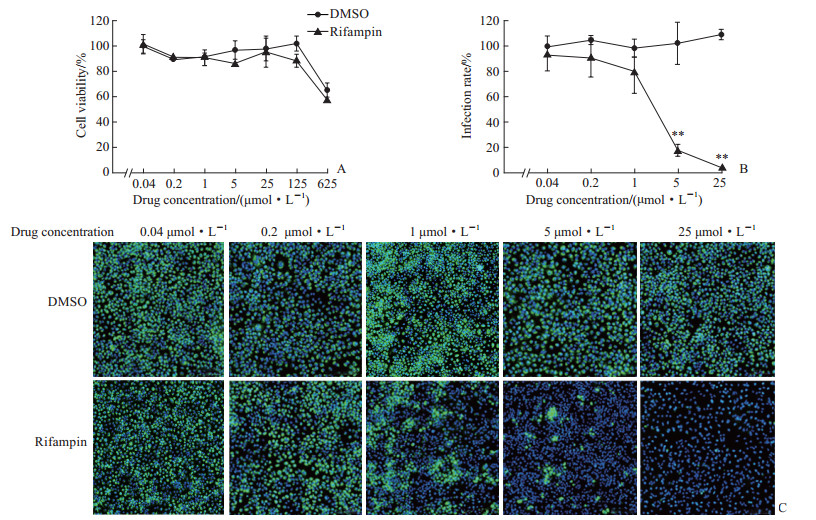
|
图 1 不同浓度利福平对细胞活性及YFV感染的影响 Fig 1 Effect of different concentrations of rifampin on cell viability and YFV infection A: Cell viability of Huh-7 cells treated with rifampin for 24 h detected by CCK-8 assay; B: Infection rate of YFV (MOI=1) in Huh-7 cells treated with rifampin detected by immunofluorenscence; C: Representative immunofluorenscence pictures (10×). **P < 0.01 vs DMSO group. n=3, x±s. YFV: Yellow fever virus; DMSO: Dimethyl sulfoxide; CCK-8: Cell counting kit 8; MOI: Multiplicity of infection. |
2.2 利福平抗YFV感染具有时间依赖性
随着利福平(5 μmol/L)作用时间的延长,其对YFV的抑制效果逐渐增加,24 h时其抑制率达90%以上且对细胞无毒性(图 2)。
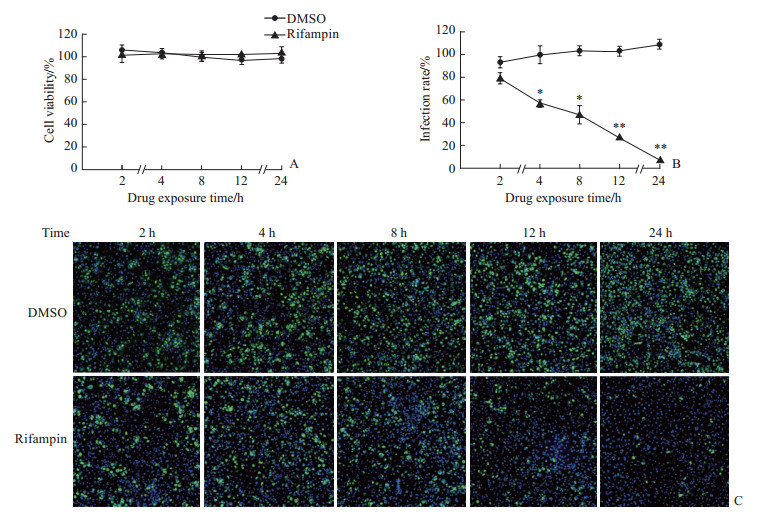
|
图 2 利福平(5 μmol/L)作用不同时长对细胞活性及YFV感染的影响 Fig 2 Effect of rifampin (5 μmol/L) with different exposure durations on cell viability and YFV infection A: Cell viability of Huh-7 cells treated with rifampin detected by CCK-8 assay; B: Infection rate of YFV (MOI=1) in Huh-7 cells treated with rifampin detected by immunofluorenscence; C: Representative immunofluorenscence pictures (10×). *P < 0.05, **P < 0.01 vs DMSO. n=3, x±s. YFV: Yellow fever virus; DMSO: Dimethyl sulfoxide; CCK-8: Cell counting kit 8; MOI: Multiplicity of infection. |
2.3 利福平主要在YFV感染早期的入侵阶段发挥抗病毒作用
动力时间窗实验结果表明,在YFV感染后0~2 h加入利福平的抑制效果最为明显,抑制率可达90%以上;提前2 h加入药物处理并不能有效阻止病毒感染靶细胞;此外,随着药物作用时间段的延后利福平对YFV感染的抑制效果逐渐下降;然而,感染12 h后加入利福平也有一定的抗YFV效果。这些结果提示,利福平主要在YFV入侵阶段发挥抗病毒作用,对入侵后的复制或释放阶段也有一定的抑制效果。见图 3。
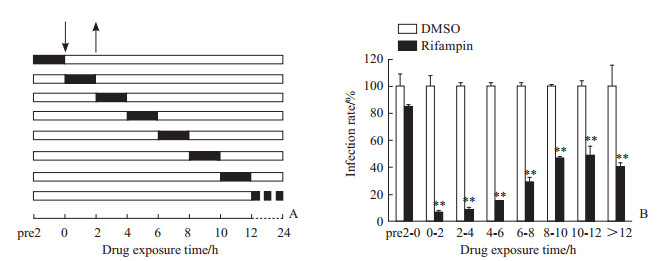
|
图 3 YFV感染不同阶段加入利福平(25 μmol/L)对病毒感染的影响 Fig 3 Effect of rifampin (25 μmol/L) on YFV infection after different exposure durations A: Kinetic test of rifampin on YFV infection (▃ : Intervention time of rifampin; ↓: Time point of adding YFV; ↑: End of YFV infection). B: The infection rate was detected by immunofluorenscence. **P < 0.01 vs DMSO group. n=3, x±s. YFV: Yellow fever virus; DMSO: Dimethyl sulfoxide. |
2.4 利福平通过干扰YFV与靶细胞的结合抑制病毒入侵
结果显示,25 μmol/L的利福平能抑制YFV结合至靶细胞表面,免疫荧光检测抑制效果可达90%以上(P<0.01,图 4),YFV RNA检测的抑制效果也在70%以上(28.51±1.93 vs 100.29±7.57,P<0.01)。

|
图 4 利福平(25 μmol/L)对YFV与靶细胞结合的影响 Fig 4 Effect of rifampin (25 μmol/L) on YFV binding to target cells A: Representative immunofluorenscence pictures (10×); B: Viral binding to target cells was detected by immunofluorenscence 24 h post infection. **P < 0.01 vs DMSO group. n=3, x±s. YFV: Yellow fever virus; DMSO: Dimethyl sulfoxide. |
2.5 利福平不影响YFV感染靶细胞的内吞过程
结果(图 5)显示,25 μmol/L利福平不影响YFV靶细胞对TF和CTB的内吞,因此利福平不抑制YFV入侵阶段内吞过程。
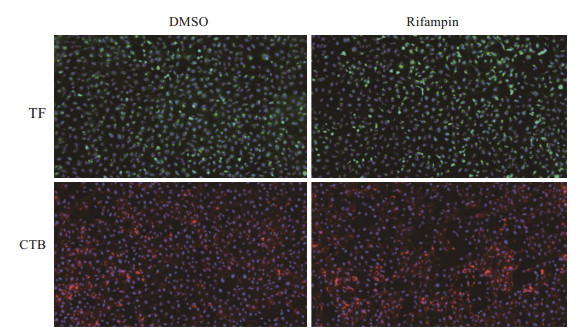
|
图 5 利福平(25 μmol/L)对YFV内吞入靶细胞的影响 Fig 5 Effect of rifampin (25 μmol/L) on the endocytosis of YFV into target cells Representative immunofluorenscence pictures (10×). YFV: Yellow fever virus; DMSO: Dimethyl sulfoxide; TF: Transferrin; CTB: Cholera toxin B. |
3 讨论
在非洲和南美洲,YFV仍然是导致致命性出血热的重要病原体[12]。YFV的分子结构、流行病学特点、传播途径等已基本明确,但目前仍未有特异性、高效的抗病毒药物,加之病毒流行区疫苗接种普及率低,在疫情高发区黄热病的病死率仍非常高。本研究发现,常用抗菌药物利福平能抑制YFV感染靶细胞。利福平作为一种经典的抗结核分枝杆菌药物,动力学及代谢学等方面的数据已成熟完善,长期临床应用安全性较好,最大安全剂量可达35 mg/kg,甚少出现严重的不良反应[13]。本研究体外实验结果显示,利福平主要在病毒感染早期的入侵阶段拮抗YFV感染靶细胞,在感染晚期阶段也能发挥一定的抑制效果。我们初步分析利福平抑制YFV入侵的机制和方式是其干扰了病毒与靶细胞表面的结合。本研究结果表明,提前加入利福平不能阻止YFV感染靶细胞,而利福平与细胞、病毒同时孵育却能有效抑制病毒感染,因此,我们认为利福平可能通过某种机制破坏了病毒表面与靶细胞结合的相关蛋白,从而抑制YFV入侵靶细胞。
入侵是病毒与宿主作用的最先过程,在此阶段干预可避免后续所有感染步骤的发生,起到预防和治疗感染的作用。疫苗不推荐用于幼儿、年迈及有免疫力缺陷等特定的高危人群,同时具有预防性和治疗性作用的药物可降低这些人群的患病率和病死率。
本研究在细胞层面证实利福平具有抗YFV感染的作用,并对其机制做了初步探索,其抗病毒靶点及具体的分子作用机制还需进一步研究,动物体内利福平的抗病毒活性也需进一步评价。
| [1] |
GUARNER J, HALE G L. Four human diseases with significant public health impact caused by mosquito-borne flaviviruses:West Nile, Zika, dengue and yellow fever[J]. Semin Diagn Pathol, 2019, 36: 170-176. DOI:10.1053/j.semdp.2019.04.009 |
| [2] |
BECK A, GUZMAN H, LI L, ELLIS B, TESH R B, BARRETT A D T. Phylogeographic reconstruction of African yellow fever virus isolates indicates recent simultaneous dispersal into east and west Africa[J/OL]. PLoS Negl Trop Dis, 2013, 7: e1910. DOI: 10.1371/journal.pntd.0001910.
|
| [3] |
MONATH T P, VASCONCELOS P F C. Yellow fever[J]. J Clin Virol, 2015, 64: 160-173. DOI:10.1016/j.jcv.2014.08.030 |
| [4] |
HOLANDA G M, CASSEB S M M, MELLO K F L, VASCONCELOS P F C, CRUZ A C R. Yellow fever virus modulates the expression of key proteins related to the microRNA pathway in the human hepatocarcinoma cell line HepG2[J]. Viral Immunol, 2017, 30: 336-341. DOI:10.1089/vim.2016.0149 |
| [5] |
MENDES E A, DE PILGER D R B, DE SEIXAS SANTOS NASTRI A C, DE MELLO MALTA F, PASCOALINO B D S, D'ALBUQUERQUE L A C, et al. Sofosbuvir inhibits yellow fever virus in vitro and in patients with acute liver failure[J]. Ann Hepatol, 2019, 18: 816-824. DOI:10.1016/j.aohep.2019.09.001 |
| [6] |
GARDNER C L, RYMAN K D. Yellow fever:a reemerging threat[J]. Clin Lab Med, 2010, 30: 237-260. DOI:10.1016/j.cll.2010.01.001 |
| [7] |
KLEINERT R D V, MONTOYA-DIAZ E, KHERA T, WELSCH K, TEGTMEYER B, HOEHL S, et al. Yellow fever: integrating current knowledge with technological innovations to identify strategies for controlling a re-emerging virus[J/OL]. Viruses, 2019, 11: 960. DOI: 10.3390/v11100960.
|
| [8] |
WANG Y, WANG X, LIU X, REN R, ZHOU L, LI C, et al. Epidemiology of imported infectious diseases, China, 2005-2016[J]. Emerg Infect Dis, 2018, 25: 33-41. DOI:10.3201/eid2501.180178 |
| [9] |
FARIA N R, KRAEMER M U G, HILL S C, GOES DE JESUS J, AGUIAR R S, IANI F C M, et al. Genomic and epidemiological monitoring of yellow fever virus transmission potential[J]. Science, 2018, 361: 894-899. DOI:10.1126/science.aat7115 |
| [10] |
WANG X, GRACE P M, PHAM M N, CHENG K, STRAND K A, SMITH C, et al. Rifampin inhibits Toll-like receptor 4 signaling by targeting myeloid differentiation protein 2 and attenuates neuropathic pain[J]. Faseb J, 2013, 27: 2713-2722. DOI:10.1096/fj.12-222992 |
| [11] |
TEMPLE M E, NAHATA M C. Rifapentine:its role in the treatment of tuberculosis[J]. Ann Pharmacother, 1999, 33: 1203-1210. DOI:10.1345/aph.18450 |
| [12] |
BEASLEY D W C, MCAULEYA J, BENTE D A. Yellow fever virus:genetic and phenotypic diversity and implications for detection, prevention and therapy[J]. Antiviral Res, 2015, 115: 48-70. DOI:10.1016/j.antiviral.2014.12.010 |
| [13] |
HAAS M K, BELKNAP R W. Updates in the treatment of active and latent tuberculosis[J]. Semin Respir Crit Care Med, 2018, 39: 297-309. DOI:10.1055/s-0038-1660863 |
 2021, Vol. 42
2021, Vol. 42


