2. 东部战区空军医院药学部, 南京 210002;
3. 海军军医大学(第二军医大学)基础医学院学员一队, 上海 200433;
4. 海军军医大学(第二军医大学)药学系有机化学教研室, 上海 200433
2. Department of Pharmacy, Air Force Hospital of PLA Eastern Theater Command, Nanjing 210002, Jiangsu, China;
3. The First Student Team, College of Basic Medical Sciences, Naval Medical University(Second Military Medical University), Shanghai 200433, China;
4. Department of Organic Chemistry, School of Pharmacy, Naval Medical University(Second Military Medical University), Shanghai 200433, China
木兰科(Magnoliaceae)五味子属(Schisandra)植物五味子作为滋补强壮中药,在民间已有两千多年的应用历史。《神农本草经》始记:“五味子主治益气,咳逆上气,劳伤羸瘦;补不足,强阴,益男子精”[1-2]。南五味子(华中五味子,Schisandra sphenanthera Rehd. et Wils.)与五味子[北五味子,Schisandra chinensis (Turcz.)Baill.]均被2015版《中华人民共和国药典》收录,主要功效为敛肺滋肾、益气生津,固表敛汗、涩精止泻、宁心安神[3]。南五味子和北五味子的主要化学成分为木质素类和三萜类化合物,木质素类化合物主要有五味子甲素、五味子乙素、五味子醇甲(schisandrin,SD)、五味子醇乙、五味子酯甲(schisantherin A,STA)等,三萜类化合物主要有五味子酸、五内酯、长南酸等[4-5]。2015版《中华人民共和国药典》规定南、北五味子的HPLC检测质量标准为:北五味子中SD含量不低于0.4%,南五味子中STA含量不低于0.2%[3],但对于五味子中三萜类化合物的含量均未做相应规定。
我们前期研究发现,五味子中四环三萜酸如甘五酸(schisandronic acid,SA)和黑老虎酸(coccinic acid,CA)等具有较好的抗丙型肝炎病毒(hepatitis C virus,HCV)活性[6]。进一步的机制研究结果表明,SA与现有药物的作用靶点不同,其可干扰HCV与细胞受体的结合,阻止HCV入侵细胞过程,是一种新型病毒入侵抑制剂,并可以协同干扰素或特拉匹韦发挥抗HCV作用;体内实验结果证明SA具有抗HCV作用[6]。目前南五味子和北五味子中四环三萜酸类成分含量的研究未见报道,此外不同产地的中药材往往存在化学物质含量差异较大的问题[7-14],因此有必要建立一种能够检测不同来源五味子中三萜酸类成分含量的方法,为五味子在抗HCV方面的应用及提升中药五味子的质量标准提供基础。基于此,本研究首次建立了能同时测定五味子属植物中SA和CA含量的HPLC方法,并考察了7个不同产地五味子中SA和CA的含量差异。
1 仪器、试剂和样品来源Waters e2695型高效液相色谱仪、Waters 2489型双波长紫外检测器、Empower 3工作站[沃特世科技(上海)有限公司],KQ2200DE型超声波仪(昆山市超声仪器有限公司),Sartorius BS 124S型电子天平[赛多利斯科学仪器(北京)有限公司],HHS-21-2B型电热恒温水浴锅(上海医疗器械五厂),SPSS分析软件(SPSSAU)。
甲醇(色谱纯,霍尼韦尔贸易上海有限公司),其余试剂均为分析纯。水为重蒸去离子水。SA对照品(实验室自制,纯度为97.5%),CA对照品(实验室自制,纯度为91%)。五味子果实2017年购于湖州心良药业有限公司,分别采自辽宁(批号170401)、吉林(批号140502)、湖北(批号140309)、湖南(批号140711)、陕西(批号130411)、山西(批号130521)、河南(批号130618)。五味子果实均经解放军904医院谭兴起主任药师鉴定,辽宁、吉林产地五味子为北五味子[Schisandra chinensis (Turcz.)Baill.],其他5个产地的五味子均为南五味子(Schisandra sphenanthera Rehd. et Wils.)。
2 方法和结果 2.1 色谱条件色谱柱为Waters Symmetry C18柱(4.6 mm×250 mm,5 μm),流动相为甲醇-1%甲酸水溶液(86:14),检测波长220 nm,流速1.0 mL/min,柱温30 ℃,进样量10 μL。
2.2 溶液的配制分别精密称取对照品SA和CA 8 mg,置于10 mL容量瓶中,加甲醇溶解并定容至刻度,制得质量浓度均为800 μg/mL的SA对照品溶液和CA对照品溶液。
精密称取产地为湖南的五味子样品50 g,置于100 mL具塞锥形瓶中,加入甲醇200 mL,超声提取1 h,冷却至室温,过滤,滤液合并转移至50 mL容量瓶中,用甲醇稀释至刻度,摇匀,用微孔滤膜(0.45 μm)过滤即得供试品溶液。
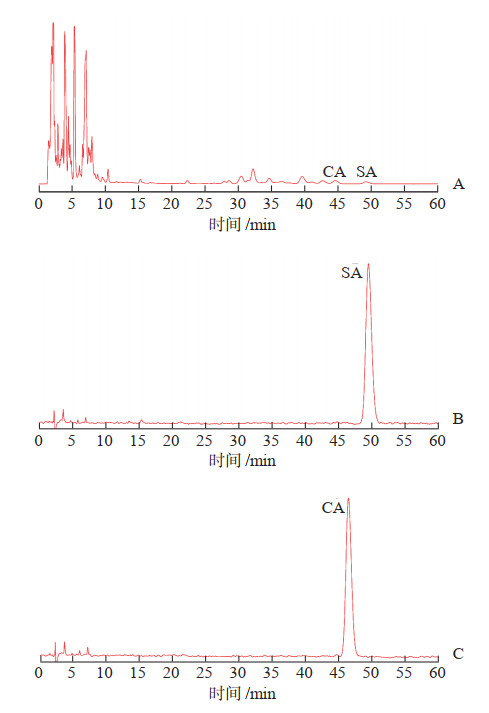
2.3 系统适应性考察取对照品溶液和供试品溶液各10 μL。按2.1项下色谱条件进样。结果表明SA、CA与其他峰分离良好,分离度分别为1.60、1.51,保留时间分别为SA 49.151 min、CA 44.546 min,美国药典(United States Pharmacopeia,USP)理论塔板数分别为15 836、13 767。HPLC图谱见图 1。
|
图 1 湖南产五味子样品和甘五酸(SA)对照品、黑老虎酸(CA)对照品的HPLC图谱 A:湖南产五味子样品;B:SA对照品;C:CA对照品.HPLC:高效液相色谱. |
2.4 线性关系考察
精密吸取SA、CA对照品溶液各5 mL分别移至10 mL容量瓶中,加入甲醇至刻度,配制成质量浓度为400 μg/mL的对照品溶液。取2种对照品溶液各5 mL分别移至10 mL容量瓶中,加入甲醇至刻度,配制成质量浓度为200 μg/mL的对照品溶液,同法分别依次对半稀释配制成质量浓度为100、50、25 μg/mL的对照品溶液,再取25 μg/mL的对照品溶液各4 mL分别移至10 mL容量瓶中,加入甲醇至刻度,配制成质量浓度为10 μg/mL的对照品溶液。
分别精密吸取上述配制的对照品溶液各10 μL,按2.1项下色谱条件进样,测定峰面积,以峰面积(Y)对浓度(X)作线性回归,绘制回归方程。结果表明,SA在10~800 μg/mL范围内呈良好的线性关系,回归方程为Y=14 400X+72 979(r=0.999 7,n=3);CA在10~800 μg/mL范围内呈良好的线性关系,回归方程为Y=7 971.1X+97 334(r=0.999 7,n=3)。
2.5 精密度试验各取质量浓度为100 μg/mL的SA对照品溶液和CA对照品溶液,重复进样5次,按2.1项下色谱条件进样,测得SA峰面积分别为1 458 411、1 410 032、1 462 753、1 456 048、1 447 652,计算RSD为1.55%;CA峰面积分别为877 610、860 854、889 541、878 864、857 132,计算RSD为1.48%,结果表明精密度良好。
2.6 重现性试验取湖南产五味子样品5份,分别按2.2项下方法制备供试品溶液,按2.1项下色谱条件进样,测定SA、CA的峰面积,计算得SA、CA的RSD分别为1.81%、1.79%,结果表明该方法重复性好。
2.7 稳定性试验取湖南产五味子样品1份,按2.2项下方法制备供试品溶液,分别放置0、2、4、6、8、12 h后按2.1项下色谱条件进样测定,计算SA、CA的峰面积RSD分别为1.25%、2.55%,结果表明供试品溶液在配置后12 h内稳定。
2.8 回收率试验精密称取已知含量的湖南产五味子样品(SA 0.250 mg/g、CA 0.749 mg/g)6份,分别精密加入SA对照品(200 μg/mL)溶液和CA对照品(200 μg/mL)溶液各0.5 mL,按2.2项下方法制备供试品溶液,按2.1项下色谱条件进样,按2.4项下的标准曲线方程计算SA、CA的含量和加样回收率。SA、CA的平均回收率分别为97.25%(RSD=2.04%,n=6)、96.02%(RSD=2.03%,n=6),结果表明该方法同时测定2种三萜酸类成分回收率良好。
2.9 样品测定结果精密称取不同产地的五味子果实各50 g,分别按2.2项下方法制备供试品溶液,并按2.1项下色谱条件进行SA、CA的含量测定,结果见表 1。
|
|
表 1 不同产地五味子样品中甘五酸(SA)、黑老虎酸(CA)含量测定结果 |
辽宁、吉林产的北五味子中SA、CA含量均低于其他5个产地的样品,同时其SA含量高于CA含量;湖北、湖南、陕西、山西、河南5个产地的南五味子中SA、CA含量丰富,且CA含量均高于SA含量。SA含量最高的为河南产五味子[(0.285±0.015)mg/g],最低的为吉林产五味子[(0.068±0.017)mg/g];CA含量最高的为山西产五味子[(0.927±0.017)mg/g],陕西较之略低,最低的为吉林产五味子[(0.039±0.010)mg/g]。
湖北、湖南、陕西、山西、河南5个产地南五味子的SA含量比较接近,而CA含量的差别略大。
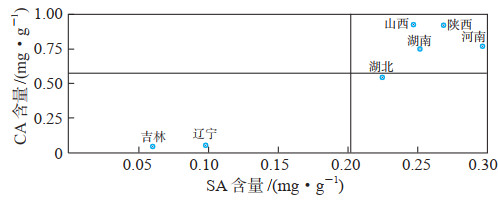
利用SPSSAU在线SPSS分析软件(https://spssau.com/front/spssau/index.html)以SA和CA含量进行象限图分析,结果如图 2所示(X轴和Y轴的交叉点为对应的平均值),可以直观地看出7个产地的五味子样品可以分为两类:吉林、辽宁样品(北五味子)为第1类;其他5个产地样品(南五味子)为第2类,它们的SA和CA含量较第1类高,即南五味子中2种三萜酸类成分含量均高于北五味子。
|
图 2 7个产地五味子样品中的甘五酸(SA)、黑老虎酸(CA)含量象限图 |
2.10 样品中SD、STA含量的测定
参照2015版《中华人民共和国药典》关于北五味子中SD及南五味子中STA含量的测定方法[3],分别精密称取产地为辽宁、吉林的五味子各0.25 g,加入20 mL甲醇超声提取20 min,HPLC法测定,条件如下:色谱柱为Waters Symmetry C18柱(4.6 mm×250 mm,5 μm),流动相为甲醇-水溶液(65:35),检测波长250 nm,流速1.0 mL/min,柱温30 ℃,进样量10 μL。测得辽宁、吉林五味子中SD含量分别为0.67%、0.45%,均>0.4%。
分别精密称取产地为湖北、湖南、陕西、山西、河南的五味子各0.5 g,加入50 mL甲醇超声提取30 min,色谱柱为Waters Symmetry C18柱(4.6 mm× 250 mm,5 μm),流动相为四氢呋喃-水溶液(38:62),检测波长254 nm,流速1.0 mL/min,柱30 ℃,进样量10 μL,测得湖北、湖南、陕西、山西、河南五味子中STA含量分别为0.21%、0.35%、0.63%、0.72%、0.61%,均>0.2%。
7个产地的五味子按2015版《中华人民共和国药典》标准均为合格产品。
3 讨论 3.1 液相条件的选择本研究对色谱柱、洗脱溶剂及比例、检测波长和流速等进行了考察。实验中,常用型号的色谱柱为:Waters Symmetry C18柱(4.6 mm×250 mm,5 μm)、Waters Sunfire C18柱(4.6 mm×250 mm,5 μm)、Waters XBridge C18柱(4.6 mm×250 mm,5 μm),结果显示各型号色谱柱对SA、CA的分离效果并没有明显差异,因此决定使用通用性较强Waters Symmetry C18柱,以增强该方法的适用性。
由于SA、CA是三萜酸类成分,紫外吸收较小,再综合考虑基线稳定性与干扰成分的影响,将检测波长定于220 nm,以获得响应效果较好的液相图谱。
对甲醇与乙腈的分离效果进行考察:SA与CA的极性均较小、样品中的干扰因素较多,乙腈洗脱能力较强导致图谱中干扰峰过多、出峰时间长且分离度低;甲醇条件下SA与CA的出峰时间在55 min以内,时间较长,但分离效度高,因此决定使用甲醇作为洗脱溶剂,并加入少量甲酸以优化峰形。进一步考察甲醇洗脱方式,发现梯度洗脱与等度洗脱相比并没有提高SA与CA的分离效率,综合考虑各种因素,确定以甲醇-1%甲酸水溶液(86:14)作为流动相进行等度洗脱。流速与柱温对SA与CA的分离效果没有明显影响。
本研究首次建立了能同时测定五味子属五味子中的2种三萜酸类成分SA、CA的HPLC法,该法分离度良好,在所测范围内浓度与峰面积线性关系良好,具有简单、准确、可靠、重复性好等特点,可用于五味子属五味子药材的质量控制。
3.2 含量结果分析SA、CA在南五味子中的含量均高于北五味子,且CA含量高于SA;北五味子中SA含量约为CA含量的2倍。南五味子的5个产地中陕西、山西和河南产五味子中CA含量接近,均高于湖北、湖南,因此CA的优选产地为陕西、山西和河南,尤以陕西、山西为最佳;5个产地的SA含量差异不明显,河南稍显优势。此外,SA、CA的结构十分相近,两者往往同时以结晶析出,单独分离难度大。比较7个产地五味子发现,南五味子的析晶中CA比例更高,反复纯化后更容易获得CA;而北五味子的析晶中SA相对比例高,反复纯化后更容易获得SA。此结果也和本实验SA、CA含量测定结果一致。从地域角度分析,辽宁与吉林接壤,处于在北纬38°~46°、东经118°~131°;陕西、山西、河南三地接壤,处于北纬31°~40°、东经105°~116°间;湖北与湖南接壤,处于北纬24°~33°、东经108°~116°。辽宁、吉林纬度相对较高,属于寒温带或温带湿润、半湿润地区,其基本特征是冬季寒冷而漫长,夏季温暖、湿润而短促,温度低、日照少可能是五味子中SA、CA含量低的部分原因。陕西、山西、河南处于中纬度,夏季炎热冬季寒冷,光照充足且日照时间长,形成光热资源丰富、水分资源不足的气候特点,这些产地的五味子中SA、CA含量相对较高可能与光热资源丰富相关[15-18]。
鉴于不同产地五味子中三萜酸类成分含量的差异,治疗病毒性肝炎等相关疾病可能以南五味子为更好。将SA、CA的含量测定列入考察五味子的质量标准中可为临床用药提供选择依据和保障。
| [1] |
江苏新医学院. 中药大辞典(上册)[M]. 上海: 上海科学技术出版社, 2000: 386-389.
|
| [2] |
马继兴. 神农本草经辑注[M]. 北京: 人民卫生出版社, 1995: 249.
|
| [3] |
国家药典委员会. 中华人民共和国药典[S]. 一部. 北京: 中国医药科技出版社, 2015: 244.
|
| [4] |
周英. 五味子科化学分类及五味子属药用植物资源利用研究[D]. 北京: 中国协和医科大学, 2002.
|
| [5] |
李蓉涛. 五种五味子属药用植物及东紫苏化学成分研究[D]. 昆明: 中国科学院昆明植物研究所, 2003.
|
| [6] |
QIAN X J, ZHANG X L, ZHAO P, JIN Y S, CHEN H S, XU Q Q, et al. A Schisandra-derived compound schizandronic acid inhibits entry of pan-HCV genotypes into human hepatocytes[J/OL]. Sci Rep, 2016, 6: 27268. DOI: 10.1038/srep27268.
|
| [7] |
WANG G W, DENG L Q, LUO Y P, LIAO Z H, CHEN M. Hepatoprotective triterpenoids and lignans from the stems of Schisandra pubescens[J]. Nat Prod Res, 2017, 31: 1855-1860. |
| [8] |
XU Y L, WANG Y T, JIANG S P, CAI T T, WANG N N, LIU X, et al. Chemical constituents from the fruit of Schisandra chinesis[J]. J Chin Pharm Sci, 2020, 29: 480-486. |
| [9] |
GUO S S, PANG X, WANG Y, GENG Z F, CAO J Q, LIANG J Y, et al. Chemical constituents isolated from stems of Schisandra chinensis and their antifeedant activity against Tribolium castaneum[J]. Nat Prod Res, 2020, 2595-2601. |
| [10] |
张雯, 朱雅迪, 张起尧, 马丽娟, 杨凌, 郭文治, 等. 五味子在肝脏疾病防治中的应用及其作用机制研究进展[J]. 中国中药杂志, 2020, 45: 3759-3769. |
| [11] |
LU Y, LI Y Q, LIU Y N, LEE K H, CHEN D F. Cytotoxic and potential anticancer constituents from the stems of Schisandra pubescens[J]. Pharm Biol, 2013, 51: 1204-1207. |
| [12] |
王宇晖, 蔡子平. 不同产地南五味子中木脂素和总多糖的比较[J]. 甘肃农业科技, 2018(1): 30-33. |
| [13] |
李筱玲, 邓寒霜. 不同产地南五味子药材质量评价[J]. 中国现代中药, 2018, 20: 1372-1376, 1382. |
| [14] |
郭丽, 杨忠杰, 于晓涛, 贾陆, 金少举, 王瑞. 南、北五味子药材的HPLC指纹图谱建立及化学模式识别分析[J]. 中国药房, 2020, 31: 2224-2229. |
| [15] |
王云变. 山西林业气候特征及人类对其分布影响分析[J]. 中国农业资源与区划, 2010, 31: 23-28. |
| [16] |
田菲. 东北林区药用植被的分布规律[J]. 科学与财富, 2013(2): 146. |
| [17] |
国志兴, 王宗明, 宋开山, 张柏, 李方, 刘殿伟. 1982-2003年东北林区森林植被NDVI与水热条件的相关分析[J]. 生态学杂志, 2007, 26: 1930-1936. |
| [18] |
张永清, 刘合刚. 药用植物栽培学[M]. 北京: 中国中医药出版社, 2013: 271.
|
 2021, Vol. 42
2021, Vol. 42


