2. 宁波美康中医医院检验科, 宁波 315100;
3. 东部战区总医院门诊部, 南京 210006
2. Department of Clinical Laboratory, Ningbo Meikang Traditional Chinese Medicine Hospital, Ningbo 315100, Zhejiang, China;
3. Outpatient Department, General Hospital of PLA Eastern Theater Command, Nanjing 210006, Jiangsu, China
椎间盘退行性变(intervertebral disc degeneration,IDD)是较为常见的脊椎疾病,其发病高峰年龄为50~60岁,近年发现IDD发病呈年轻化趋势[1]。IDD主要表现为腰痛及腰椎支撑功能下降,严重时可引起腰腿痛甚至神经损害,对患者的工作能力和生活质量造成极大影响。因此,寻找IDD早期退变生物标志分子对其早期诊断和治疗具有重要意义。
miRNA是一类长度为20~22 nt的碱基序列,通过靶向靶基因的3'非编码区(3'untranslated region,3'UTR)抑制靶基因的表达[2]。miRNA还参与调控细胞凋亡、自噬、增殖及肿瘤转移等[3-4]。研究表明,miRNA在髓核细胞凋亡及炎症反应中发挥了重要作用[5-6]。本研究通过miRNA表达谱测序数据库,筛选出IDD组织中表达升高最显著的miRNA-603,探讨miRNA-603在IDD发生、发展中的作用及可能机制。
1 材料和方法 1.1 生物信息学分析通过基因表达汇编(gene expression omnibus,GEO)数据库查询到IDD相关的测序数据集,分别为GSE19943、GSE63492和GSE34095,其中GSE19943和GSE63492是miRNA表达谱测序数据集,GSE34095为mRNA表达谱测序数据集。分析比较GSE19943和GSE63492数据集,筛选出3个在IDD组织中均高表达的miRNA:miRNA-603、miRNA-574-3p、miRNA-199a-5p。利用TargetScan、miRTarBase生物信息学网站和GSE34095数据集的IDD mRNA表达谱测序数据获得miRNA-603的靶基因为山梨糖和SH3结构域包含蛋白3(sorbin and SH3 domain-containing protein 3,SORBS3)。
1.2 资料来源收集海军军医大学(第二军医大学)长海医院2018年1月至12月经手术治疗的IDD患者和腰椎骨折患者的椎间盘组织。IDD患者(n=10):男7例、女3例,年龄33~73岁,平均年龄为(53.6±11.6)岁;腰椎骨折患者(n=10):男6例、女4例,年龄34~74岁,平均年龄为(52.7±11.5)岁。本研究通过海军军医大学(第二军医大学)长海医院伦理委员会审批,所有患者均知情同意。
1.3 髓核细胞分离及原代培养从腰椎骨折患者的椎间盘组织中分离出髓核组织,然后用0.25% Ⅱ型胶原酶37 ℃消化3~5 h;用细胞滤网过滤去除杂质,细胞悬液以300×g离心5 min,然后弃上清,获得髓核细胞。用适量的完全培养液重悬细胞后,置于37 ℃ 5% CO2的细胞培养箱中培养。选择2代以后的髓核细胞进行后续实验或冻存备用。
1.4 细胞免疫荧光染色取适量髓核细胞接种于带有细胞爬片的24孔板内,转染miRNA-603模拟物(广州市锐博生物科技有限公司)48 h后,用PBS洗2次,每次3 min;每孔加入500 μL 4%多聚甲醛溶液室温固定15 min;PBS洗3次,每孔加入500 μL 4% Triton X-100室温孵育20 min;PBS洗3次,每孔加入500 μL 2%牛血清白蛋白室温孵育30 min;加入一抗SORBS3抗体(货号NBP2-20861,美国NOVUS公司),4 ℃静置过夜;第2天弃去一抗,PBS洗3次后加入二抗(货号4413,美国CST公司)室温孵育60 min;PBS洗3次后加入DAPI室温孵育5 min;PBST洗2次后收集细胞爬片,荧光显微镜下观察、拍照。
1.5 qRT-PCR分析取50 mg组织,加入TRIzol试剂后用组织匀浆机匀浆,再用RNA抽提试剂盒抽提样品的总RNA并检测浓度。细胞样本直接加入TRIzol试剂后用RNA抽提试剂盒抽提样品,琼脂糖凝胶电泳检测RNA的纯度。用日本TaKaRa公司的miRNA、mRNA反转录试剂盒进行反转录,用日本TaKaRa公司的SYBR Green实时荧光定量PCR预混液试剂盒检测相关基因的表达。引物设计与合成均由生工生物工程(上海)股份有限公司完成,引物序列(5'-3')为miRNA-603正向引物CACACACTGCAATTACTTTTGCAA,反向引物CCAGTGCAGGGTCCGAGGTA;miRNA-574-3p正向引物GCACCAAGCAAGTCTGGAA,反向引物CGAGGCCTCTGTCTTACAGG;miRNA-199a-5p,正向引物ACACTCCAGCTGGGCCCAGTGTTCA-G ACTACC,反向引物CTCAACTGGTGTCGTGG-AGTCGGCAATTCAGTTGAGGAACAGGTA;U6正向引物ACACACACACACACACGTAT,反向引物AAGGATGACACGAAATTC;SORBS3正向引物TCTTCCACATCCCAGTCTCC,反向引物CACAT-GCTTGGTGAAGAACG;IL-6正向引物AGTGAG-GAACAAGCCAGAGC,反向引物AGCTGCGC-AGAATGAGATGA;IL-1β正向引物CCACCTCC-AGGGACAGGATA,反向引物TCAACACGCAG-GACAGGTAC;β-actin正向引物CCCAAGGCC-AACAGGGAAAA,反向引物GGTGCCCATCTCCT-GCTCAA。以2-ΔΔCt计算目的基因的相对表达量。
1.6 蛋白质印迹分析用RIPA裂解液裂解细胞,之后用蛋白浓度检测试剂盒(美国ThermoFisher公司)测定蛋白浓度,把不同浓度的样品调整至相同浓度后加入蛋白上样缓冲液加热变性。上样行SDS-PAGE,之后将蛋白从凝胶转移至NC膜上,室温封闭1 h,加入一抗4 ℃孵育过夜;第2天回收一抗,用PBST洗膜3次,每次5 min;加入对应的二抗,室温孵育1 h,PBST洗膜3次,每次5 min;滴加电化学发光液显影。用ImageJ软件量化分析条带灰度,以目的蛋白与内参蛋白灰度值的比值代表蛋白相对表达量。实验所用一抗包括SORBS3抗体(货号NBP2-20861,美国NOVUS公司)、caspase-1抗体(货号24232,美国CST公司)、cleaved caspase-1抗体(货号89332,美国CST公司)、IL-1β抗体(货号12703,美国CST公司)、微管蛋白抗体(货号2148,美国CST公司)、二抗为HRP标记的抗兔IgG(货号7074S,美国CST公司)。
1.7 双荧光素酶基因报告实验通过UCSC(University of California Santa Cruz)数据库查询到SORBS3 3'UTR序列,将其插入pMIR-report luciferase质粒(上海吉凯基因医学科技股份有限公司),构建pMIR-SORBS3 3'UTR重组质粒,将重组载体和对照空载体转入293T细胞(中国科学院上海细胞库),同时转入Renilla质粒(上海吉凯基因医学科技股份有限公司)作为内参,再分别转入miRNA-603模拟物,24 h后收集细胞。根据双荧光素酶报告基因检测试剂盒(美国Promega公司)说明书进行操作。
1.8 免疫组织化学染色将椎间盘组织石蜡切片脱蜡水化,之后将切片放入PBS中微波炉加热10 min进行抗原修复,取出切片,用正常山羊血清室温封闭20 min,吸取血清后滴加SORBS3抗体,置于4 ℃冰箱过夜;取出切片,用PBS洗3次,每次5 min,加入生物素标记的二抗室温孵育1 h;PBS洗3次,每次5 min,滴加DAB显色液,5 min后PBS洗3次,中性树胶封片拍照。免疫组织化学染色试剂盒及DAB显色试剂盒均购于福州迈新生物技术开发有限公司。
1.9 统计学处理应用SPSS 21.0软件进行统计学分析,用GraphPad Prism 5.0软件制图。判断数据是否服从正态分布(Shapiro-Wilk检验)和方差齐性(Levene检验),符合正态分布且方差齐的计量资料以x±s表示,组间比较采用独立样本t检验或单因素方差分析。检验水准(α)为0.05。
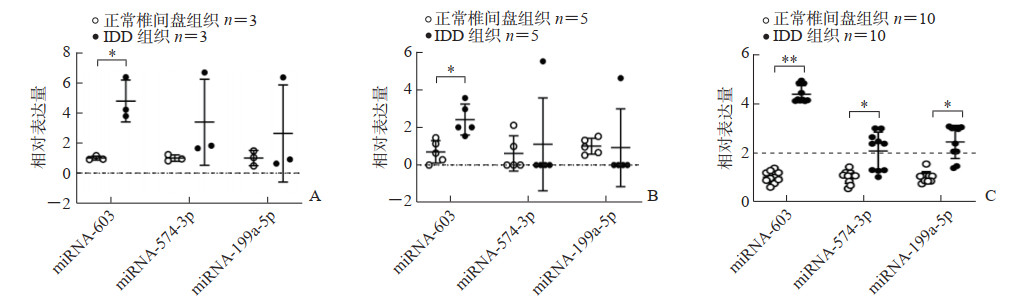
2 结果 2.1 miRNA-603在IDD组织中高表达分析2个IDD miRNA表达谱测序数据集GSE19943和GSE63492,结果显示有3个miRNA在IDD组织中高表达,分别为miRNA-603、miRNA-574-3p、miRNA-199a-5p(图 1A、1B)。为进一步验证这3个miRNA在正常椎间盘组织和IDD组织中的表达差异,我们收集了10例IDD患者和10例腰椎骨折患者椎间盘组织,qRT-PCR结果显示,与正常椎间盘组织相比,IDD组织中3个miRNA的表达均上调(P<0.01,P<0.05),其中miRNA-603表达升高最明显(图 1C)。
|
图 1 miRNA-603在IDD组织中高表达 A:GSE19943 miRNA表达谱测序数据集中miRNA-603、miRNA-574-3p和miRNA-199a-5p的表达;B:GSE63492 miRNA表达谱测序数据集中miRNA-603、miRNA-574-3p和miRNA-199a-5p的表达;C:qRT-PCR检测miRNA-603、miRNA-574-3p和miRNA-199a-5p在IDD患者椎间盘组织和腰椎骨折患者正常椎间盘组织中的表达.*P<0.05,**P<0.01.x±s. miRNA:微RNA;IDD:椎间盘退行性变;qRT-PCR:实时定量聚合酶链反应. |
2.2 miRNA-603促进髓核细胞炎症反应
分离培养正常髓核细胞,用脂质体3000转染miRNA-603对照和模拟物,收集细胞培养上清,qRT-PCR检测结果显示髓核细胞过表达miRNA-603后,可明显诱导IL-6和IL-1β mRNA的表达(P均<0.01,图 2A)。收集细胞裂解液,蛋白质印迹分析检测结果显示,转染miRNA-603模拟物后,cleaved caspase-1和IL-1β表达增加(P均<0.01,图 2B)。用miRNA-603抑制子转染髓核细胞,再用100 ng/mL TNF-α刺激细胞24 h,之后收集细胞培养上清,qRT-PCR检测结果显示髓核细胞转染miRNA-603抑制子后,可明显减弱TNF-α诱导的IL-6和IL-1β mRNA的表达(P均<0.01,图 2C)。收集细胞裂解液,蛋白质印迹分析检测结果显示转染miRNA-603抑制子后,可以抑制cleaved caspase-1和IL-1β的表达(P<0.01,P<0.05;图 2D)。

|
图 2 miRNA-603促进髓核细胞的炎症反应 A:qRT-PCR检测转染miRNA-603模拟物后髓核细胞中IL-6和IL-1β mRNA的表达;B:蛋白质印迹分析检测转染miRNA-603模拟物后髓核细胞中cleaved caspase-1(Casp1)和IL-1β的表达;C:qRT-PCR检测转染miRNA-603抑制子后TNF-α诱导的髓核细胞中IL-6和IL-1β mRNA的表达;D:蛋白质印迹分析检测转染miRNA-603抑制子后TNF-α诱导的髓核细胞中cleaved Casp1和IL-1β的表达.*P<0.05,**P<0.01.n=6,x±s. miRNA:微RNA;qRT-PCR:实时定量聚合酶链反应;IL:白细胞介素;TNF-α:肿瘤坏死因子α. |
2.3 miRNA-603靶向SORBS3促进TNF-α诱导的髓核细胞炎症反应
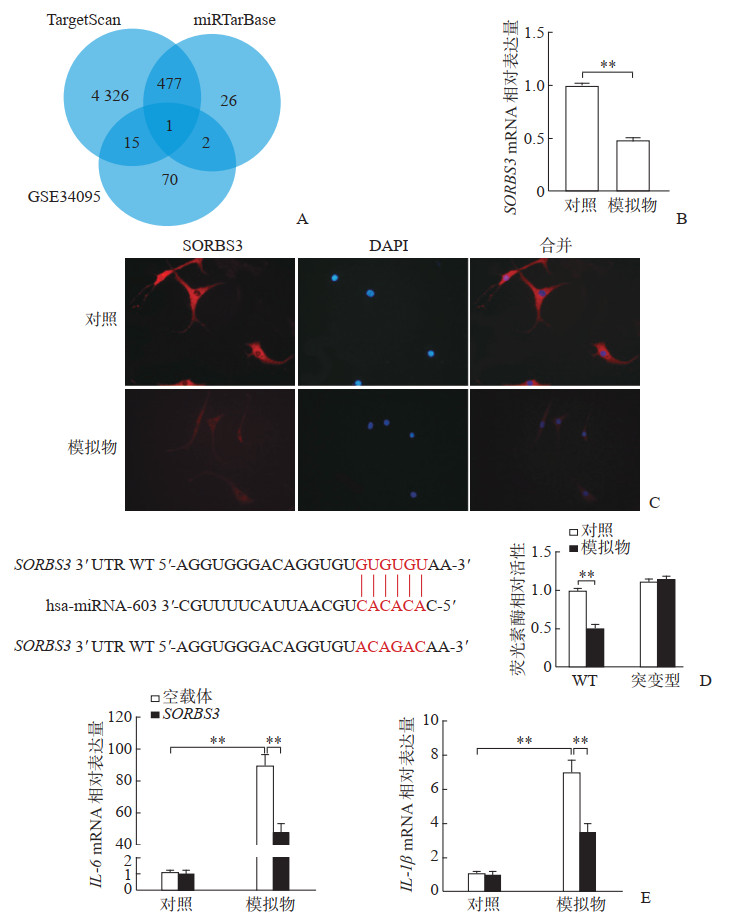
通过生物信息学网站TargetScan和miRTarBase,分别查询到4 819个和506个miRNA- 603的靶基因,其中有478个公共基因,再通过GSE34095 mRNA表达谱测序数据集,发现SORBS3作为miRNA-603的靶基因在IDD组织中低表达(图 3A)。qRT-PCR(图 3B)和细胞免疫荧光染色(图 3C)检测结果显示,髓核细胞中过表达miRNA-603后,SORBS3表达量降低。双荧光素酶报告基因实验结果(图 3D)显示,过表达miRNA-603可以明显抑制野生型荧光素酶报告质粒的活性,当SORBS3 3'UTR结合位点突变后,这种抑制得以恢复,说明miRNA-603可以靶向SORBS3抑制其表达。qRT-PCR检测结果显示,与单独转染miRNA-603模拟物相比,在髓核细胞中同时转染miRNA-603模拟物和SORBS3,诱导的IL-6和IL-1β mRNA表达明显降低(P均<0.01,图 3E)。结果提示miRNA-603通过抑制SORBS3的表达,继而促进髓核细胞的炎症反应。
|
图 3 miRNA-603靶向SORBS3促进TNF-α诱导的炎症反应 A:通过生物信息学网站TargetScan和miRTarBase及GSE34095 mRNA表达谱测序数据集筛选出miRNA-603的靶基因SORBS3;B:qRT-PCR检测过表达miRNA-603后髓核细胞中SORBS3的表达;C:细胞免疫荧光染色检测髓核细胞中SORBS3的表达(200×);D:双荧光素酶报告基因实验验证miRNA-603可靶向调控SORBS3的表达;E:qRT-PCR检测结果表明SORBS3可抑制miRNA-603模拟物诱导的IL-6和IL-1β mRNA表达. **P<0.01.n=6,x±s. miRNA:微RNA;SORBS3:山梨糖和SH3结构域包含蛋白3;TNF-α:肿瘤坏死因子α;DAPI:4’, 6-二脒基-2-苯基吲哚;3'UTR:3'非编码区;WT:野生型;IL:白细胞介素;qRT-PCR:实时定量聚合酶链反应. |
2.4 SORBS3在IDD组织中低表达并可减弱TNF-α诱导的髓核细胞炎症反应
qRT-PCR(图 4A)和免疫组织化学染色(图 4B)结果显示,与正常的椎间盘组织相比,SORBS3在IDD组织中低表达(P<0.01)。为了明确SORBS3的改变能否影响髓核细胞发生炎症反应,我们在髓核细胞中过表达SORBS3,24 h后加入100 ng/mL TNF-α,继续培养24 h后检测炎症相关因子。qRT-PCR检测结果显示,与空载体组加入TNF-α相比,过表达SORBS3组加入TNF-α的细胞中IL-6和IL-1β mRNA表达明显降低(P均<0.01,图 4C)。结果提示SORBS3可以抑制髓核细胞发生炎症反应。

|
图 4 SORBS3在IDD组织中低表达并可减弱TNF-α诱导的炎症反应 A:qRT-PCR检测SORBS3 mRNA在正常椎间盘组织及IDD组织中的表达(**P<0.01.n=10,x±s);B:免疫组织化学染色检测SORBS3在正常椎间盘组织及IDD组织中的表达(40×);C:qRT-PCR检测髓核细胞中过表达SORBS3后TNF-α诱导的IL-6和IL-1β mRNA的表达(**P<0.01.n=6,x±s).SORBS3:山梨糖和SH3结构域包含蛋白3;IDD:椎间盘退行性变;TNF-α:肿瘤坏死因子α;IL:白细胞介素;qRT-PCR:实时定量聚合酶链反应. |
3 讨论
miRNA是一种非编码单链RNA,广泛存在于动植物及部分病毒中,其在基因转录调控中有着重要作用[7]。针对miRNA的研究表明,目前绝大多数疾病均与miRNA的表达异常有关,基于miRNA的发病机制研究及治疗方法已成为研究热点之一[8]。随着研究的不断扩展和深入,miRNA在IDD中的重要功能逐渐被揭示,在椎间盘内环境、椎间盘组织细胞死亡等方面均发挥重要作用[9]。本研究对比了2个IDD miRNA表达谱测序数据集,发现与正常的椎间盘组织相比,miRNA-603在IDD组织中高表达。目前miRNA-603在炎症反应中的作用尚未见报道,仅有部分报道显示,与卵巢癌癌旁组织相比,miRNA-603在卵巢癌组织中低表达,其可以抑制卵巢癌[10];在三阴性乳腺癌中,miRNA-603可以抑制三阴性乳腺癌细胞的生长、迁移和侵袭[11]。
炎症是由有害刺激或病症引起的适应性反应。在IDD的发生、发展过程中,由于椎间盘组织损伤,引起椎间盘组织炎症加剧,产生IL-2、IL-3、IL-8、TNF-α等炎性因子[12]。这些炎性因子一方面可以通过调控一氧化氮和前列腺素的表达增强缓激肽、5-羟色胺等疼痛因子对神经末梢疼痛的加强作用,使患者的症状不断加重[13];另一方面,它们可以降低髓核细胞周围的多糖及胶原量,影响髓核细胞微环境及调控死亡受体通路使椎间盘细胞发生凋亡,进而引起IDD[14]。我们在髓核细胞中过表达miRNA-603,结果显示过表达miRNA-603可以明显诱导IL-6和IL-1β的表达;在以TNF-α刺激作为炎症模型的基础上,抑制miRNA-603的表达,结果显示TNF-α诱导的IL-6和IL-1β表达明显减弱。上述结果说明在髓核细胞中miRNA-603具有诱导炎症反应的作用。通过生物信息学方法,我们预测SORBS3是miRNA-603的靶基因。有研究表明,在肝癌细胞中过表达SORBS3可使IL-6基因表达降低[13]。之后,我们在髓核细胞中过表达miRNA-603,发现SORBS3的表达量明显降低,说明miRNA-603可以抑制SORBS3的表达,双荧光素酶报告基因实验进一步证明SORBS3是miRNA-603的靶基因。在髓核细胞中过表达SORBS3,可以明显抑制TNF-α诱导的IL-6和IL-1β,与加入miRNA-603抑制子诱导的IL-6和IL-1β表达趋势一致,说明miRNA-603可以靶向SORBS3促进TNF-α诱导的炎症反应。
综上所述,本研究发现miRNA-603在IDD组织中表达升高,在髓核细胞中过表达miRNA-603可以诱导炎症反应,SORBS3作为miRNA-603的靶基因具有抑制炎症反应的作用。本研究结果为IDD中髓核细胞炎症的发生提供了理论依据,同时也为椎间盘退变性疾病提供了一个可能的早期诊疗靶点。
| [1] |
YANG S, ZHANG F, MA J, DING W. Intervertebral disc ageing and degeneration: the antiapoptotic effect of oestrogen[J/OL]. Ageing Res Rev, 2020, 57: 100978. DOI: 10.1016/j.arr.2019.100978.
|
| [2] |
VISHNOI A, RANI S. MiRNA biogenesis and regulation of diseases:an overview[J]. Methods Mol Biol, 2017, 1509: 1-10. |
| [3] |
HUANG J, SUN C, WANG S, HE Q, LI D. MicroRNA miR-10b inhibition reduces cell proliferation and promotes apoptosis in non-small cell lung cancer (NSCLC) cells[J]. Mol Biosyst, 2015, 11: 2051-2059. DOI:10.1039/C4MB00752B |
| [4] |
DONG C G, WU W K, FENG S Y, WANG X J, SHAO J F, QIAO J. Co-inhibition of microRNA-10b and microRNA-21 exerts synergistic inhibition on the proliferation and invasion of human glioma cells[J]. Int J Oncol, 2012, 41: 1005-1012. DOI:10.3892/ijo.2012.1542 |
| [5] |
WANG C, WANG W J, YAN Y G, XIANG Y X, ZHANG J, TANG Z H, et al. MicroRNAs:new players in intervertebral disc degeneration[J]. Clin Chim Acta, 2015, 450: 333-341. DOI:10.1016/j.cca.2015.09.011 |
| [6] |
KONG L, SUN M, JIANG Z, LI L, LU B. MicroRNA-194 inhibits lipopolysaccharide-induced inflammatory response in nucleus pulposus cells of the intervertebral disc by targeting TNF receptor-associated factor 6(TRAF6)[J]. Med Sci Monit, 2018, 24: 3056-3067. DOI:10.12659/MSM.907280 |
| [7] |
LU T X, ROTHENBERG M E. MicroRNA[J]. J Allergy Clin Immunol, 2018, 141: 1202-1207. DOI:10.1016/j.jaci.2017.08.034 |
| [8] |
CORTEZ M A, ANFOSSI S, RAMAPRIYAN R, MENON H, ATALAR S C, ALIRU M, et al. Role of miRNAs in immune responses and immunotherapy in cancer[J]. Genes Chromosomes Cancer, 2019, 58: 244-253. DOI:10.1002/gcc.22725 |
| [9] |
王睿哲, 徐辰, 李真, 钟华建, 袁文. miRNA影响椎间盘退变的机制研究进展[J]. 中国脊柱脊髓杂志, 2018, 28: 949-953. DOI:10.3969/j.issn.1004-406X.2018.10.12 |
| [10] |
LU J, WANG L, CHEN W, WANG Y, ZHEN S, CHEN H, et al. MiR-603 targeted hexokinase-2 to inhibit the malignancy of ovarian cancer cells[J]. Arch Biochem Biophys, 2019, 661: 1-9. DOI:10.1016/j.abb.2018.10.014 |
| [11] |
BAYRAKTAR R, PICHLER M, KANLIKILICER P, IVAN C, BAYRAKTAR E, KAHRAMAN N, et al. MicroRNA 603 acts as a tumor suppressor and inhibits triple-negative breast cancer tumorigenesis by targeting elongation factor 2 kinase[J]. Oncotarget, 2017, 8: 11641-11658. DOI:10.18632/oncotarget.14264 |
| [12] |
TERTTI M, PAAJANEN H, LAATO M, AHO H, KOMU M, KORMANO M. Disc degeneration in magnetic resonance imaging. A comparative biochemical, histologic, and radiologic study in cadaver spines[J]. Spine (Phila Pa 1976), 1991, 16: 629-634. DOI:10.1097/00007632-199106000-00006 |
| [13] |
PLOEGER C, WALDBURGER N, FRAAS A, GOEPPERT B, PUSCH S, BREUHAHN K, et al. Chromosome 8p tumor suppressor genes SH2D4A and SORBS3 cooperate to inhibit interleukin-6 signaling in hepatocellular carcinoma[J]. Hepatology, 2016, 64: 828-842. DOI:10.1002/hep.28684 |
| [14] |
NAVONE S E, MARFIA G, GIANNONI A, BERETTA M, GUARNACCIA L, GUALTIEROTTI R, et al. Inflammatory mediators and signalling pathways controlling intervertebral disc degeneration[J]. Histol Histopathol, 2017, 32: 523-542. |
 2021, Vol. 42
2021, Vol. 42


