2. 上海海事大学信息工程学院计算机科学系, 上海 201306
2. Department of Computer Science, College of Information Engineering, Shanghai Maritime University, Shanghai 201306, China
不同因素所致的骨骼肌损伤类型和程度有所不同,二维超声可直观地观察骨骼肌纹理结构改变。我们前期的离体研究表明,遭受微波消融损伤后,猪横纹肌超声表现与无水乙酸化学因素所致损伤不同[1]。运用计算机骨骼肌纹理自动提取与定量分析技术——超声回波强度界面多级分解法,可对离体猪横纹肌损伤区域的纹理特征进行定量[2]。本研究通过建立微波消融致急性骨骼肌损伤的活体兔模型,观察不同功率下兔肌肉组织的超声特点,然后运用计算机辅助分析技术寻求合理、可靠的声学定量指标,探讨兔肌肉损伤修复过程中的超声纹理特征变化。
1 材料和方法 1.1 动物模型的制备健康新西兰大白兔44只[购自浙江省农业科学院,生产许可证号:SCXK(浙)2010-0047],6~8周龄,雌雄不拘,分笼饲养(普通级),体质量为(2.3±0.2)kg。依照国家科学技术委员会发布的《实验动物管理条例》[3]处置实验兔。随机取40只兔平均分为两组:30 W组和50 W组,分别进行30 W和50 W微波消融;另外4只兔作为正常对照,不进行微波消融。
全身麻醉后暴露兔右侧股内侧皮肤,在高分辨率超声引导下将微波针插入肌肉深约5 mm,两组分别按30、50 W功率启动微波消融仪(KY-2100型,2 450 MHz,南京康友医疗科技有限公司),天线全长约10 cm,外径16 G,发射端长度0.3 cm,天线杆温设定为30 ℃,对右侧股肌肉微波消融持续3 min。
1.2 研究方法 1.2.1 超声检查流程与操作规范采用高档彩色多普勒超声成像仪(HI VISION Preirus型,日本日立公司),探头型号L74M,频率5~13 MHz。系统参数:灰阶增益36 dB,时间增益零补偿,彩色增益39 dB,彩色血流M级,高精细动态组织谐波成像模式,聚焦深度1.0~1.5 cm,热指数(thermal index,TI) < 0.4,机械指数(mechanical index,MI)为1.2。正常对照、30 W、50 W组均以微波消融前超声检查同时清晰显示的右侧下肢股动脉干与股肌肉长轴为研究平面,进行二维灰阶超声观察,并存储图像。30 W组与50 W组微波消融(3 min)后1 h、1 d、2 d、7 d、28 d分别存储相应二维超声图像以备脱机分析,正常对照组同时间点采集上述图像。
1.2.2 二维超声图像纹理特征提取与分析由2名具有至少5年工作经验的超声科医师共同采集和存储超声图像。由2名具有至少3年工作经验的超声科医师和图像分析人员共同在兔肌肉二维超声图像上选定感兴趣区(region of interest,ROI),应用Matlab 7.0软件(美国MathWorks公司)分别截取相同大小、形状、深度的ROI,取样大小为60像素×60像素,每组共采集20个ROI(每个时间节点采集4幅图像,且重复取样5次),采用超声回波强度界面多级分解方法,提取图像中包含的8个肌纤维纹理特征[2, 4],即纹理灰度均值(grayscale mean)、纹理灰度标准差(standard deviation)、纹理密致性(number of blobs)、纹理基元形状不规则度(irregularity of blobs)、纹理基元平均大小(average size of blobs)、纹理分布均匀性(homogeneity of distribution)、纹理分布的方向性(directionality of distribution)和纹理分布的周期性(periodicity of distribution)。
1.3 统计学处理应用SPSS 17.0软件进行统计学分析。数据以x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。检验水准(α)为0.05。
2 结果 2.1 兔骨骼肌微波消融前后超声表现在沿肌肉长轴切面,正常肌纹理表现为由低回声肌束与强回声肌束膜相间排列而成的线状或轻度网络状(图 1A)。30 W微波消融后1 h,微波消融区回声呈一过性增高,后方回声衰减,其内肌纹理连续性中断,网络状结构消失,呈磨玻璃样(图 1B)。与30 W组相比,50 W组微波消融区肌纹理更模糊。随着损伤骨骼肌逐渐修复,微波消融后7 d肌纹理逐渐清晰,但与30 W组比较50 W组修复较慢(图 1C、1D)。
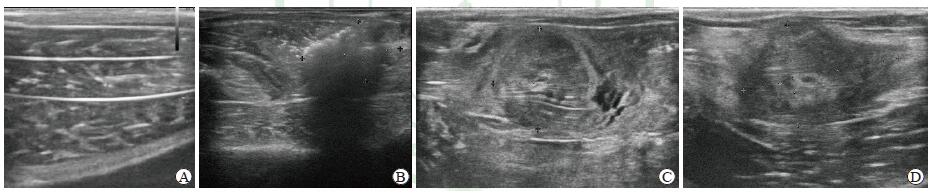
|
图 1 兔正常骨骼肌及不同功率微波消融后损伤骨骼肌的二维超声特征 Fig 1 Two-dimensional ultrasonogram features of normal skeletal muscle and injured skeletal muscle by different power microwave ablation in rabbits A: Before microwave ablation injury, normal muscle texture showed a linear or network-like arrangement induced by hypoechoic muscle bundle and hyperechoic myofascial membrane; B: One hour after 30 W microwave ablation injury, the echo level in ablation region increased transiently with posterior attenuation, the continuity of the inner muscle texture was interrupted, and the network structure disappeared, showing a ground glass-like appearance; C: 7 days after 30 W microwave ablation injury, the muscle texture of ablation region could be detected gradually; D: 7 days after 50 W microwave ablation injury, the muscle texture of ablation region was still obscured, with lower echo level than ablation region of the 30 W group |
2.2 微波消融后兔骨骼肌8个超声纹理特征 2.2.1 纹理灰度均值
与正常对照组比较,在微波消融后1 h、1 d、2 d、7 d,30 W组、50 W组微波消融区兔骨骼肌纹理灰度均值较大,差异均有统计学意义(30 W组:t=13.911、24.564、17.969、2.515,P均 < 0.05;50 W组:t=16.869、24.698、25.517、5.111,P均 < 0.01)。在微波消融后28 d,50 W组兔骨骼肌纹理灰度均值仍大于正常对照组,差异有统计学意义(t=3.090,P=0.009),而30 W组与正常对照组比较差异无统计学意义(P > 0.05)。在微波消融后1 h、2 d、7 d,50 W组兔骨骼肌纹理灰度均值均大于30 W组,差异均有统计学意义(t=2.958、7.548、2.596,P均 < 0.05)。见表 1。
|
|
表 1 不同功率微波消融后各时间点兔骨骼肌纹理特征的变化 Tab 1 Changes of texture features of rabbit skeletal muscle at different time points after microwave ablation with different powers |
2.2.2 纹理灰度标准差
与正常对照组比较,在微波消融后1 h、1 d、2 d,30 W组、50 W组微波消融区兔骨骼肌纹理灰度标准差较大,差异均有统计学意义(30 W组:t=2.874、3.568、3.049,P均 < 0.05;50 W组:t=11.522、30.577、31.149,P均 < 0.01)。在微波消融后7 d、28 d,50 W组兔骨骼肌纹理灰度标准差均大于正常对照组,差异均有统计学意义(t=34.632、21.813,P均 < 0.01)。在微波消融后1 h、1 d、2 d、7 d、28 d,50 W组兔骨骼肌纹理灰度标准差均大于30 W组,差异均有统计学意义(t=8.649、27.009、28.099、32.611、22.374,P均 < 0.01)。见表 1。
2.2.3 纹理密致性与正常对照组比较,在微波消融后1 h、1 d、2 d、7 d,30 W组、50 W组微波消融区兔骨骼肌纹理密致性均较高,差异均有统计学意义(30 W组:t=2.343、2.285、4.173、6.623,P均 < 0.05;50 W组:t=4.626、5.583、5.937、8.331,P均 < 0.01)。在微波消融后28 d,50 W组兔骨骼肌纹理密致性高于正常对照组,差异有统计学意义(t=2.886,P=0.014)。在微波消融后1 h、1 d,50 W组兔骨骼肌纹理密致性均高于30 W组,差异均有统计学意义(t=2.283、3.298,P均 < 0.05)。见表 1。
2.2.4 纹理基元形状不规则度与正常对照组比较,在微波消融后1 h、1 d、2 d,30 W组、50 W组微波消融区兔骨骼肌纹理基元形状不规则度均较高,差异均有统计学意义(30 W组:t=2.596、3.400、2.971,P均 < 0.05;50 W组:t=4.374、5.178、5.174,P均 < 0.01)。在微波消融后2 d,50 W组兔骨骼肌纹理基元形状不规则度高于30 W组,差异有统计学意义(t=2.203,P=0.048)。见表 1。
2.2.5 纹理基元平均大小与正常对照组比较,在微波消融后1 h、1 d、2 d、7 d,30 W组、50 W组微波消融区兔骨骼肌纹理基元平均大小均较大,差异均有统计学意义(30 W组:t=2.212、4.005、4.155、2.596,P均 < 0.05;50 W组:t=5.007、6.294、6.584、5.414,P均 < 0.01)。在微波消融后28 d,50 W组兔骨骼肌纹理基元平均大小亦大于正常对照组,差异有统计学意义(t=5.607,P < 0.01)。在微波消融后1 d、2 d、7 d、28 d,50 W组兔骨骼肌纹理基元平均大小均大于30 W组,差异均有统计学意义(t=2.289、2.429、2.509、3.481,P均 < 0.05)。见表 1。
2.2.6 纹理分布均匀性与正常对照组比较,在微波消融后1 h、1 d、2 d、7 d,30 W组、50 W组微波消融区兔骨骼肌纹理分布均匀性均较高,差异均有统计学意义(30 W组:t=4.285、5.255、4.846、2.777,P均 < 0.05;50 W组:t=3.779、7.940、6.713、3.108,P均 < 0.01)。在微波消融后28 d,30 W组、50 W组兔骨骼肌纹理分布均匀性与正常对照组比较差异均无统计学意义(P均 > 0.05)。在微波消融后1 d,50 W组兔骨骼肌纹理分布均匀性高于30 W组,差异有统计学意义(t=2.685,P=0.020)。见表 1。
2.2.7 纹理分布的方向性与正常对照组比较,在微波消融后1 h、1 d、2 d,30 W组、50 W组微波消融区兔骨骼肌纹理分布的方向性均较高,差异均有统计学意义(30 W组:t=3.812、3.130、3.361,P均 < 0.01;50 W组:t=4.697、3.881、4.129,P均 < 0.01)。在微波消融后7、28 d,30 W组、50 W组兔骨骼肌纹理分布均匀性与正常对照组比较差异均无统计学意义(P均 > 0.05)。在微波消融后各时间点,50 W组兔骨骼肌纹理分布均匀性与30 W组比较差异均无统计学意义(P均 > 0.05)。见表 1。
2.2.8 纹理分布的周期性与正常对照组比较,在微波消融后1 h、1 d、2 d、7 d、28 d,30 W组、50 W组微波消融区兔骨骼肌纹理分布的周期性均较高,差异均有统计学意义(30 W组:t=6.708、7.422、8.034、8.746、5.383,P均 < 0.01;50 W组:t=11.851、9.133、11.615、10.285、7.488,P均 < 0.01)。在微波消融后1 h、2 d,50 W组兔骨骼肌纹理分布的周期性均高于30 W组,差异均有统计学意义(t=5.143、3.581,P均 < 0.01)。见表 1。
3 讨论 3.1 计算机辅助超声纹理定量分析对骨骼肌损伤修复的评估价值随着人工智能的飞速发展,越来越多的计算机辅助诊断技术等被应用于疾病的诊断与治疗[5-6],其与超声的交叉融合为研究实质性器官、组织的纹理提供了一种新的组织定征工具[7-11]。Eisele等[12]运用计算机辅助超声技术定量阐明了二维灰阶图像上脊柱旁腰肌的纹理特征与患者腰痛症状或功能障碍的关系;周翔等[13]对数十例肌萎缩患者的大腿肌群进行高频超声扫查,发现超声图像上萎缩肌肉的粗糙程度、复杂性、均匀性等纹理特征参量与正常肌肉明显不同。Pillen等[14-16]运用计算机辅助灰阶超声定量分析技术获得了小腿和足部肌肉的正常厚度和回声强度数据,这些数据对神经肌肉障碍的诊断灵敏度高达87%,表明定量肌肉超声特征对于临床评估肌肉疾病具有较高的实用价值。
在前期研究中,我们动态观察了超声图像上微波消融致兔肌肉损伤的组织形态、血流分布、弹性质地等,发现超声可达到与病理组织微观结构、血清标志物随时间变化一致的骨骼肌损伤修复过程的监测效果;微波消融功率越小损伤程度越轻,一般在微波消融后1~2 d时伤情最重,7~28 d逐渐修复,30 W组损伤肌肉的修复明显早于50 W组[17-18]。然而,超声图像上微波消融后兔肌肉损伤的动态变化易受超声科医师主观经验的影响产生偏差,不能客观定量分析[1, 17, 19]。因此,本研究利用计算机辅助超声定量分析技术,从肌纤维结构分布的不同层次对各组肌肉超声图像ROI提取的纹理几何参量进行定量分析,以更客观地描述兔骨骼肌损伤修复不同时期的超声纹理特征。结果表明,在微波消融后1 h、1 d、2 d,30 W组、50 W组微波消融区兔骨骼肌的纹理灰度均值、纹理灰度标准差、纹理密致性、纹理基元形状不规则度、纹理基元平均大小、纹理分布均匀性、纹理分布的方向性和纹理分布的周期性8个纹理特征与正常对照组比较差异均有统计学意义(P均 < 0.05);50 W组与30 W组比较,在微波消融后急性损伤期,纹理灰度均值(1 h、2 d)、纹理灰度标准差(1 h、1 d、2 d)、纹理密致性(1 h、1 d)、纹理基元形状不规则度(2 d)、纹理基元平均大小(1 d、2 d)、纹理分布均匀性(1 d)、纹理分布的周期性(1 h、2 d)差异均有统计学意义(P均 < 0.05);在微波消融后修复期,纹理灰度标准差(7 d、28 d)、纹理基元平均大小(7 d、28 d)和纹理灰度均值(7 d)差异仍均有统计学意义(P均 < 0.05)。结果说明计算机辅助超声定量分析可定量描述不同功率微波消融致兔骨骼肌急性损伤及修复期的动态变化。
3.2 计算机辅助超声定量分析微波消融致兔骨骼肌急性损伤修复的局限性及改进方向考虑各类创伤致骨骼肌损伤时下肢受累可达74%,且兔骨骼肌与离体猪横纹肌、人骨骼肌超声表现相似,参考相关文献[20]发现,虽然骨骼肌损伤类型中钝挫伤在临床更常见[21],但为了保持动物模型较高的可重复性、易操作性及超声观察平面的一致性,本实验选择了微波消融致兔骨骼肌急性损伤模型观察损伤肌束的超声演变特点,并利用计算机辅助超声定量其纹理特点。由于微波消融损伤和钝挫伤在病理组织学上均有相应的肌细胞坏死、浊肿、间质纤维化等改变,相应的超声图像亦有变化。
任何类型的损伤都会导致人体不同程度的肌肉损害,甚至致残或危及生命。基于超声回波强度界面多级分解法的超声纹理定量分析技术,改良了以往图像多尺度斑块纹理特征法[4, 22],能够更好地揭示肌肉损伤期和恢复期不同的纹理特征差异,可提供更全面、细致的骨骼肌信息,为临床开展骨骼肌损伤的超声定量诊断提供计算机软件支持和技术保障。
尽管计算机辅助超声纹理定量分析技术可避免超声科医师的主观判断偏差,但其操作要求较高,短期内难以在临床普及,依赖超声科医师的超声定性描述仍是常规方法。本研究旨在探讨一种可规避常规方法诊断局限的计算机辅助超声定量分析方法,提示未来应加强对专业超声人才的培养(如针对性培养肌肉超声诊断从业人员),确保超声科医师无论工作经验如何都能做出准确诊断。还应继续研发不依赖于人员操作的超声图像人工智能定量分析工具[23],以提高超声定量、客观诊断的准确度。
| [1] |
赵佳琦, 章建全, 盛建国, 赵璐璐, 潘倩.不同技术级别超声医师对离体猪横纹肌理化损伤模型超声定性诊断的局限性分析[J/CD].中华医学超声杂志(电子版), 2014, 11: 763-769.
|
| [2] |
赵佳琦, 章建全, 徐琪, 陈雁秋, 盛建国, 卢峰, 等.超声图像纹理分析技术对离体猪横纹肌理化损伤模型的定量研究[J/CD].中华医学超声杂志(电子版), 2013, 10: 674-680.
|
| [3] |
中华人民共和国国家科学技术委员会. 实验动物管理条例[J]. 畜牧兽医科技信息, 2003(9): 29-30. |
| [4] |
ZHAO J, ZHANG J, XU Q, SHENG J, DIAO Z, LIU S. Quantitative evaluation of striated muscle injury by multiscale blob features method[J]. J Med Ultrason, 2016, 43: 337-345. DOI:10.1007/s10396-016-0708-y |
| [5] |
KAICK O V, HAMARNEH G, WARD A D, SCHWEITZER M, ZHANG H. Learning Fourier descriptors for computer-aided diagnosis of the supraspinatus[J]. Acad Radiol, 2010, 17: 1040-1049. DOI:10.1016/j.acra.2010.04.006 |
| [6] |
CHEN D R, HSIAO Y H. Computer-aided diagnosis in breast ultrasound[J]. J Med Ultrasound, 2008, 16: 46-56. DOI:10.1016/S0929-6441(08)60005-3 |
| [7] |
GAO S, PENG Y, GUO H, LIU W, GAO T, XU Y, et al. Texture analysis and classification of ultrasound liver images[J]. Biomed Mater Eng, 2014, 24: 1209-1216. |
| [8] |
MORARU L, MOLDOVANU S, BISWAS A. Optimization of breast lesion segmentation in texture feature space approach[J]. Med Eng Phys, 2014, 36: 129-135. DOI:10.1016/j.medengphy.2013.05.013 |
| [9] |
NARCHI H, MAHMOUD-GHONEIM D, SKINNER A, COGINGS P. Texture analysis of periventricular echogenicity on neonatal cranial ultrasound predicts periventricular leukomalacia[J]. J Neonatal Perinatal Med, 2013, 6: 117-124. DOI:10.3233/NPM-1365012 |
| [10] |
CHEN D R, HUANG Y L, LIN S H. Computer-aided diagnosis with textural features for breast lesions in sonograms[J]. Comput Med Imaging Graph, 2011, 35: 220-226. DOI:10.1016/j.compmedimag.2010.11.003 |
| [11] |
IAKOVIDIS D K, KERAMIDAS E G, MAROULIS D. Fusion of fuzzy statistical distributions for classification of thyroid ultrasound patterns[J]. Artif Intell Med, 2010, 50: 33-41. DOI:10.1016/j.artmed.2010.04.004 |
| [12] |
EISELE R, SCHMID R, KINZL L, KRAMER M, KATZMAIER P, HARTWIG E. Soft tissue texture analysis by B-mode-ultrasound in the evaluation of impairment in chronic low back pain[J]. Eur J Ultrasound, 1998, 8: 167-175. DOI:10.1016/S0929-8266(98)00073-1 |
| [13] |
周翔, 张青萍, 乐桂蓉. 肌肉高频超声成像及其纹理分析[J]. 中国超声医学杂志, 2001(1): 70-72. |
| [14] |
PILLEN S, VAN DIJK J P, WEIJERS G, RAIJMANN W, DE KORTE C L, ZWARTS M J. Quantitative gray-scale analysis in skeletal muscle ultrasound: a comparison study of two ultrasound devices[J]. Muscle Nerve, 2009, 39: 781-786. DOI:10.1002/mus.21285 |
| [15] |
VERHULST F V, LEEUWESTEIJN A E, LOUWERENS J W, GEURTS A C, VAN ALFEN N, PILLEN S. Quantitative ultrasound of lower leg and foot muscles: feasibility and reference values[J]. Foot Ankle Surg, 2011, 17: 145-149. DOI:10.1016/j.fas.2010.04.002 |
| [16] |
ARTS I M, PILLEN S, SCHELHAAS H J, OVEREEM S, ZWARTS M J. Normal values for quantitative muscle ultrasonography in adults[J]. Muscle Nerve, 2010, 41: 32-41. DOI:10.1002/mus.21458 |
| [17] |
赵佳琦, 章建全, 赵璐璐, 宋家琳, 潘倩, 盛建国, 等. 不同消融功率致兔骨骼肌急性微波热损伤修复的超声影像演变特征[J]. 中华医学超声杂志(电子版), 2016, 13: 780-789. |
| [18] |
赵佳琦, 章建全, 赵璐璐, 宋家琳, 潘倩, 盛建国, 等. 实时超声弹性成像技术评价不同功率微波消融致兔骨骼肌急性损伤后修复的动态变化[J]. 第二军医大学学报, 2019, 40: 970-976. ZHAO J Q, ZHANG J Q, ZHAO L L, SONG J L, PAN Q, SHENG J G, et al. Real-time ultrasound elastography in evaluating dynamic changes of rabbit skeletal muscle injury induced by microwave ablation of different powers[J]. Acad J Sec Mil Med Univ, 2019, 40: 970-976. |
| [19] |
张燕, 王文丽, 敖丽娟. 高频超声对骨骼肌特性的评估[J]. 中国康复医学杂志, 2017, 32: 110-113. |
| [20] |
杨志金, 舒彬, 曾登芬, 邓皓月, 方响琴. 不同强度脉冲超声波促进大鼠骨骼肌挫伤修复的实验研究[J]. 中华物理医学与康复杂志, 2010, 3: 811-815. |
| [21] |
王晓艳.超声观察重物打击致家兔肌肉损伤的实验研究[D].大连: 大连医科大学, 2008.
|
| [22] |
XU Q, WU H S, CHEN Y Q. Statistical multiscale blob features for classifying and retrieving image texture from large-scale databases[J]. J Electron Imaging, 2010, 19: 043006. DOI:10.1117/1.3491420 |
| [23] |
赵佳琦, 刁宗平, 徐琪, 章建全. 人工智能时代超声医学新发展[J]. 第二军医大学学报, 2019, 40: 478-482. ZHAO J Q, DIAO Z P, XU Q, ZHANG J Q. New development of ultrasound medicine in the era of artifcial intelligence[J]. Acad J Sec Mil Med Univ, 2019, 40: 478-482. |
 2020, Vol. 41
2020, Vol. 41


