2. 海军军医大学(第二军医大学)长征医院骨科, 上海 200003
2. Department of Orthopaedics, Changzheng Hospital, Naval Medical University(Second Military Medical University), Shanghai 200003, China
近年,炎性因子在关节非肿瘤性疾病的发生、发展和治疗中日益受到重视。各种原因造成的关节内微小创伤等均可引发关节组织内感觉神经元合成与释放炎性神经肽,刺激周围组织合成释放TNF等多种致炎细胞因子,加重局部炎症反应[1]。有学者发现通过干预IL和TNF等炎症介质治疗关节非肿瘤性疾病可取得较好的治疗效果[2-3]。但目前的研究主要局限于骨关节炎(osteoarthritis,OA)[4],罕见其他关节非肿瘤性疾病的研究,且未见人关节液中炎性因子与相应的组织病理学改变相关性的报道。本研究通过检测组织病理学诊断为OA、假体置换后翻修(revision after prosthesis replacement,RPR)、色素性绒毛结节性滑膜炎(pigmented villonodular synovitis,PVNS)和类风湿关节炎(rheumatoid arthritis,RA)患者膝关节液中炎性因子IL-1β、IL-6、IL-8、TNF-α的表达水平及分析其相应的关节滑膜组织病理学特征,探讨炎性因子与组织病理学的关系,以助于理解和研究这些关节疾病的发病、进展等,为临床诊治和基础研究提供参考。
1 资料和方法 1.1 研究对象选取2017年1月至2018年3月在海军军医大学(第二军医大学)长征医院关节外科因膝关节非肿瘤性疾病行外科手术且同意术前抽取膝关节液的患者31例,所有患者均有完整的病例资料,手术中均获取膝关节滑膜组织标本。本研究通过海军军医大学(第二军医大学)长征医院伦理委员会审批。
1.2 膝关节液采集与保存采用髌骨外上缘穿刺法抽取患侧膝关节关节腔内积液3~10 mL,离心后取上清液2 mL,分装于离心管中,保存在-20 ℃冰箱中待测。
1.3 标本检测采用流式细胞小球微阵列术(cytometric bead array,CBA)进行检测,用CBA试剂盒(美国BD公司)内配套的仪器调整微球调整流式细胞仪,按照操作说明书制备调整微球样品和Calibrite三色微球。上机获取数据:调出仪器设置的条件,首先测定标准品管,再测定样品管。测试条件:激光器电源15 mV,电流6.20 A,样本电压5.90 V。按照说明书操作。
1.4 膝关节滑膜组织病理学H-E染色及免疫组织化学染色观察取患侧膝关节滑膜组织用10%甲醛溶液固定,常规乙醇脱水,二甲苯透明,石蜡包埋,5 μm厚切片行H-E染色,4 μm厚切片行免疫组织化学SP法染色。免疫组织化学染色所用抗体及试剂盒购自福建迈新生物技术开发有限公司(CD4编号:RMA-0620;CD68编号:KIT-0026;CD138编号:MAB-0200;CD163编号:MBA-0206;CD8编号:ZA-0508;CD45编号:ZM-0183)。
1.5 统计学处理采用美国BD公司CBA软件进行数据分析,并应用SPSS 11.0软件进行统计学分析,数据以x±s表示。组间比较采用独立样本t检验或单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 患者临床资料31例患者中男9例、女22例,年龄为50~82岁,平均年龄为(63.60±9.19)岁,左膝12例、右膝19例,术前均有不同程度的疼痛和活动受限。其中OA 18例,RPR 5例,PVNS 5例,RA 3例。
2.2 膝关节滑膜组织大体标本观察OA患者膝关节滑膜组织呈灰白色,部分患者滑膜组织有乳头状增生(图 1A);RPR患者滑膜组织呈淡黄色(图 1B);PVNS患者滑膜组织有乳头结节状增生,呈铁锈色(图 1C);RA患者滑膜组织有明显的绒毛结节状增生,多数呈灰白色。

|
图 1 患者膝关节滑膜组织大体标本观察 A:OA患者滑膜组织乳头状增生,呈灰白色;B:RPR患者滑膜组织呈淡黄色;C:PVNS患者滑膜组织乳头结节状增生,呈铁锈色.OA:骨关节炎;RPR:假体置换后翻修;PVNS:色素性绒毛结节性滑膜炎 |
2.3 膝关节滑膜组织病理学H-E染色及免疫组织化学染色结果
OA患者膝关节滑膜组织H-E染色结果显示软骨变性、软骨厚薄不等、软骨下骨组织增生,可形成骨赘样结构,深部骨小梁间纤维组织增生、囊性变等;2例患者滑膜组织有增生,呈乳头状,其余患者滑膜组织病变不明显,亦未见明显的慢性炎细胞浸润(图 2A)。
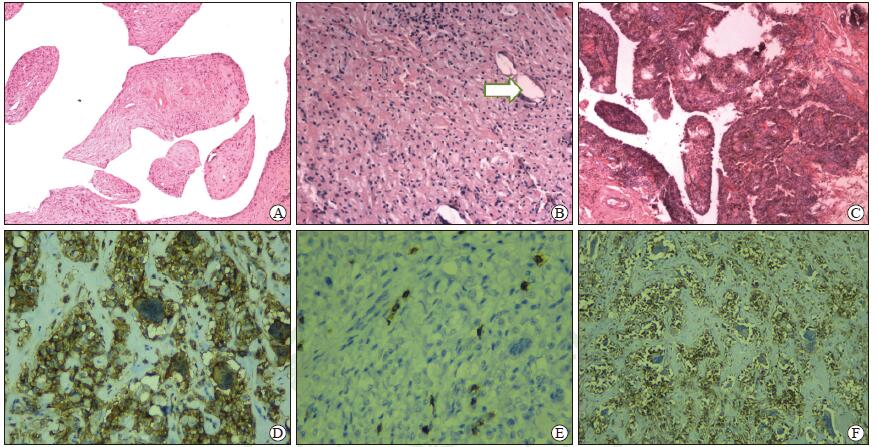
|
图 2 患者膝关节滑膜组织H-E染色(A~C)和免疫组织化学染色(D~F)结果 A:OA患者滑膜组织增生呈乳头状,间质炎细胞浸润不明显;B:RPR患者滑膜组织中见大量组织细胞,见多核异物巨细胞吞噬异物(箭头);C:PVNS患者滑膜组织绒毛结节状增生,间质大量含铁血黄素沉着;D:PVNS患者滑膜组织中CD4多核巨细胞和单核细胞、炎细胞弥漫阳性;E:PVNS患者滑膜组织中CD8少数炎细胞阳性;F:PVNS患者滑膜组织中CD163弥漫阳性,多核巨细胞阴性.OA:骨关节炎;RPR:假体置换后翻修;PVNS:色素性绒毛结节性滑膜炎. Original magnification:×40(A,C),×100(B),×400(D),×200(E,F) |
RPR患者膝关节滑膜组织H-E染色结果显示假体磨屑肉芽肿、慢性非特异性炎性改变,即假体颗粒被巨噬细胞和(或)滑膜细胞吞噬,形成组织细胞、泡沫细胞、多核异物巨细胞等,呈片状弥漫分布,其内可见假体颗粒(图 2B)。免疫组织化学染色显示CD68阳性。
RA患者膝关节滑膜组织H-E染色结果显示滑膜组织肥大绒毛状增生,血管增生、大量慢性炎细胞浸润,局部形成淋巴小结样结构,可见含铁血黄素。免疫组织化学染色显示炎细胞主要为CD45阳性的淋巴细胞和CD138阳性的浆细胞。
PVNS患者膝关节滑膜组织H-E染色结果显示滑膜组织绒毛状增生、增粗并相互融合形成肉芽肿性结节,可见数量不等的炎细胞和多核巨细胞,均伴有含铁血黄素沉着(图 2C)。免疫组织化学染色显示炎细胞主要为CD4弥漫阳性的多核巨细胞和组织细胞样细胞(图 2D);CD8仅零星少数细胞阳性(图 2E),CD163组织细胞样细胞等慢性炎细胞弥漫阳性,多核巨细胞阴性(图 2F)。
2.4 膝关节液中炎性因子检测结果及与相应组织病理学的关系 2.4.1 按病理诊断分析OA组患者膝关节液中4种炎性因子(IL-1β、IL-6、IL-8、TNF-α)的水平均最低,与其他3种病变比较差异均有统计学意义(P均<0.05)。RA组患者膝关节液中IL-1β水平高于RPR组和PVNS组,差异均有统计学意义(P均<0.05),但后两组间差异无统计学意义(P>0.05)。RA组患者膝关节液中IL-6水平高于PVNS组,但低于RPR组,3组间差异均有统计学意义(P均<0.05)。RA组患者膝关节液中IL-8水平高于RPR组和PVNS组,3组间差异均有统计学意义(P均<0.05)。RA组患者膝关节液中TNF-α水平高于RPR组和PVNS组,3组间差异均有统计学意义(P均<0.05)。见表 1。
|
|
表 1 31例患者膝关节液中4种炎性因子含量 |
2.4.2 按滑膜组织内炎细胞数量分析
膝关节滑膜组织炎细胞浸润组(11例)膝关节液中IL-1β[(1 319.5±53.4)pg/mL vs(74.6±12.2)pg/mL]、IL-6[(107.2±17.2)pg/mL vs(19.4±3.1)pg/mL]、IL-8[(28.2±3.1)pg/mL vs(7.5±2.1)pg/mL]、TNF-α[(9.2±2.8)pg/mL vs(3.5±1.1)pg/mL]水平均高于非膝关节滑膜组织炎细胞浸润组(20例),差异均有统计学意义(P均<0.05)。
2.4.3 按滑膜组织内含铁血黄素沉着与否分析膝关节滑膜组织含铁血黄素沉着组(7例)膝关节液中IL-1β[(1 075.8±109.7)pg/mL vs(354.5±32.6)pg/mL]、IL-6[(76.4±21.3)pg/mL vs(46.2±9.2)pg/mL]、IL-8[(21.1±7.1)pg/mL vs(15.5±3.2)pg/mL]、TNF-α[(7.1±2.1)pg/mL vs(3.8±0.7)pg/mL]水平均高于膝关节滑膜组织非含铁血黄素沉着组(24例),差异均有统计学意义(P均<0.05)。
2.4.4 按膝关节液肉眼观分析血性膝关节液组(4例)膝关节液中IL-1β[(557.6±97.1)pg/mL vs(508.7±87.3)pg/mL]水平高于非血性膝关节液组(27例),差异有统计学意义(P<0.05);两组间IL-6[(56.3±8.2)pg/mL vs(52.8±7.4)pg/mL]、IL-8[(21.1±2.1)pg/mL vs(16.3±2.2)pg/mL]、TNF-α[(4.5±0.7)pg/mL vs(4.3±0.6)pg/mL]水平差异均无统计学意义(P均>0.05)。
3 讨论随着中国社会的老龄化,各种原因引起的关节炎和关节疾患越来越多,最常见的临床症状是病患关节疼痛和功能障碍等,当前治疗的主要目标是缓解疼痛和改善关节功能。流行病学调查显示关节软骨破坏和滑膜炎症等与关节疾病有着非常明确的关系,而炎性因子在关节组织新陈代谢和疾病的发生、发展中起着重要的作用,其中IL-1β、IL-8、IL-6和TNF被认为是最主要的炎性因子[5]。
OA是关节疾病中最常见的类型。研究发现IL-1β和TNF作为主要的炎性因子,可诱导产生IL-6和IL-8等,在OA进程中发挥放大和持久效应,这使得抗炎性因子成为治疗OA的主要手段之一[6]。当前以阿那白滞素为代表的IL-1受体拮抗剂[7]和以依那西普、英夫利西单抗、阿达木单抗为代表的抑制TNF活性的生物制剂的诞生与临床应用,使得OA炎患者有了更多治疗方法,并获得更好的治疗效果[8-9],甚至在同时患有RA和OA的患者中也获得了很好的疗效[9]。
膝关节液中炎性因子的水平往往能反映相应疾病及其变化。膝关节中的炎性因子谱取决于组织病理学[10],如检测关节液中磷脂酰肌醇蛋白聚糖-3能反映膝关节的炎症程度[11],冰球运动员和高山滑雪运动员运动损伤后检测其膝关节液相应的生物化学标志能反映其软骨损失情况等[12]。
基于此,本课题组研究了31例不同类型的膝关节炎患者的膝关节液中炎性因子IL-1β、IL-6、IL-8、TNF-α的表达水平,以期发现其与组织病理学变化的相关性,为这些疾病的临床诊治和基础研究提供参考。
常见的关节疾患包括感染性关节炎(化脓性关节炎、结核性关节炎)、RA、OA、创伤性关节炎、痛风性关节炎等,化脓性关节炎、结核性关节炎等已有针对性的治疗方法,目前国内主要的研究对象是OA。本课题在此基础上主要研究了OA、RA,还将PVNS纳入研究。因为PVNS是膝关节常见的疾病之一,目前手术切除似乎是唯一有效的治疗方法,但容易复发,破坏关节完整性和功能,近年研究发现其可能与创伤有关[13],因此本研究将其纳入,以期寻找其发生、发展机制及新的治疗方法。本课题组还研究了5例RPR,因部分患者人工膝关节置换后容易出现关节疼痛和功能受限等,且人工膝关节置换后由于创伤和异物等原因易继发炎症,目前亦无明确有效的治疗方法,本研究也希望寻找其发生、发展机制及新的治疗方法。
组织病理学结果显示OA患者膝关节滑膜组织有软骨变性,软骨下骨组织增生,深部骨小梁间纤维组织增生、囊性变等,滑膜组织病变不明显,亦未见明显的慢性炎细胞浸润。RA患者膝关节滑膜组织增生显著,其内大量慢性炎细胞浸润,部分患者有少量含铁血黄素沉着。PVNS患者膝关节滑膜组织增生显著,呈绒毛状或结节状,伴有多少不等的慢性炎细胞浸润,并可见数量不等的泡沫样组织细胞和多核巨细胞,伴有含铁血黄素沉着。RPR患者组织病理学显示大量泡沫样组织反应,可伴有数量不等的慢性炎细胞浸润,可见假体颗粒(假体的延迟性过敏反应)[13]。
本课题组在组织病理学基础上,研究了31例4种膝关节疾患患者的关节液中IL-1β、IL-6、IL-8及TNF-α含量,并做了对比分析。我们发现所有患者膝关节液中均检测到不等量的IL-1β、IL-6、IL-8及TNF-α,其中OA膝关节液中检测到的炎性因子含量较低。按照病理诊断分析,IL-1β在RA中含量最高,在OA中含量最低,RA、RPR、PVNS与OA比较差异均有统计学意义(P均<0.05),但PVNS和RPR间差异无统计学意义(P>0.05);IL-6在RPR中含量最高,其次是RA、PVNS和OA,两两比较差异均有统计学意义(P均<0.05);IL-8在RA中含量最高,其次是PVNS、RPR和OA,两两比较差异均有统计学意义(P均<0.05);TNF-α在RA中含量最高,其次是RPR、PVNS和OA,两两比较差异均有统计学意义(P均<0.05)。结果表明OA、PVNS、RA和RPR膝关节液中均存在相应的炎性因子,且PVNS、RA和RPR中炎性因子含量明显高于OA,提示针对OA炎性因子的治疗方案对PVNS、RA和RPR可能也会有效,但后续需要更多的研究加以确证。
膝关节滑膜组织内炎细胞浸润组膝关节液中4种炎性因子水平均高于非炎细胞浸润组,差异均有统计学意义(P均<0.05)。结果表明炎性因子的含量与炎细胞浸润程度有相关性,可通过关节液中炎性因子的变化了解疾病的治疗效果和疾病进展。
有研究显示创伤可导致滑膜炎[14]。本研究发现膝关节滑膜组织内有含铁血黄素沉着组4种炎性因子水平均高于非含铁血黄素沉着组,差异均有统计学意义(P均<0.05)。结果提示长期慢性创伤等可能会导致疾病发生、发展。肉眼血性与非血性膝关节液相比,IL-1β水平差异有统计学意义(P<0.05),IL-6、IL-8及TNF-α水平差异均无统计学意义(P均>0.05)。提示急性创伤不一定导致这些炎性因子升高,急性创伤和慢性创伤的致病机制可能不同。
总之,本研究发现OA、RPR、PVNS和RA患者膝关节液中IL-1β、IL-6、IL-8及TNF-α均有表达,且其表达水平与关节疾病组织病理学等有相关性。鉴于目前OA患者抗炎性因子治疗有效,后续我们将针对其余3种疾病进一步研究其关节液中炎性因子改变,并通过细胞和动物模型开展抗炎性因子治疗研究,以期为这些关节疾病的发病机制、临床诊断和治疗研究提供参考。
| [1] |
MILAM S B, SCHMIM J P. Molecular biology of temporomandbular joint disorder[J]. J Oral Maxillofac Surg, 1995, 53: 1448-1454. DOI:10.1016/0278-2391(95)90675-4 |
| [2] |
侯亚平. 膝骨关节炎患者滑液中炎症因子的表达及其与中医证型的相关性分析[J]. 湖南中医药大学学报, 2014, 4: 29-31. |
| [3] |
张洪亮, 王文波, 李明宇, 李进取, 史雪峰. 致炎细胞因子在骨性关节炎病理生理中的作用[J]. 现代生物医学进展, 2014, 5: 989-992. |
| [4] |
侯春福, 韦嵩, 王舒婷. 经筋微创疗法对兔骨性关节炎模型细胞因子及滑膜的病理研究[J]. 华南国防医学杂志, 2016, 7: 426-429. |
| [5] |
VAN DEN BERG W B. Osteoarthritis year 2010 in review:pathomechanisms[J]. Osteoarthritis Cartilage, 2011, 19: 338-341. DOI:10.1016/j.joca.2011.01.022 |
| [6] |
KAPOOR M, MARTEL-PELLETIER J, LAJEUNESSE D, PELLETIER J P, FAHMI H. Role of proinflammatory cytokines in the pathophysiology of osteoarthritis[J]. Nat Rev Rheumatol, 2011, 7: 33-42. DOI:10.1038/nrrheum.2010.196 |
| [7] |
IQBAL I, FLEISCHRNANN R. Treatment of osteoarthritis with anakinra[J]. Curr Rheumatol Rep, 2007, 9: 31-35. DOI:10.1007/s11926-007-0019-9 |
| [8] |
MALEMUD C J. Anticytokine therapy for osteoarthritis:evidence to date[J]. Drugs Aging, 2010, 27: 95-115. DOI:10.2165/11319950-000000000-00000 |
| [9] |
LOEF M, KROON F P B, BERGSTRA S A, VAN DER POL J A, LEMS W F, KERSTENS P J S M, et al. TNF inhibitor treatment is associated with a lower risk of hand osteoarthritis progression in rheumatoid arthritis patients after 10 years[J]. Rheumatology (Oxford), 2018, 57: 1917-1924. DOI:10.1093/rheumatology/key016 |
| [10] |
TSUCHIDA A I, BEEKHUIZEN M, 'T HART M C, RADSTAKE T R D J, DHERT W J A, SARIS D B F, et al. Cytokine profiles in the joint depend on pathology, but are different between synovial fluid, cartilage tissue and cultured chondrocytes[J/OL]. Arthritis Res Ther, 2014, 16: 441. doi: 10.1186/s13075-014-0441-0.
|
| [11] |
UDOMSINPRASERT W, MCCONACHIE E, NGARMUKOS S, THEERAWATTANAPONG N, TANAVALEE A, HONSAWEK S. Plasma and joint fluid glypican-3 are inversely correlated with the severity of knee osteoarthritis[J/OL]. Cartilage, 2019. doi: 10.1177/1947603519841679.
|
| [12] |
BÜTTNER E, GRÖGER A, BURGHART R. [Experimental pathobiochemistry research of the knee joint fluid of ice hockey players and alpine skiers after sport injuries][J]. Sportverletz Sportschaden, 2001, 15: 78-81. DOI:10.1055/s-2001-19046 |
| [13] |
MA X, SHI G, XIA C, LIU H, HE J, JIN W. Pigmented villonodular synovitis:a retrospective study of seventy five cases (eighty one joints)[J]. Int Orthop, 2013, 37: 1165-1170. DOI:10.1007/s00264-013-1858-9 |
| [14] |
MUTO T, KAWAKAMI J, KANAZAWA M, KAKU T, YAJIMA T. Development and histologic characteristics of synvitis induced by trauma in the rat temporomandibular joint[J]. Int J Oral Maxillofac Surg, 1998, 27: 470-475. DOI:10.1016/S0901-5027(98)80041-6 |
 2020, Vol. 41
2020, Vol. 41


