2. 海军军医大学(第二军医大学)基础医学院医学遗传学教研室, 上海 200433
2. Department of Medical Genetics, College of Basic Medical Sciences, Naval Medical University(Second Military Medical University), Shanghai 200433, China
在肝癌研究中,小鼠荷瘤实验常被用来建造体内肝癌模型。免疫荧光技术能够直观反映抗原的性质和定位及分子间的相互作用,在肝癌的研究中发挥着不可或缺的作用。
目前,肝脏组织切片主要有石蜡切片和冰冻切片2种切片形式。石蜡切片的制作过程中需要用有机试剂对组织进行脱水透明处理,而有机试剂会导致蛋白出现不同程度的变性。因此,在进行活体荧光、脂质的表达研究和细胞膜抗原等免疫荧光染色时通常采用冰冻切片,冰冻切片能够更加完好地保存抗原的免疫活性。冰冻切片在制作过程中易形成冰晶而导致自发荧光的产生,科学家们已从不同的角度在防止冰冻切片冰晶形成上进行了优化[1-2],即便如此,肝脏组织依然存在比较强的自发荧光。我们在实验过程中发现,封闭液对肝脏组织冰冻切片的自发荧光有一定影响。丙酮在免疫荧光和免疫组织化学染色中常被用作组织或细胞固定液[3],不仅可以保持蛋白的活性[4],还能够通透组织[5],使抗原抗体充分作用。本研究通过使用4种不同的封闭策略对小鼠肝脏组织的冰冻切片进行处理,以期找到消除小鼠肝脏组织冰冻切片自发荧光的最佳方法,提高免疫荧光结果的准确性。
1 材料和方法 1.1 细胞样品及实验动物Hepa1-6细胞购自中国科学院细胞库,雄性无胸腺BALB/c裸小鼠(5周龄)和C57BL/6小鼠(6~8周龄)由上海斯莱克实验动物有限责任公司提供[动物生产许可证号:SCXK(沪)2017-0005]。
1.2 试剂和耗材细胞培养液:DMEM培养液(美国Invitrogen公司),10% FBS(美国Gibco-BRL公司),1/1 000青霉素-链霉素双抗。组织标本处理液:4%多聚甲醛溶液,30%蔗糖溶液,OCT冰冻切片包埋剂(德国Leica公司)。免疫荧光所需试剂耗材:丙酮,A液(streptavidin reagent,美国Invitrogen公司)、B液(biotin reagent,美国Invitrogen公司),blocking(0.3% Triton X-100,1% FBS,1%牛血清白蛋白,PBS),红细胞去除液(50 mmol/L Tris-HCl,5 mmol/L EDTA),PBS,F4/80抗体(1︰200,美国CST公司),Alexa FluorⓇ 488标记的山羊抗兔IgG(1︰1 000,美国Invitrogen公司),DAPI(1︰2 000,上海碧云天生物技术研究所),抗荧光淬灭封片剂(美国Vector公司),免疫组织化学笔(福州迈新生物技术公司)。仪器:冰冻切片机(德国Leica公司),Echo Revolve正倒置一体荧光显微镜(美国Echo公司)。
1.3 Hepa1-6-GFP细胞构建用过表达GFP的慢病毒(上海吉凯基因化学技术有限公司)感染Hepa1-6细胞,构建GFP稳定标记的Hepa1-6细胞株(Hepa1-6-GFP)。
1.4 组织标本取材及固定对BALB/c裸小鼠进行脾静脉注射、脾切除手术,使Hepa1-6-GFP细胞经由脾静脉-肝门静脉进入肝脏定植,8 h后,取肝脏于4%多聚甲醛溶液中室温固定24 h;C57BL/6小鼠直接取肝脏,置于4%多聚甲醛溶液中室温固定24 h。
1.5 冰冻切片制作将固定过的肝脏组织放入30%蔗糖中进行脱水,直至组织沉到容器底部,吸去组织表面蔗糖,在机箱温度为-20 ℃的冰冻切片机中用OCT进行包埋。待OCT凝固后,用冰冻切片机做10 μm厚度连续切片。
1.6 免疫荧光染色 1.6.1 处理分组共分为5组,每组3个样本。A组:不做任何处理;B组:A液室温30 min+B液室温30 min[6];C组:blocking室温1 h[7];D组:A液室温30 min+B液室温30 min+blocking室温1 h;E组:丙酮室温15 min+A液室温30 min+B液室温30 min+blocking室温1 h。
1.6.2 染色(1)经脾静脉注射肝脏荷瘤裸小鼠:将切片室温干燥2 h,在PBS中浸泡10 min,用红细胞去除液处理10 min去除肝脏组织中的红细胞,PBS冲洗2次,用免疫组织化学笔圈出组织。再分别对5组组织进行不同处理,抗荧光淬灭封片剂封片后在Echo Revolve荧光显微镜下拍照。
(2)C57BL/6小鼠:肝脏切片封闭前处理及封闭方法同经脾静脉注射肝脏荷瘤裸小鼠。待切片封闭结束后加入F4/80抗体4 ℃孵育过夜,第2天在37 ℃恒温箱内复温1 h,PBS冲洗3次,加入Alexa FluorⓇ 488荧光二抗室温孵育1 h,DAPI染色10 min,抗荧光淬灭封片剂封片后在Echo Revolve荧光显微镜下拍照。
1.7 结果判读用20×物镜在相同的拍摄强度和曝光时间下分别对肝脏组织切片进行拍照,每张切片选取3个视野。对采集的图片用Fiji-ImageJ进行背景荧光强度统计。
1.8 统计学处理实验数据使用GraphPad Prism 6.0软件(美国GraphPad公司)进行分析。数据以x±s表示,组间比较采用单因素方差分析,多重比较采用Tukey检验。检验水准(α)为0.05。
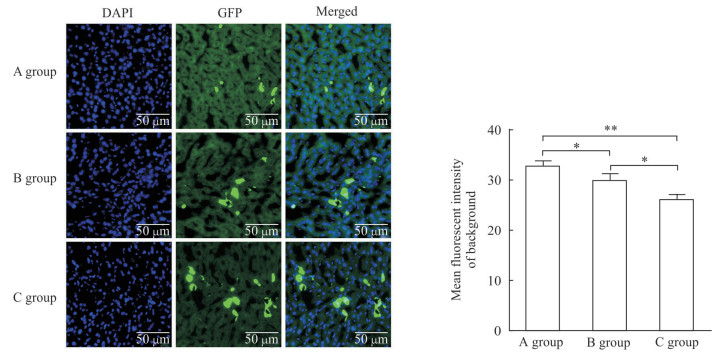
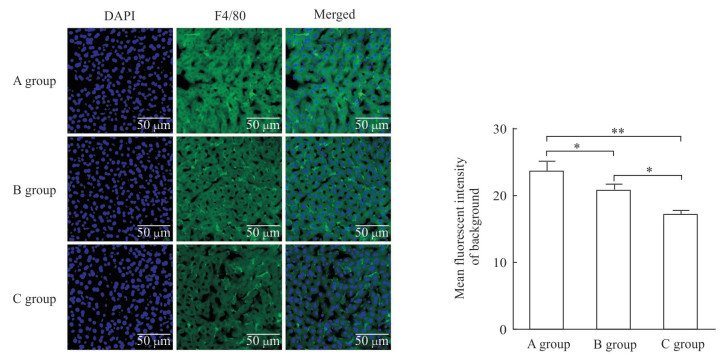
2 结果 2.1 单一封闭液处理对小鼠肝脏组织冰冻切片自发荧光的去除效果将肝脏中已经定植Hepa1-6-GFP细胞的裸小鼠随机分为3组,切片经过不同处理后直接在荧光显微镜下进行拍照,每张切片采集3个视野,对图片进行背景荧光强度统计。结果(图 1)发现与没有进行封闭处理(A组)的肝脏冰冻切片相比,AB液封闭处理(B组)和blocking封闭处理(C组)均能减弱肝脏切片的荧光背景;blocking封闭处理(C组)的肝脏切片荧光背景的去除效果优于AB液封闭处理(B组)。用F4/80抗体标记C57BL/6小鼠肝脏内Kupffer细胞,与经脾静脉注射肝脏荷瘤裸小鼠同样分组处理,对采集的荧光图片进行背景荧光强度统计,结果与经脾静脉注射肝脏荷瘤裸小鼠一致:与没有进行封闭处理(A组)的肝脏冰冻切片相比,AB液封闭处理(B组)和blocking封闭处理(C组)都能减弱肝脏切片的荧光背景,但blocking封闭处理(C组)对肝脏切片荧光背景的去除效果更优(图 2)。
|
图 1 单一封闭液处理的经脾静脉注射肝脏荷瘤裸小鼠肝脏组织冰冻切片背景荧光比较 Fig 1 Comparison of background fluorescence intensities of liver frozen sections in intrasplenic injection-liver colonization nude mice blocked by different single buffer Liver frozen sections were stained with DAPI and GFP. A group: No blocking; B group: AB reagent (A reagent: Streptavidin reagent; B reagent: Biotin reagent); C group: Blocking buffer. DAPI: 4', 6-diamidino-2-phenylindole; GFP: Green fluorescent protein. *P < 0.05, **P < 0.01. n=3, x±s |
|
图 2 单一封闭液处理的C57BL/6小鼠肝脏组织冰冻切片背景荧光比较 Fig 2 Comparison of background fluorescence intensities of liver frozen sections in C57BL/6 mice blocked by single buffer Liver frozen sections were stained with DAPI and F4/80. A group: No blocking; B group: AB reagent (A reagent: Streptavidin reagent; B reagent: Biotin reagent); C group: Blocking buffer. DAPI: 4', 6-diamidino-2-phenylindole. *P < 0.05, **P < 0.01. n=3, x±s |
2.2 封闭液联合应用对小鼠肝脏组织冰冻切片自发荧光的去除效果
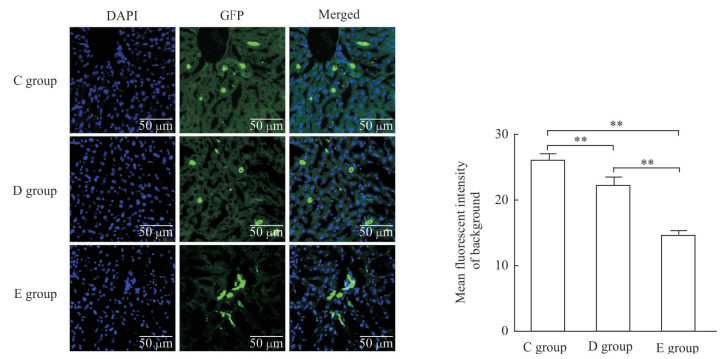
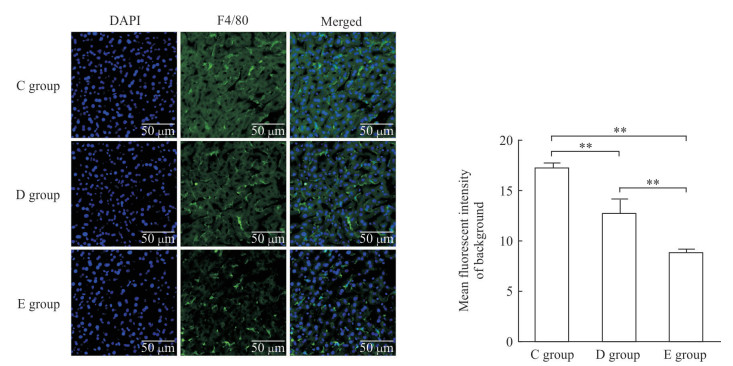
与blocking处理(C组)相比,AB液和blocking联合应用(D组)对经脾静脉注射荷瘤裸小鼠肝脏切片的荧光背景消除效果更好;丙酮+AB液+blocking处理(E组)方法最佳,可以明显消除经脾静脉注射肝脏荷瘤裸小鼠肝脏冰冻切片的自发荧光(图 3)。C57BL/6小鼠结果与经脾静脉注射肝脏荷瘤裸小鼠结果一致:与blocking处理(C组)相比,AB液和blocking联合应用(D组)对肝脏切片的荧光背景消除效果更好,但丙酮+AB液+blocking处理(E组)对肝脏切片的荧光背景消除效果最佳(图 4)。
|
图 3 封闭液联合应用的经脾静脉注射肝脏荷瘤裸小鼠肝脏组织冰冻切片背景荧光比较 Fig 3 Comparison of background fluorescence intensities of liver frozen sections in intrasplenic injection-liver colonization nude mice blocked by combined buffers Liver frozen sections were stained with DAPI and GFP. C group: Blocking buffer; D group: AB reagent (A reagent: Streptavidin reagent; B reagent: Biotin reagent)+blocking buffer; E group: Acetone+AB reagent+blocking buffer. DAPI: 4', 6-diamidino-2-phenylindole; GFP: Green fluorescent protein. **P < 0.01. n=3, x±s |
|
图 4 封闭液联合应用的C57BL/6小鼠肝脏组织冰冻切片背景荧光比较 Fig 4 Comparison of background fluorescence intensities of liver frozen sections in C57BL/6 mice blocked by combined buffers Liver frozen sections were stained with DAPI and F4/80. C group: Blocking buffer; D group: AB reagent (A reagent: Streptavidin reagent; B reagent: Biotin reagent)+blocking buffer; E group: Acetone+AB reagent+blocking buffer. DAPI: 4', 6-diamidino-2-phenylindole. **P < 0.01. n=3, x±s |
3 讨论
与免疫组织化学技术相比,免疫荧光具有灵敏性高和信号放大的优点[7],可用于蛋白质定位、蛋白与蛋白相互作用、多靶标标记等实验。在肝脏的研究中,免疫荧光可以标记肝星状细胞[8]、巨噬细胞[9]、弹性蛋白等标志性结构,在肝癌研究领域应用广泛。肝脏的自发荧光比较强,会对阳性信号造成干扰,目前主要通过使用激光共聚焦的背景扣除(offset)功能降低背景荧光,但是背景扣除也同时会对阳性信号进行荧光扣除,导致表达较弱的信号无法被检测到,影响结果的准确性。
组织切片产生的自发荧光主要有2个部分,即冰冻切片制作过程中产生和组织本身产生的自发荧光。在冰冻切片的制作过程中,可以通过选择合适的固定液[10-11]、避免冰晶的形成[2]等方法减少自发荧光的产生。组织本身产生自发荧光主要因其含有卟啉、胶原蛋白、弹性蛋白、红细胞和脂褐素等天然组分。目前主要通过化学还原剂[12]和光漂白[13]2种方法消除组织本身自发荧光,还原剂在中性pH环境中不稳定,使得实验结果的可重复性低;光漂白方法需要将组织长时间暴露于高强度光照下,导致组织中的成分发生不可逆的光氧化作用,不能用于已经表达荧光的样品,且实验耗时较长、需要特定的仪器设备。
本研究比较了不同的封闭策略去除肝脏冰冻切片自发荧光的效果,结果显示单一封闭液处理时blocking对2种小鼠模型的肝脏自发荧光去除效果优于AB液。将AB液和blocking这2种封闭液联合应用效果更佳,丙酮+AB液+blocking联合应用能够最大程度地去除肝脏冰冻切片的自发荧光,使得免疫荧光背景减弱、信噪比提高,效果最佳。AB液用于消除哺乳动物内源性生物素,blocking用于常规免疫荧光封闭处理。在本研究中,丙酮因其通透性使得AB液和blocking更容易透过,亦或是丙酮本身可以破坏组织内脂褐素等引起自发荧光的组分还有待进一步验证。下一步我们考虑将本方法应用于自发荧光较强的脑组织、肺组织、脾脏及肾脏等,观察其在这些组织中去除自发荧光的效果。
| [1] |
杨秀静, 滕孝静. 冰冻切片技术经验探讨[J]. 临床和实验医学杂志, 2014, 13: 2002-2004. |
| [2] |
包翠芬, 刘霞, 穆长征, 李淑玲. 冰冻切片几种防冰晶方法的比较[J]. 中国误诊学杂志, 2006, 6: 3310-3311. |
| [3] |
宋岩彪, 杜娟, 张创, 曹学会, 靳晓次, 刘雪来. 6种固定液对小鼠皮肤急性炎性反应冷冻组织切片免疫组织化学染色效果的比较[J]. 发育医学电子杂志, 2020, 8: 29-33. |
| [4] |
王秋霞, 王建华, 曹力, 牛勃, 王国亮, 钟儒刚. 儿童原发性肾病综合征尿蛋白质组样品预处理方法的研究[J]. 中国当代儿科杂志, 2011, 13: 157-160. |
| [5] |
JAMUR M C, OLIVER C. Permeabilization of cell membranes[J]. Methods Mol Biol, 2010, 588: 63-66. |
| [6] |
PETTY H R, ELNER V M, KAWAJI T, CLARK A, THOMPSON D, YANG D L. A facile method for immunofluorescence microscopy of highly autofluorescent human retinal sections using nanoparticles with large Stokes shifts[J]. J Neurosci Methods, 2010, 191: 222-226. DOI:10.1016/j.jneumeth.2010.07.001 |
| [7] |
IM K, MARENINOV S, DIAZ M F P, YONG W H. An introduction to performing immunofluorescence staining[J]. Methods Mol Biol, 2019, 1897: 299-311. |
| [8] |
OGAWA T, LI Y, LUA I, HARTNER A, ASAHINA K. Isolation of a unique hepatic stellate cell population expressing integrin α8 from embryonic mouse livers[J]. Dev Dyn, 2018, 247: 867-881. DOI:10.1002/dvdy.24634 |
| [9] |
GÜL N, BABES L, SIEGMUND K, KORTHOUWER R, BÖGELS M, BRASTER R, et al. Macrophages eliminate circulating tumor cells after monoclonal antibody therapy[J]. J Clin Invest, 2014, 124: 812-823. DOI:10.1172/JCI66776 |
| [10] |
陈高峰. 冰冻切片免疫荧光中组织固定方法研究[J]. 实用医技杂志, 2010, 17: 307-308. |
| [11] |
李颖, 矫健, 张罗. 不同固定剂对鼻息肉上皮细胞免疫荧光染色的影响[J]. 首都医科大学学报, 2020, 41: 189-193. |
| [12] |
AHRENS M J, DUDLEY A T. Chemical pretreatment of growth plate cartilage increases immunofluorescence sensitivity[J]. J Histochem Cytochem, 2011, 59: 408-418. DOI:10.1369/0022155411400869 |
| [13] |
SUN Y, IP P, CHAKRABARTTY A. Simple elimination of background fluorescence in formalin-fixed human brain tissue for immunofluorescence microscopy[J/OL]. J Vis Exp, 2017(127): 56188. doi: 10.3791/56188.
|
 2020, Vol. 41
2020, Vol. 41


