2. 上海中医药大学附属曙光医院肾内科, 上海 201203
2. Department of Nephrology, Shuguang Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
血液透析是终末期肾脏疾病的主要治疗方法,随着慢性肾脏病患病率的逐年增高,血液透析患者数也在逐年增加,目前已成为全球性公共卫生问题之一。血液透析是一种体外循环治疗模式,肝素/低分子肝素是其主要抗凝药物。维持性血液透析(maintenance hemodialysis,MHD)患者长期暴露于肝素/低分子肝素,有通过免疫介导产生肝素/血小板因子4(heparin/platelet factor 4,H/PF4)抗体的风险。肝素/低分子肝素与血小板因子4(platelet factor 4,PF4)结合形成肝素-PF4复合物,该复合物刺激人体产生抗H/PF4抗体,其可通过结合至血小板和内皮细胞的细胞膜,引起血小板的活化及聚集,从而导致血小板减少及血栓栓塞事件的发生[1],可能与MHD患者的心血管事件、动静脉内瘘血栓形成和死亡有关[2-3]。由于H/PF4抗体检测尚未系统地应用于接受肝素治疗的人群,因此有关其阳性率和临床预后的研究结果不尽相同。本研究采用前瞻性队列研究方法,通过3年随访,分析海军军医大学(第二军医大学)长征医院肾内科血液透析中心MHD患者H/PF4抗体阳性率及与不良事件的相关性。
1 资料和方法 1.1 研究对象选择2016年11月海军军医大学(第二军医大学)长征医院肾内科MHD患者。纳入标准:(1)MHD≥3个月;(2)以普通肝素/低分子肝素为透析抗凝方式≥3个月;(3)自愿参加本研究并签署知情同意书。排除标准:(1)妊娠及哺乳期妇女;(2)有恶性肿瘤病史者;(3)1个月内有感染、活动性出血病史者;(4)1个月内有手术或外伤史者。根据病例选择标准,共入组54例患者,其中45例行常规血液透析治疗,9例行夜间延长血液透析治疗。本研究通过海军军医大学(第二军医大学)长征医院医学伦理委员会审批。
1.2 透析方法常规血液透析患者每周透析3次,每次4 h,血流量为200~360 mL/min,透析液流量为500 mL/min。夜间延长血液透析患者每周透析3次,每次7 h,血流量为200~260 mL/min,透析液流量为300 mL/min。均采用日本旭化成聚砜膜血液透析器(型号REXEED-15LC,1.5 m2),血管通路为动静脉内瘘或带涤纶套中心静脉导管,抗凝方式始终为普通肝素或低分子肝素。
1.3 观察指标及随访收集MHD患者透析前血液标本。常规血液透析患者采样的前一次透析均采用常规血液透析模式,透析时间为4 h;夜间延长血液透析患者采样的前一次透析均采用夜间延长血液透析模式,透析时间为7 h。采用颗粒免疫过滤法(particle immunofiltration assay,PIFA)检测血清IgG型H/PF4抗体,采用自动生物化学分析仪检测血红蛋白水平、血小板计数。通过每月门诊随访记录患者血管通路栓塞事件、心血管事件、脑血管事件、住院及死亡发生情况,所有患者均完成随访。随访时间自2016年11月至2019年11月。
1.4 统计学处理应用SPSS 20.0软件进行统计学分析。计量资料以
入组的MHD患者共54例,男33例、女21例,年龄34~84岁,平均年龄为(58.8±12.7)岁,透析龄3~342个月,平均透析龄为(133.9±111.5)个月。原发病为慢性肾炎综合征36例,常染色体显性多囊肾病8例,高血压肾病5例,糖尿病肾病3例,肾病综合征1例,原因不明1例。14例患者采用普通肝素(上海上药第一生化药业有限公司)抗凝,40例患者采用低分子肝素(法国赛诺菲公司)抗凝。血管通路为动静脉内瘘39例,带涤纶套中心静脉导管15例。
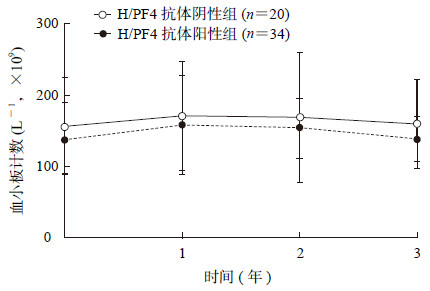
2.2 H/PF4抗体阳性与阴性MHD患者临床基线特征及实验室检验结果比较MHD患者H/PF4抗体阳性率为63.0%(34/54)。如表 1所示,H/PF4抗体阳性和阴性患者在性别、年龄、透析龄、血红蛋白水平、血小板计数方面的差异均无统计学意义(P均>0.05);H/PF4抗体阳性与原发病、抗凝方式(普通肝素/低分子肝素)、抗凝剂剂量及透析方式(常规血液透析/夜间延长血液透析)均无关(P均>0.05)。经过3年随访,H/PF4抗体阳性与阴性患者血小板计数均无明显降低,差异无统计学意义(P>0.05)。见图 1。
|
|
表 1 H/PF4抗体阳性与阴性MHD患者临床基线特征及实验室检验结果比较 |
|
图 1
H/PF4抗体阳性与阴性MHD患者血小板计数随访结果
H/PF4:肝素/血小板因子4;MHD:维持性血液透析. 
|
2.3 H/PF4抗体阳性与阴性MHD患者血管通路不良事件比较
以动静脉内瘘为血管通路的患者在H/PF4抗体阳性患者中的比例高于H/PF4抗体阴性患者(P<0.01)。H/PF4抗体阳性患者血管通路血栓形成率为14.7%(5/34),H/PF4抗体阴性患者为25.0%(5/20),二者比较差异无统计学意义(P>0.05)。其中,H/PF4抗体阳性患者中带涤纶套中心静脉导管栓塞与动静脉内瘘血栓形成发生率分别为25.0%(1/4)和13.3%(4/30),H/PF4抗体阴性患者分别为27.3%(3/11)和22.2%(2/9),二者比较差异无统计学意义(P>0.05)。H/PF4抗体阳性患者和阴性患者在心血管事件、脑血管事件、住院率及死亡率方面的差异均无统计学意义(P均>0.05)。见表 2。
|
|
表 2 H/PF4抗体阳性与阴性MHD患者不良事件比较 |
3 讨论
本研究结果显示,在本中心以普通肝素/低分子肝素为透析抗凝方式进行治疗的MHD患者H/PF4抗体阳性率达63.0%(34/54),高于既往文献报道(1.2%~47%[4-7])。各研究结果之间差异较大的原因之一可能是大多数研究是基于单中心患者资料进行的统计分析且研究规模小。各项研究中的研究对象来自不同国家,说明不同民族和种族间MHD患者的H/PF4抗体阳性率可能不同。此外,各研究中使用的试剂盒和检测方法不同,阈值设置标准也不一致,故H/PF4抗体阳性率也存在差异。
血清素释放测定是一种血小板活化测定,被认为是诊断肝素诱导血小板减少症(heparin-induced thrombocytopenia,HIT)的金标准,但检测的复杂性和对放射性试剂的需求等因素限制了该测定方法仅在国外几个实验室可用,且检测耗时较长[8]。目前,我国检测H/PF4抗体的主要方法是PIFA法和乳胶免疫比浊法(latex immunoturbidimetric assay,LIA)。PIFA法具有实时、检测速度快的优点,灵敏度高达100%,阴性预测值可达100%,但特异度较低,为30%~70%,因此应用PIFA法可能检测到在临床上无意义的弱抗体和容易形成血栓的强抗体[9-10]。LIA法是另一种快速、全自动检测H/PF4抗体的免疫学方法,可同时检测出无致病性的非血小板激活性抗体;特异度偏低,约90%,灵敏度为66.7%~100%,不同的研究结果差异较大[11-12]。
IgA型和IgM型H/PF4抗体的致病性尚不明确,研究表明只有IgG型H/PF4抗体可激活血小板,有可能引起HIT[13],因此本研究仅应用PIFA法检测了IgG型H/PF4抗体。本研究结果提示H/PF4抗体阳性患者和阴性患者在性别、年龄、透析龄、血红蛋白水平、血小板计数方面的差异均无统计学意义(P均>0.05),H/PF4抗体阳性与原发病、抗凝方式(普通肝素/低分子肝素)、抗凝剂剂量无关,这与既往研究结果[5-6, 14]一致。此外本研究还证实H/PF4抗体阳性与透析方式即选择常规血液透析还是夜间延长血液透析无关。
MHD患者罹患心脑血管疾病的风险较高,包括冠状动脉疾病、脑血管疾病、外周动脉疾病和血管通路血栓形成[15-16]。但是,已知的传统心血管危险因素并不能完全解释血液透析患者心血管疾病的高发率,而H/PF4抗体与MHD患者血管栓塞事件之间的关系始终存在争议。一些研究表明H/PF4抗体阳性的血液透析患者发生心血管疾病和动静脉内瘘血栓形成的风险高于H/PF4抗体阴性患者[15, 17]。H/PF4抗体可以诱导活性氧的产生及内皮细胞和血小板微粒的释放,进而促进凝血和炎症反应,引起动脉和内皮功能障碍,导致血液透析患者的血管通路功能障碍[18-20]。踝肱指数(ankle brachial index,ABI)是血液透析患者心血管事件、外周动脉事件和心血管疾病死亡率的有力预测因子,有研究提示H/PF4抗体是ABI的主要决定因素,与H/PF4抗体滴度无关,H/PF4抗体阳性与血小板计数无关[14, 21]。一项为期7年的纵向随访研究得出H/PF4抗体是血液透析患者发生冠状动脉疾病、缺血性脑卒中、外周动脉疾病和血管通路血栓形成的危险因素[3]。但有研究结论与之相反,一项针对740例接受MHD和腹膜透析治疗患者的H/PF4抗体(IgG、IgA或IgM)检测结果提示H/PF4抗体不是心血管事件和死亡率的独立危险因素[22]。另一项针对血液透析患者的研究同样证实反复暴露于肝素的血液透析与H/PF4抗体的升高相关,但与血管通路血栓形成无关[23]。刘新宇等[24]对2个血液净化中心的148例MHD患者进行了研究,结果显示H/PF4抗体阳性与血管通路的栓塞无关。既往研究结果说明血管通路功能障碍与MHD患者预后之间存在显著关联,而MHD患者血管通路功能障碍是一个复杂的、受多因素影响的过程,其中炎症反应是关键[25-26]。本研究通过3年随访,未发现MHD患者H/PF4抗体与血管通路栓塞存在相关性,同时带涤纶套中心静脉导管栓塞与动静脉内瘘血栓形成发生率在H/PF4抗体阳性患者与阴性患者间同样无明显差异(P>0.05)。
本研究通过3年随访,发现H/PF4抗体阳性患者与阴性患者的血小板计数均无明显降低,且随访期间二者血小板计数差异无统计学意义(P>0.05)。此外,H/PF4抗体阳性患者和阴性患者在心血管事件、脑血管事件、住院率及死亡率方面的差异均无统计学意义(P均>0.05)。一项有关心脏术后肝素抗凝的HIT患者研究显示,有H/PF4抗体的患者30 d血栓并发症的发生率高于缺乏该抗体的患者,但大多数发生在抗体滴度高的患者中,且在随访期间,血栓事件的发生率随后下降,更重要的是,在持续存在H/PF4抗体的患者中血栓事件的发生率随时间延长而降低[27],该项研究是在已经诊断为HIT的患者中进行的。Maharaj等[28]对212例MHD患者自使用肝素进行血液透析抗凝开始监测H/PF4抗体[平均随访时间为(2.3±1.4)年],结果显示尽管持续接触肝素,但仅在血液透析的前6个月产生最强的免疫反应,从6个月起免疫反应明显减弱,其间没有患者发生HIT,且抗体和HIT之间没有关联,抗体强滴度患者的血栓形成发生率增加但没有统计学意义,这可能是由于H/PF4抗体免疫反应活跃下调并诱导外周耐受机制造成。以上研究结果提示,尽管在长期使用普通肝素或低分子肝素的MHD患者中H/PF4抗体阳性率较高,但持续存在的抗体对于患者的血小板计数及不良事件包括血栓形成事件、心血管事件等均无明显影响。由于MHD患者持续反复地暴露于肝素,故过去20年关于该人群H/PF4抗体阳性率及重要性愈发引人关注,但研究结果各不相同,现在已知有些患者可以检测到H/PF4抗体但仍无症状,无HIT或血栓形成,故H/PF4抗体的免疫生物学意义仍然令人困惑,需要通过更多的体外和体内研究进一步明确。
本研究存在以下不足:本实验为短期小样本研究,入组的夜间延长血液透析患者数偏少,今后需要通过大样本且长期的随访进一步研究。另外本研究未探讨他汀类、阿司匹林或其他抗血小板药物对H/PF4抗体及血管通路功能障碍的影响。
| [1] |
HAASE M, BELLOMO R, ROCKTAESCHEL J, ZIEMER S, KIESEWETTER H, MORGERA S, et al. Use of fondaparinux (ARIXTRA®) in a dialysis patient with symptomatic heparin-induced thrombocytopaenia type Ⅱ[J]. Nephrol Dial Transplant, 2005, 20: 444-446. DOI:10.1093/ndt/gfh544 |
| [2] |
KUO C, TSAI C C, CHEN C A, TSAI Y F, CHEN Y H. Anti-platelet factor 4/heparin antibody plays a significant role in progression of arterial stiffness among hemodialysis patients[J]. Acta Cardiologica Sinica, 2017, 33: 188-194. |
| [3] |
LIU C C, CHOU L P, CHEN T S, CHEN C A, TSAI Y F. Significant association of anti-platelet factor 4/heparin antibody with cardiovascular disease in hemodialysis patients:a longitudinal 7-year study[J]. Int Urol Nephrol, 2018, 50: 2289-2297. DOI:10.1007/s11255-018-2002-y |
| [4] |
O'SHEA S I, SANDS J J, NUDO S A, ORTEL T L. Frequency of anti-heparin-platelet factor 4 antibodies in hemodialysis patients and correlation with recurrent vascular access thrombosis[J]. Am J Hematol, 2002, 69: 72-73. DOI:10.1002/ajh.10032 |
| [5] |
BENJAMIN J, MOLDAVSKY S, LEE J, RUBIN R. Prevalence of heparin-induced antibody in African-American hemodialysis patients-comparison to non-dialysis patients[J]. Clin Nephrol, 2009, 71: 263-266. DOI:10.5414/CNP71263 |
| [6] |
ZHAO D, SUN X, YAO L, LIN H, LI J, ZHAO J, et al. The clinical significance and risk factors of anti-platelet factor 4/heparin antibody on maintenance hemodialysis patients: a two-year prospective follow-up[J/OL]. PLoS One, 2013, 8: e62239. doi: 10.1371/journal.pone.0062239.
|
| [7] |
MYA H T, TAY H M, GAN S W, SURENDRAN S, YEANG S H, LIM C C, et al. Screening frequency, incidence and pattern of heparin-induced thrombocytopenia syndrome at a large tertiary institution[J]. Int J Hematol, 2016, 104: 92-98. DOI:10.1007/s12185-016-2013-3 |
| [8] |
VAYNE C, GUÉRY E A, CHARUEL N, BESOMBES J, LAMBERT W C, ROLLIN J, et al. Evaluation of functional assays for the diagnosis of heparin induced thrombocytopenia using 5B9, a monoclonal IgG that mimics human antibodies[J]. J Thromb Haemost, 2020, 18: 968-975. DOI:10.1111/jth.14749 |
| [9] |
李森, 范连凯, 吴为, 赵永强, 王书杰. 二种检测肝素/PF4复合物抗体免疫学方法在肝素诱导的血小板减少症中的诊断价值[J]. 中华血液学杂志, 2019, 40: 411-416. |
| [10] |
AREPALLY G M. Heparin-induced thrombocytopenia[J]. Blood, 2017, 129: 2864-2872. DOI:10.1182/blood-2016-11-709873 |
| [11] |
ALTHAUS K, HRON G, STROBEL U, ABBATE R, ROGOLINO A, DAVIDSON S, et al. Evaluation of automated immunoassays in the diagnosis of heparin induced thrombocytopenia[J/OL]. Thromb Res, 2013, 131: e85-e90. doi: 10.1016/j.thromres.2013.01.005.
|
| [12] |
WARKENTIN T E, SHEPPARD J A I, LINKINS L A, ARNOLD D M, NAZY I. Performance characteristics of an automated latex immunoturbidimetric assay[J]. Thromb Res, 2017, 153: 108-117. DOI:10.1016/j.thromres.2017.03.010 |
| [13] |
POUPLARD C, LEROUX D, REGINA S, ROLLIN J, GRUEL Y. Effectiveness of a new immuno-assay for the diagnosis of heparin-induced thrombocytopenia and improved specificity when detecting IgG antibodies[J]. Thromb Haemost, 2010, 103: 145-150. DOI:10.1160/TH09-04-0253 |
| [14] |
PALOMO I, PEREIRA J, ALARCÓN M, DÍAZ G, HIDALGO P, PIZARRO I, et al. Prevalence of heparin-induced antibodies in patients with chronic renal failure undergoing hemodialysis[J]. J Clin Lab Anal, 2005, 19: 189-195. DOI:10.1002/jcla.20076 |
| [15] |
CHEN Y H, LIN K C, TSAI Y F, YU L K, HUANG L H, CHEN C A. Anti-platelet factor 4/heparin antibody is associated with progression of peripheral arterial disease in hemodialysis patients[J]. Int Urol Nephrol, 2015, 47: 1565-1570. DOI:10.1007/s11255-015-1056-3 |
| [16] |
GO A S, CHERTOW G M, FAN D, MCCULLOCH C E, HSU C Y. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization[J]. N Engl J Med, 2004, 351: 1296-1305. DOI:10.1056/NEJMoa041031 |
| [17] |
MATSUO T, WANAKA K, WALENGA J M. Evaluation of circuit and AV fistula clotting and detection of anti-PF4/heparin complex antibodies in hemodialysis patients suspected of having heparin-induced thrombocytopenia[J]. Clin Appl Thromb Hemost, 2013, 19: 73-78. DOI:10.1177/1076029612436676 |
| [18] |
QIAO J, ARTHUR J F, GARDINER E E, ANDREWS R K, ZENG L, XU K. Regulation of platelet activation and thrombus formation by reactive oxygen species[J]. Redox Biol, 2018, 14: 126-130. DOI:10.1016/j.redox.2017.08.021 |
| [19] |
AMABILE N, GUÉRIN A P, TEDGUI A, BOULANGER C M, LONDON G M. Predictive value of circulating endothelial microparticles for cardiovascular mortality in end-stage renal failure:a pilot study[J]. Nephrol Dial Transplant, 2012, 27: 1873-1880. DOI:10.1093/ndt/gfr573 |
| [20] |
RYU J H, LIM S Y, RYU D R, KANG D H, CHOI K B, KIM S J. Association between vascular access failure and microparticles in hemodialysis patients[J]. Kidney Res Clin Pract, 2012, 31: 38-47. DOI:10.1016/j.krcp.2011.12.002 |
| [21] |
TANAKA M, ISHII H, AOYAMA T, TAKAHASHI H, TORIYAMA T, KASUGA H, et al. Ankle brachial pressure index but not brachial-ankle pulse wave velocity is a strong predictor of systemic atherosclerotic morbidity and mortality in patients on maintenance hemodialysis[J]. Atherosclerosis, 2011, 219: 643-647. DOI:10.1016/j.atherosclerosis.2011.09.037 |
| [22] |
ASMIS L M, SEGAL J B, PLANTINGA L C, FINK N E, KERMAN J S, KICKLER T S, et al. Heparin-induced antibodies and cardiovascular risk in patients on dialysis[J]. Thromb Haemost, 2008, 100: 498-504. DOI:10.1160/TH08-03-0144 |
| [23] |
CARRIER M, KNOLL G A, KOVACS M J, MOORE J C, FERGUSSON D, RODGER M A, et al. The prevalence of antibodies to the platelet factor 4-heparin complex and association with access thrombosis in patients on chronic hemodialysis[J]. Thromb Res, 2007, 120: 215-220. DOI:10.1016/j.thromres.2006.09.014 |
| [24] |
刘新宇, 李宓, 苏明, 周文英.维持性血液透析患者肝素-血小板因子4抗体的相关研究[J/CD].中华临床医师杂志(电子版), 2011, 5: 111-115.
|
| [25] |
STOLIC R V, TRAJKOVIC G Z, KOSTIC M M, MIHAILOVIC B, JOVANOVIC A N, LAZIC B D, et al. Factors affecting the patency of arteriovenous fistulas for hemodialysis:single center experience[J]. Hemodial Int, 2018, 22: 328-334. DOI:10.1111/hdi.12615 |
| [26] |
KUWAHARA G, HASHIMOTO T, TSUNEKI M, YAMAMOTO K, ASSI R, FOSTER T R, et al. CD44 promotes inflammation and extracellular matrix production during arteriovenous fistula maturation[J]. Arterioscler Thromb Vasc Biol, 2017, 37: 1147-1156. DOI:10.1161/ATVBAHA.117.309385 |
| [27] |
MATTIOLI A V, BONETTI L, ZENNARO M, AMBROSIO G, MATTIOLI G. Heparin/PF4 antibodies formation after heparin treatment:temporal aspects and long-term follow-up[J]. Am Heart J, 2009, 157: 589-595. DOI:10.1016/j.ahj.2008.11.007 |
| [28] |
MAHARAJ S, CHANG S, SEEGOBIN K, MORALES J, AYSOLA A, RANA F, et al. Temporality of heparin-induced antibodies: a retrospective study in outpatients undergoing hemodialysis on unfractionated heparin[J/OL]. Exp Hematol Oncol, 2018, 7: 23. doi: 10.1186/s40164-018-0115-8.
|
 2020, Vol. 41
2020, Vol. 41


