2. 广东食品药品职业学院药学院药物分析教研室, 广州 510520;
3. 蚌埠医学院药学系, 蚌埠 233030
2. Department of Pharmaceutical Analysis, School of Pharmacy, Guangdong Food and Drug Vocational College, Guangzhou 510520, Guangdong, China;
3. Department of Pharmacy, Bengbu Medical College, Bengbu 233030, Anhui, China
甘草为豆科植物甘草、胀果甘草或光果甘草的干燥根和根茎[1]。初步统计,2015年版《中华人民共和国药典》收载的中药制剂中含有甘草饮片的制剂约占23%,如此大量的需求导致每批甘草药材和饮片的检验要耗费巨大的人力、物力和财力,寻求简单、快速的检验方法不仅降低检验成本,还可以提高检验效率。研究表明三萜皂苷和黄酮类是甘草的主要成分,其中甘草酸和甘草苷是评价甘草质量的常用主要考察指标。目前甘草中甘草酸和甘草苷的含量测定方法主要有HPLC和高效毛细管电泳法[2-5],这些检测方法具有高效、高灵敏度的优点,也有样品预处理烦琐、试剂消耗量大、实验时间长、对环境造成污染等缺点。近年来化学计量学的发展极大地拓展了近红外光谱法的应用,在中草药领域中建立成分含量测定方法已有一些研究[6-11]。本研究利用近红外光谱结合偏最小二乘(partial least square,PLS)法,建立了快速测定甘草饮片中甘草酸和甘草苷含量的方法,与传统色谱法相比样品预处理简单、环保,而且实现了快速、无损检测,为甘草饮片中2种成分的含量测定提供了一种新的光谱分析方法。
1 材料 1.1 仪器SupNIR-2700近红外光谱分析仪[聚光科技(杭州)股份有限公司];岛津LC-20AD型高效液相色谱仪,包括二元泵、在线脱气机、DAD检测器等(日本岛津公司);08895-79超声波清洗器(美国COLE PARMER公司);XS205DU电子天平(瑞士METTLER TOLEDO公司);GZX-9240鼓风干燥箱(上海博迅实业有限公司);100 g密封型手提式中药粉碎机(广州市旭朗机械设备有限公司);三号筛网,50目(浙江省上虞市纱筛厂)。
1.2 试药甘草饮片28批,购自多家医院药房和零售药店,其中来自甘肃14批[批号150402、151102、160401、160802、161102、161201、170501、170601,上海同济堂药业有限公司;批号171220,江苏华洪药业科技有限公司;批号180801,上海岳阳医院;批号18082706、2018101304,海军军医大学(第二军医大学)长海医院;批号181206,上海中医医院;批号181215-1,上海市静安区闸北中心医院],新疆9批(批号151022、161201、170527-1、170527-2、170916、180413,铜陵禾田中药饮片股份有限公司;批号A180301、A180601,上海德康医药商店长海路店;批号180918,上海市静安区闸北中心医院),内蒙古2批(批号180201,上海同济堂药业有限公司;批号2018113006,上海中医医院),山西3批(批号190228-1、190228-2、190228-3,铜陵禾田中药饮片股份有限公司)。甘草酸铵对照品(批号110731-201619,含量93.0%),购于中国食品药品检定研究院;甘草苷对照品(批号CDAA-281111,含量98.3%),购于上海安谱实验科技股份有限公司;乙腈、甲醇[色谱纯,赛默飞世尔科技(中国)有限公司];磷酸(分析纯,国药集团化学试剂有限公司);水为蒸馏水,海军军医大学(第二军医大学)长海医院制剂室自制。
2 方法和结果 2.1 样品预处理将甘草饮片置于60 ℃的烘箱中,烘干4 h,取出放冷后粉碎,粉末过三号筛网(50目),密封,干燥保存,即得样品粉末。
2.2 采集近红外光谱数据28批样品每批取2份,共56份样本,每份取3 g,装入石英瓶,压实,进行测定,实验室温度为25 ℃,相对湿度为45%~60%。近红外光谱仪参数设置为:测样方法为积分球漫反射,光谱采集范围为2 500~1 000 nm,分辨率为1 nm,扫描次数为64次。56份甘草饮片样品的近红外光谱叠加图如图 1所示,每条谱线由1 500个数据点构成。
|
图 1 甘草饮片的近红外光谱叠加图 |
2.3 甘草饮片中甘草酸和甘草苷的含量测定 2.3.1 供试品溶液的制备
精密称取2.1项下处理的样品0.01 g,置于5 mL量瓶中,精密加入70%甲醇5 mL,密封,称定质量,超声处理(功率160 W,频率40 kHz)1 h,冷却至室温,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.3.2 标准曲线溶液的制备分别精密称取甘草酸铵和甘草苷标准品20.39、6.67 mg,置10 mL量瓶中,用甲醇溶解并稀释至刻度,分别制得浓度为2.039、0.667 mg/mL的母液。各取母液适量制成不同浓度的标准曲线混合溶液,甘草酸的浓度分别为4.644、9.289、18.58、37.16、74.31、148.6和185.8 μg/mL,甘草苷的浓度分别为1.639、3.278、6.557、13.11、26.23、52.45和65.57 μg/mL。
2.3.3 色谱条件色谱柱:Agilent ZORBAX Extend-C18(4.6 mm×250 mm,5 μm);流动相:0.05%磷酸溶液(A)和乙腈(B)按下列程序进行梯度洗脱:0~8 min,22% B;8~60 min,22%→40% B;60~60.01 min,40%→100% B;60.01~65 min,100%→22% B。流速:0.8 mL/min;进样量:20 μL;检测波长:甘草酸250 nm,甘草苷276 nm。根据建立的色谱条件对标准品和甘草饮片样品进行测定,甘草酸、甘草苷的保留时间分别为52.5、6.7 min。色谱图见图 2。

|
图 2 混合标准品溶液及甘草饮片样品溶液的HPLC色谱图 A:混合标准品溶液,检测波长为276 nm;B:混合标准品溶液,检测波长为250 nm;C:甘草饮片样品溶液,检测波长为276 nm;D:甘草饮片样品溶液,检测波长为250 nm.1:甘草苷;2:甘草酸.HPLC:高效液相色谱法 |
2.3.4 线性关系
将不同浓度梯度的混合标准品溶液进样,按照色谱条件进行测定,以横坐标(X)为浓度、纵坐标(Y)为峰面积进行线性回归。甘草酸和甘草苷线性范围分别为4.644~185.8 μg/mL和1.639~65.57 μg/mL;标准曲线方程分别为Y=24 824X+3 827.7(R2=1,n=7)和Y=42 829X+6 649.2(R2=0.999 9,n=7)。
2.3.5 精密度取2.3.2项下方法制备的浓度分别为37.16、13.11 μg/mL的甘草酸和甘草苷混合标准品溶液,按2.3.3色谱条件连续进样测定6次,甘草酸和甘草苷峰面积的相对标准偏差(relative standard deviation,RSD)分别为0.66%和0.72%,表明方法的精密度良好。
2.3.6 重复性取同一批甘草饮片样品6份,按2.3.1项下方法进行供试品溶液制备,按2.3.3项下色谱条件测定,计算甘草酸和甘草苷的平均含量为3.01%和0.75%,RSD为1.60%和3.91%,表明方法的重复性良好。
2.3.7 稳定性取2.3.1项下方法制备的浓度分别为60.80、15.20 μg/mL的甘草酸和甘草苷供试品溶液,于0、2、4、6、8 h分别测定,甘草酸和甘草苷峰面积的RSD分别为1.21%和2.35%,表明供试品溶液在8 h内稳定。
2.3.8 加样回收率取已知含量的甘草饮片样品(产地甘肃,批号161102)9份,每份约0.01 g,精密称定,分别加入甘草酸对照品185.8、204.4、260.1 μg各3份,甘草苷对照品65.57、72.12、91.79 μg各3份,按2.3.1项下方法制备供试品溶液,按2.3.3项下色谱条件测定甘草酸和甘草苷含量,计算加样回收率。甘草酸、甘草苷的平均加样回收率为100.16%、97.13%,RSD为3.28%、3.35%,表明方法的准确度满足测定要求。
2.3.9 含量测定按2.3.3项下色谱条件测定28批甘草饮片中甘草酸和甘草苷的含量,每批测2份。
2.4 模型的建立与验证 2.4.1 甘草酸和甘草苷的含量测定化学值按2.3.3项下色谱条件,采用HPLC法测定含量,以标准曲线法计算。
2.4.2 不同预处理方法优化的校正模型选择本研究采用PLS法建立校正甘草饮片中甘草酸和甘草苷含量的模型。模型的评价指标主要有建模集和验证集变量间的线性关系(相关系数)、交互验证均方差(root-mean-squares error of cross validation,RMSECV)。定量分析模型建立采用OPUS 7.8软件进行。对采集的甘草饮片近红外光谱数据采用不同的光谱预处理方法进行筛选和优化,建立光谱数据与甘草酸和甘草苷含量数据间最佳的校正模型。最终确定消除常数偏移量和一阶导数+矢量归一化分别作为甘草酸和甘草苷含量模型的光谱预处理方法,检验方法采用交叉验证,分别以2 200~2 049、1 750~1 450、1 151~1 001 nm和1 795~1 475、1 395~1 293、1 125~1 030 nm的波长范围作为最佳范围,由表 1、表 2可以看出,不同预处理方法或不同波长范围对模型的影响不同。
|
|
表 1 不同预处理方法甘草酸和甘草苷含量校正模型结果 |
|
|
表 2 不同波长范围甘草酸和甘草苷含量校正模型结果 |
2.4.3 主因子数的选择
本研究中,甘草酸和甘草苷主因子数的筛选和RMSECV之间的关系如图 3所示,甘草酸和甘草苷均以主因子数9建模时RMSECV值最小。
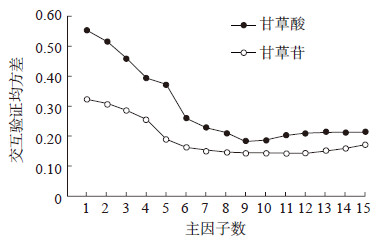
|
图 3 主因子数对甘草酸和甘草苷含量模型交互验证均方差的影响 |
2.4.4 甘草饮片中甘草酸和甘草苷含量模型的建立
以PLS方法建模,留一交叉验证,甘草酸以消除常数偏移量为近红外光谱预处理方法(波长范围:2 200~2 049、1 750~1 450、1 151~1 001nm),甘草苷以一阶导数+矢量归一化为近红外光谱预处理方法(波长范围:1 795~1 475、1 395~1 293、1 125~1 030 nm)。结果甘草酸和甘草苷校正模型的交叉检验相关系数分别为0.981和0.919、RMSECV分别为0.184和0.144,各项参数的评价良好,甘草酸和甘草苷含量近红外光谱预测值与化学值的相关性如图 4所示。
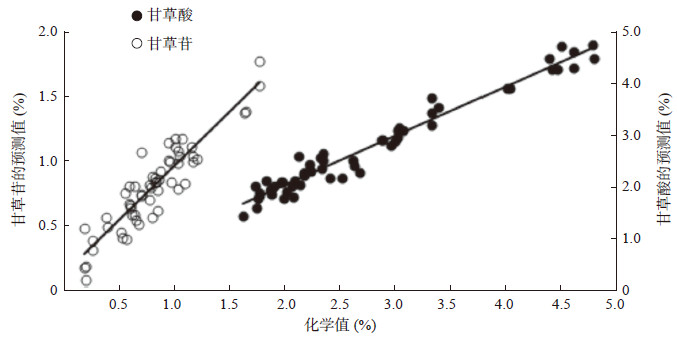
|
图 4 甘草酸和甘草苷近红外光谱预测值与化学值的相关性 |
3 讨论
本研究最初采用2015年版《中华人民共和国药典》收载的HPLC法测定甘草饮片中甘草酸和甘草苷含量[1],不论采用15 cm还是25 cm长度的十八烷基硅烷键合硅胶柱,在药典所载色谱条件下有些产地的饮片样品成分对2个待测成分的测定均存在干扰,方法的专属性不理想,影响测定的准确性。再者,药典所载检测波长为237 nm并不是2个待测成分的最大吸收波长,在一定程度上影响方法的检测灵敏度。鉴于此,本研究重新优化了梯度洗脱程序,分别选择甘草酸和甘草苷的最大吸收波长250 nm和276 nm为检测波长,采用二极管阵列检测器达到同时测定2个成分含量的目的,经验证方法的专属性、精密度和准确度均满足测定要求。
本研究在建立近红外光谱法同时测定甘草饮片中甘草酸和甘草苷的含量测定模型时,考察了不同光谱预处理方法和不同波长范围对两者定量分析模型的影响,可见甘草酸模型的整体相关系数均明显优于甘草苷模型,由于近红外光谱是化合物分子内部一些含氢基团(C-H、O-H、N-H及S-H等)振动的倍频和合频吸收信息,化学信息量丰富,但吸收峰的特异性和选择性不高,含量高的化合物往往在近红外光谱图上显示出的信息量更大,HPLC测定结果可知甘草饮片中甘草酸含量远远高于甘草苷,因此甘草酸模型的拟合效果更好,甘草酸含量的预测值与化学值的相对偏差在±10%和±20%之间者占比分别为80%和98%,而甘草苷则分别只有48%和70%,由此可见样品含量越高预测结果的相关性愈好、准确性愈高。
部分样品中甘草酸和甘草苷含量的化学值和预测值存在一定的偏差,主要可能来自于近红外光谱数据采集的取样和光谱仪器扫描引入,同时建立的最优化拟合模型并非适用于所有样本定量结果的准确预测。
本研究所建立的近红外光谱法快速测定甘草饮片中甘草酸和甘草苷含量的模型,为快速评价不同产地甘草饮片的质量提供了一种新方法和可行性,在中药饮片质量评价中具有广阔的应用前景,值得推广使用。为提高模型的适用性和实用性,后期可以根据实际使用需求进一步扩大不同产地甘草饮片的样本量,用以对所建立的模型进行修正和完善,以期达到样品的预测值与化学值之间的相关系数>0.95且相对偏差尽可能小(<10%,甚至<5%),提高该模型预测未知样品的准确度。
| [1] |
国家药典委员会.中华人民共和国药典(一部)[S].北京: 中国医药科技出版社, 2015: 86-87.
|
| [2] |
崔淑芬, 张信青, 许柏球, 王小如. 高效液相色谱法同时测定甘草中甘草酸和甘草苷的含量[J]. 时珍国医国药, 2006, 17: 307-308. |
| [3] |
栾海云, 张树平, 李金莲, 刘秀珍. HPLC法测定甘草酸和甘草苷的含量[J]. 现代生物医学进展, 2010, 10: 1539-1542. |
| [4] |
蔡翠芳, 冀小君, 堐榜琴, 高淑红. 甘草饮片中甘草苷和甘草酸含量分析[J]. 中国现代药物应用, 2009, 3: 3-5. |
| [5] |
周逸芝, 韩乐, 刘训红, 傅兴圣, 许虎, 李俊松, 等. 甘草饮片HPCE指纹图谱研究[J]. 中国现代应用药学, 2012, 29: 405-409. |
| [6] |
王丽, 何鹰, 邱招钗, 王小如, 黎先春. 光纤近红外光谱法在中草药中的应用--甘草中甘草酸含量的测定[J]. 光谱学与光谱分析, 2005, 25: 1397-1399. |
| [7] |
LIU X S, ZHANG S Y, NI H F, XIAO W, WANG J, LI Y R, et al. Near infrared system coupled chemometric algorithms for the variable selection and prediction of baicalin in three different processes[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2019, 218: 33-39. DOI:10.1016/j.saa.2019.03.113 |
| [8] |
LI S L, SHAO Q S, LU Z H, DUAN C L, YI H J, SU L Y. Rapid determination of crocins in saffron by near-infrared spectroscopy combined with chemometric techniques[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2018, 190: 283-289. DOI:10.1016/j.saa.2017.09.030 |
| [9] |
YANG Y, WU Y J, LI W L, LIU X S, ZHENG J Y, ZHANG W T, et al. Determination of geographical origin and icariin content of Herba Epimedii using near infrared spectroscopy and chemometrics[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2018, 191: 233-240. DOI:10.1016/j.saa.2017.10.019 |
| [10] |
王遥琼, 王维皓. 近红外光谱用于甘草中甘草苷、甘草酸及水分测定[J]. 中国实验方剂学杂志, 2016, 22: 59-62. |
| [11] |
雍婧姣, 王霞, 石思佳, 温奎申, 佟月, 张霞, 等. 基于R语言的近红外光谱对甘草中指标成分定量分析[J]. 中国实验方剂学杂志, 2019, 25: 176-181. |
 2020, Vol. 41
2020, Vol. 41


