患者女,28岁,因四肢进行性无力伴头晕3年,于2017年3月29日收入我院神经内科。患者3年前劳累后出现四肢酸痛无力,行走上坡困难,休息后症状缓解,但仍感四肢肌肉疼痛,活动及行走不如以前,四肢无力症状逐渐加重。现双上肢上举费力、握物不紧,以右上肢为更明显,已不能梳头,双下肢爬坡、上楼、臀位起立费力,伴有颈背部酸痛。既往无特殊病史,患者有1位兄长,二十几岁时感冒后出现四肢酸痛、肌无力,症状逐渐加重,现肢体无力明显,已不能上坡,不能从事日常体力活动,四肢肌肉明显萎缩。
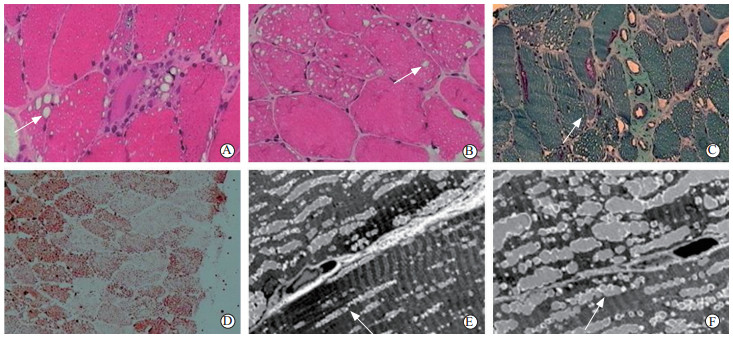
入院后体格检查:血压115/60 mmHg(1 mmHg=0.133 kPa),心率82 min-1,发育正常,神志清,构音清,咽反射尚存在,心、肺、腹未见明显异常,双上肢肌张力低(右上肢肌力4-级,左上肢肌力4级),双下肢肌张力正常(肌力4+级),双上肢肌腱反射减退,双下肢肌腱反射正常,无肌肉萎缩,无肌束颤动,无肌肉握痛及假性肥大,病理反射未引出,无感觉障碍。实验室检查:肌酸激酶1 799 U/L,肌酸激酶同工酶83.3 U/L,乳酸脱氢酶430 U/L。肌电图提示:右三角肌、右肱二头肌静息状态可见失神经电位,运动单元时限缩窄,多相点位增多;所检神经传导速度未见异常。符合肌源性损害。肌活组织检查(右肱二头肌)光镜下显示:送检组织大小基本一致,排列整齐,未见坏死肌纤维改变,偶见少许再生肌纤维,部分肌纤维胞质内可见空泡散在(图 1A),部分小空泡融合呈大空泡或裂隙样,间质未见明显增生,未见细胞浸润(图 1B)。冰冻切片结缔组织改良格莫瑞三色(modified Gemory trichrome,MGT)染色未见破碎红纤维,可见少许镶边空泡(图 1C)。油红O(oil red O,ORO)染色:脂滴含量未见增多,即未见Jordan现象(图 1D)。透射电镜检查(图 1E、1F):肌纤维大部分肌膜连续性完整,肌膜下肌原纤维具有排列整齐Z线,部分肌纤维肌膜下以及肌原纤维之间见较多脂滴和溶酶体沉积,且脂滴呈串珠样排列,线粒体稍显增多,间质未见炎性细胞浸润,毛细血管基膜未见明显增厚。基因检测发现患者PNPLA2基因1个纯合致病突变和MYH7基因1个杂合可疑致病突变。诊断:脂质沉积性肌病(lipid storage myopathy,LSM),单纯肌病型中性脂肪沉积症(neutral lipid storage disease with myopathy,NLSDM)。治疗:服用维生素B2,50 mg/次,每日3次。嘱患者多食瘦肉、低脂高蛋白食物、新鲜绿色蔬菜。住院期间患者肌无力症状有所缓解,1周后复查肌酶:肌酸激酶542 U/L,肌酸激酶同工酶47 U/L,乳酸脱氢酶288 U/L,患者出院后定期随诊,治疗效果不佳,肌无力症状反复且逐渐加重。
|
图 1 肌活组织检查(右臂肱二头肌)结果 A:部分肌纤维胞质内可见空泡散在(H-E染色);B:部分小空泡融合呈大空泡或裂隙样(H-E染色);C:未见破碎红纤维,可见少许镶边空泡(改良格莫瑞三色染色);D:脂滴含量未见增多(油红O染色);E,F:部分肌纤维肌膜下及肌原纤维之间见较多脂滴和溶酶体沉积,且脂滴呈串珠样排列,线粒体稍显增多(透射电镜)。箭头所示均为脂质沉积形成的空泡征. Original magnification:×400(A,B);×200(C,E,F);×100(D) |
2 讨论
LSM是指在肌肉中有异常含量的脂质沉积,且为主要的病理改变,为肌肉长链脂肪酸氧化过程缺陷所致的代谢性肌病,是神经系统脂肪代谢遗传性疾病的一种表现形式[1-2]。LSM临床表现为进行性肌无力和运动不耐受,病程可有波动性。按病因LSM可分为:晚发型多酰基辅酶A脱氢酶缺乏症(multiple acyl coenzyme A dehydrogenase deficiency,MADD)、原发性系统性肉碱缺乏症(primary carnitine deficiency,PCD)、NLSDM和中性脂肪沉积症伴鱼鳞病(neutral lipid storage disease with ichthyosis,NLSDI),晚发型MADD单用核黄素(维生素B2)治疗有肯定疗效;PCD在我国罕见,补充肉碱治疗有效;NLSDM仅次于MADD,居我国LSM发病病因第2位,暂无有效治疗方法;NLSDI在我国未见报道[3]。
本例患者诊断为NLSDM,是由PNPLA2基因突变导致脂肪三酰甘油脂肪酶功能缺陷引起的[4],为常染色体隐性遗传病。回顾38例国内外文献中经基因证实的NLSDM病例[5-6],其特点为:(1)从婴儿早期到66岁均可发病,发病年龄中位数为30岁;(2)男女比例无明显差异,其中女性占47.36%;(3)32.25%的患者有血缘关系;(4)86.84%的患者表现为进行性肌无力,其中42.42%表现为不对称性肌无力,右侧受累占不对称性肌无力表现的91.67%;(5)血清肌酸激酶水平异常(61~4 700 U/L),中位数为897 U/L;(6)34例报告肌肉活组织检查结果,所有标本均有脂质沉积,其中有23.52%有边缘空泡;(7)44.44%的NLSDM患者有心肌病。(8)在所有的病例中,均出现外周血涂片ORO染色白细胞中脂质积累,此现象被称为“Jordan现象”。本例患者外周血涂片ORO染色未见脂质沉积,考虑与症状的严重性相关,该患者症状较轻,未出现相关并发症。(9)报道的PNPLA2基因突变显示在外显子4~7中。评估突变位点和临床表型之间的关联,包括发病年龄,肌病分布和共病,没有发现任何基因型-表型相关性。
LSM易被误诊为糖原贮积病、线粒体肌病、多发性肌炎、肌营养不良症、脊髓性肌萎缩及重症肌无力等[7-11],应注意鉴别。但在临床中的另一种并不少见的疾病包涵体肌炎,与NLSDM的临床表现也较为相似,均可表现为成年发病和远端肌肉受累,且可见典型镶边空泡纤维,临床医生也应重视。包涵体肌炎多伴有明显的炎症细胞浸润和单核细胞侵入非坏死纤维现象,且其基质和核基内有管状细丝包涵体,肌纤维内没有大量的脂肪沉积[12]。遗传性包涵体肌病肌肉活组织检查病理表现为大量的镶边空泡纤维,但无脂肪沉积,基因突变分析可发现GNE基因突变[1]。
目前NLSDM尚缺乏特异、有效的治疗手段,糖皮质激素、左旋肉碱和核黄素治疗均无明显效果[13]。本例患者入院后症状有改善,考虑与纠正贫血及减少活动有关。研究表明, 中链脂肪酸饮食疗法可能有一定疗效[13]。将一日三餐改为一日多餐以减少糖原转化为脂肪;中链脂肪酸饮食、椰子油及奶制品的中链脂肪酸相对较多,可减少脂肪在肌纤维内过多的沉积[6]。
综上所述,NLSDM是一种PNPLA2基因突变致脂肪三酰甘油脂肪酶功能缺陷导致的常染色体隐性遗传病,为临床罕见病,但累及年龄范围广,以中年多见;起病隐匿,缓慢进展。临床特征为四肢对称或者不对称的肌无力和肌萎缩,远端和近端均可受累。既往文献报道中指出NLSDM患者外周血中性粒细胞质内可见脂肪滴沉积(既Jordan现象)是其诊断标准之一[3],本例患者虽未出现Jordan现象,但其临床表现、肌肉活组织检查及基因检测均符合NLSDM诊断标准,因此外周血ORO染色的Jordan现象不是其诊断的必要条件。
| [1] |
ANGELINI C, NASCIMBENI A C, CENACCHI G, TASCA E. Lipolysis and lipophagy in lipid storage myopathie[J]. Biochim Biophys Acta, 2016, 1862: 1367-1373. DOI:10.1016/j.bbadis.2016.04.008 |
| [2] |
LIANG W C, NISHINO I. Lipid storage myopathy[J]. Curr Neurol Neurosci Rep, 2011, 11: 97-103. DOI:10.1007/s11910-010-0154-y |
| [3] |
中华医学会神经病学分会, 中华医学会神经病学分会神经肌肉病学病, 中华医学会神经病学分会肌电图及临床神经生理学组. 中国脂质沉积性肌病诊治专家共识[J]. 中华神经科杂志, 2015, 48: 941-945. |
| [4] |
MISSAGLIA S, MAGGI L, MORA M, GIBERTINI S, BLASEVICH F, AGOSTONI P, et al. Late onset of neutral lipid storage disease due to novel PNPLA2 mutations causing total loss of lipase activity in a patient with myopathy and slight cardiac involvement[J]. Neuromuscul Disord, 2017, 27: 481-486. DOI:10.1016/j.nmd.2017.01.011 |
| [5] |
KANEKO K, KURODA H, IZUMI R, TATEYAMA M, KATO M, SUGIMURA K, et al. A novel mutation in PNPLA2 causes neutral lipid storage disease with myopathy and triglyceride deposit cardiomyovasculopathy:a case report and literature review[J]. Neuromuscul Disord, 2014, 24: 634-641. DOI:10.1016/j.nmd.2014.04.001 |
| [6] |
卢晓庆, 胡波琳, 陈燕红, 丁卫江, 漆学良.PNPLA2基因新发纯合移码突变导致中性脂肪沉积症伴肌病1例报告[J].2018, 10: 935-936.
|
| [7] |
管玉青, 谢作善, 郑卉, 潘速跃. 误诊为多发性肌炎的脂质沉积性肌病--附3例报告[J]. 中国神经精神疾病杂志, 2012, 38: 101-104. |
| [8] |
TAN J, YANG H, FAN J, FAN Y, XIAO F. Patients with neutral lipid storage disease with myopathy (NLSDM) in Southwestern China[J]. Clin Neurol Neurosurg, 2018, 168: 102-107. DOI:10.1016/j.clineuro.2018.03.001 |
| [9] |
PERRIN L, FÉASSON L, FURBY A, LAFORÊT P, PETIT F M, GAUTHERON V, et al. PNPLA2 mutation:a paediatric case with early onset but indolent course[J]. Neuromuscul Disord, 2013, 23: 986-991. DOI:10.1016/j.nmd.2013.08.008 |
| [10] |
HIRANO K, IKEDA Y, ZAIMA N, SAKATA Y, MATSUMIYA G. Triglyceride deposit cardiomyovasculopathy[J]. N Engl J Med, 2008, 359: 2396-2398. DOI:10.1056/NEJMc0805305 |
| [11] |
LI M, HIRANO K I, IKEDA Y, HIGASHI M, HASHIMOTO C, ZHANG B, et al. Triglyceride deposit cardiomyovasculopathy:a rare cardiovascular disorder[J]. Orphanet J Rare Dis, 2019, 14: 134. DOI:10.1186/s13023-019-1087-4 |
| [12] |
杨建, 李吉娜, 刘晓光. 包涵体肌炎的临床与病理特点(附1例报告)[J]. 转化医学电子杂志, 2016, 3: 90-91. |
| [13] |
LU X, YANG X, LIU J. Differential control of ATGL-mediated lipid droplet degradation by CGI-58 and G0S2[J]. Cell Cycle, 2010, 9: 2719-2725. |
 2020, Vol. 41
2020, Vol. 41


