2. 中国药科大学生命科学与技术学院, 南京 211198;
3. 海军军医大学(第二军医大学)东方肝胆外科医院仪器设备科, 上海 201805
2. School of Life Science and Technology, China Pharmaceutical University, Nanjing 211198, Jiangsu, China;
3. Department of Medical Equipment, Eastern Hepatobiliary Surgery Hospital, Naval Medical University(Second Military Medical University), Shanghai 201805, China
肺癌是全球范围内发生率与死亡率最高的恶性肿瘤之一,美国最新统计报告显示,预计2020年全美新发癌症患者达1 806 590例,死亡606 520例,其中新发支气管癌及肺癌228 820例,死亡135 720例[1]。支气管癌及肺癌中80%以上是非小细胞肺癌(non-small cell lung cancer,NSCLC),由于发病隐匿,多数NSCLC患者确诊时已处于晚期,失去手术机会,预后较差[2]。免疫抑制信号的激活是癌细胞免疫逃避的重要机制,近几年针对免疫检查点分子细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)、程序性死亡蛋白1(programmed death 1,PD-1)、程序性死亡配体1(programmed death ligand 1,PD-L1)设计的抗肿瘤免疫治疗发展迅猛,CTLA-4、PD-1、PD-L1抑制剂在临床前和临床试验中获得良好疗效[3]。虽然这些免疫抑制剂显著延长了部分肺癌患者的生存期,但总体反应率仍然很低[4]。为了提高肺癌免疫治疗疗效,有必要深入研究肺癌免疫检查点分子表达和功能的调控机制,挖掘其中调控信号通路的生物标志物,并通过这些生物标志物筛选可能的免疫治疗获益病例,这正是当前急需解决的问题。本研究拟探讨NSCLC癌组织中PD-L1的表达及调控机制,阐明PD-L1与miRNA-200家族的关系,为临床设计更优越的以PD-L1抗体为主导的协同治疗方案提供依据。
1 材料和方法 1.1 病例标本收集南通大学附属医院2018年1月至2019年12月138例NSCLC患者资料和标本,所有患者术前均未接受任何方式针对肿瘤的治疗。138例患者中,男97例,女41例;年龄37~86岁,中位年龄68岁。所有患者均经病理组织学检查确诊,其诊断、分型及分期依据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)标准[5]。手术标本取癌组织和相应的癌旁组织,癌组织避开中心坏死区取材,癌旁组织在距癌组织边缘2 cm以外的区域取材。一部分标本经甲醛固定、石蜡包埋后切片,用于免疫组织化学染色;一部分新鲜标本于-80 ℃保存,用于qRT-PCR检测。本研究通过南通大学附属医院生物医学研究伦理委员会审批。
1.2 临床标本PD-L1免疫组织化学检测免疫组织化学染色过程参照SP试剂盒(福州迈新生物技术开发有限公司)说明进行。鼠抗人PD-L1单克隆抗体购自福州迈新生物技术开发有限公司,工作浓度为1:100。每张切片在200倍镜下计数5个视野的阳性细胞数,并计算阳性率。
1.3 临床标本miRNA-200家族qRT-PCR检测将新鲜NSCLC标本经TRIzol试剂盒(美国Invitrogen公司)裂解提取总RNA,采用qRT-PCR试剂盒(大连宝生物公司)检测miRNA-200家族5个成员(miRNA-200a、miRNA-200b、miRNA-200c、miRNA-429、miRNA-141)的含量。内参选用U6基因。引物由上海捷瑞生物工程有限公司合成。
1.4 肺癌细胞系A549过表达miRNA-200家族实验人肺癌A549细胞系由中国科学院上海生物细胞研究所提供,用含10% FBS的DMEM培养液(美国Gibco公司)于37 ℃、5% CO2培养箱中培养。设计miRNA-200家族模拟物(mimics),并设置阴性对照(miRNA-NC),均由广州锐博生物技术有限公司化学合成。将A549细胞按每孔1×106个细胞的密度接种于6孔板中,培养过夜后细胞贴壁,换无血清培养液并加入miRNA-200家族模拟物(终浓度20 µg/mL),继续培养48 h。收集细胞,采用TRIzol试剂盒提取总RNA,采用qRT-PCR检测miRNA-200家族的表达水平。
1.5 肺癌细胞系A549表达PD-L1的蛋白质印迹检测A549细胞转染miRNA-200家族模拟物后培养48 h,收集细胞,采用TRIzol试剂盒抽提总蛋白,用蛋白质印迹法检测PD-L1的表达。以GAPDH作为内参照。PD-L1抗体(货号ab213524,工作浓度1:1 000)和GAPDH抗体(货号ab181602,工作浓度1:2 000)均为英国Abcam公司产品。
1.6 miRNA-200家族对A549细胞增殖活性的影响将A549细胞按每孔5×103的密度接种于96孔板中,培养过夜后细胞贴壁,换无血清培养液并加入miRNA-200家族模拟物(终浓度为20 µg/mL),继续培养24、48、72 h;弃培养液,每孔加入100 μL 0.1 mol/L PBS,再按CCK-8试剂盒(上海碧云天生物技术有限公司)说明书加入CCK-8试剂,置孵箱内孵育过夜。用酶标仪(Bio-Rad公司)进行检测,读取570 nm波长处光密度值,校正波长为655 nm。计算细胞存活率:细胞存活率(%)=[(实验孔光密度值-空白孔光密度值)/(对照孔光密度值-空白孔光密度值)]×100%。
1.7 PD-L1与miRNA-200家族调控的荧光素酶报告基因验证合成PD-L1基因的3'-非翻译区(untranslated region,UTR)序列的2个片段F1和F2,F1(5'-AGAGTCTCAGTGTTG-3')含有miRNA-200a和miRNA-141的结合位点,F2(5'-AACGGGACAGTATTT-3')含有miRNA-200b、miRNA-200c和miRNA-429的结合位点。将F1和F2分别插入荧光素酶报告基因载体(pGL3-Control,美国Promega公司)中,构建pGL3-F1和pGL3-F2质粒。将A549细胞按每孔5×103个细胞的密度接种于96孔板,培养24 h后换无血清培养液,加入miRNA-200家族模拟物和阴性对照miRNA-NC(终浓度20 µg/mL),24 h后每孔加入pGL3-F1和pGL3-F2各200 ng进行转染,并加入pRL-TK质粒(美国Promega公司)20 ng进行共转染,再培养48 h后,回收并裂解细胞,测定荧光素酶活性。
1.8 统计学处理采用SPSS 18.0软件进行统计学分析。计量资料以x±s表示,组间比较采用独立样本t检验;计数资料以例数和百分数表示,组间比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 NSCLC癌组织PD-L1表达与临床病理学特征的关系免疫组织化学染色结果显示,PD-L1阳性反应多见于细胞核和细胞质(图 1),NSCLC癌组织PD-L1阳性率为58.7%(81/138),而癌旁组织阳性率仅为3.6%(5/138),癌组织PD-L1阳性率高于癌旁组织(P<0.05)。分析PD-L1与NSCLC临床病理特征的关系,结果显示,PD-L1表达水平与NSCLC患者的性别、年龄、肿瘤大小、组织学类型无关,而与淋巴结转移、脉管侵犯、临床TNM分期密切相关,有淋巴结转移、有微血管和淋巴管侵犯、临床分期较晚的患者PD-L1阳性率较高(P均<0.05,表 1)。

|
图 1 NSCLC患者癌组织及癌旁组织PD-L1免疫组织化学染色 Fig 1 PD-L1 immunohistochemistry staining of cancer tissues and paracancerous tissues in NSCLC patients A: Paracancerous tissue; B: Poorly differentiated lung adenocarcinoma tissue. NSCLC: Non-small cell lung cancer; PD-L1: Programmed death ligand 1. Original magnification: ×200 |
|
|
表 1 NSCLC患者癌组织PD-L1表达与临床病理特征的关系 Tab 1 Association between PD-L1 expression in cancer tissues and clinicopathological features of NSCLC patients |
2.2 NSCLC癌组织miRNA-200家族表达水平及其与PD-L1的关系
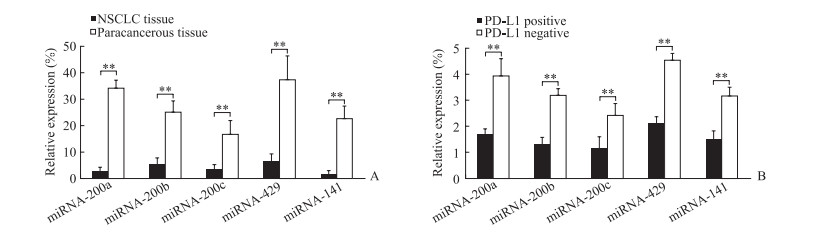
qRT-PCR检测结果显示,患者癌组织中miRNA-200a、miRNA-200b、miRNA-200c、miRNA-429、miRNA-141表达水平均低于癌旁组织(P均<0.01,图 2A),以miRNA-200a、miRNA-429和miRNA-141为最显著。进一步分析这些miRNA表达水平与癌组织PD-L1表达的关系,发现PD-L1表达阳性的患者具有更低水平的miRNA-200家族表达(P均<0.01,图 2B)。
|
图 2 qRT-PCR检测NSCLC患者癌组织miRNA-200家族的表达及其与PD-L1的关系 Fig 2 qRT-PCR analysis of miRNA-200 family expression and its relationship with PD-L1 in cancer tissues of NSCLC patients A: Expression levels of miRNA-200 family in NSCLC tissues and paracancerous tissues (n=138); B: Expression of miRNA-200 family in NSCLC tissues with PD-L1 positive (n=81) and negative (n=57) expression. qRT-PCR: Quantitative real-time polymerase chain reaction; NSCLC: Non-small cell lung cancer; miRNA: microRNA; PD-L1: Programmed death ligand 1. **P < 0.01. x±s |
2.3 肺癌细胞过表达miRNA-200家族能下调PD-L1表达
qRT-PCR检测结果显示,A549细胞转染miRNA-200家族模拟物后,miRNA-200a、miRNA-200b、miRNA-200c、miRNA-429、miRNA-141表达水平均较阴性对照组升高(P均<0.01,图 3A)。蛋白质印迹检测结果显示,这些miRNA模拟物均能下调PD-L1表达(P均<0.01,图 3B)。

|
图 3 肺癌细胞A549过表达miRNA-200家族对PD-L1表达的影响 Fig 3 Impact of miRNA-200 family overexpression on PD-L1 expression in lung cancer A549 cells A: qRT-PCR analysis demonstrated that miRNA-200 family was highly expressed following transfection with miRNA-200 family mimics in A549 cells; B: Western blotting analysis showed that the expression of PD-L1 decreased following transfection with miRNA-200 family mimics in A549 cells. miRNA: microRNA; NC: Negative control; PD-L1: Programmed death ligand 1; qRT-PCR: Quantitative real-time polymerase chain reaction; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. **P < 0.01 vs miRNA-NC group. n=3, x±s |
2.4 肺癌细胞A549过表达miRNA-200家族能抑制细胞的增殖活性
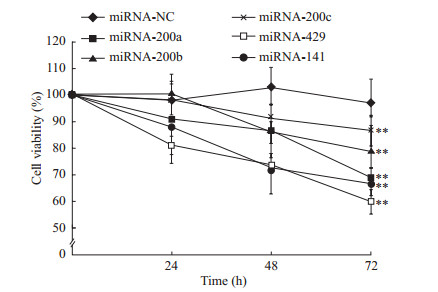
CCK-8实验结果显示,A549细胞转染阴性对照miRNA后24、48、72 h,细胞存活率基本保持平稳,说明转染过程本身不会对细胞存活率造成明显影响。A549细胞转染miRNA-200家族模拟物后,癌细胞存活率随时间延长而逐渐下降,72 h时与阴性对照组相比差异均有统计学意义(P均<0.01),其中miRNA-429、miRNA-141和miRNA-200a的作用最显著(图 4)。
|
图 4 CCK-8实验检测肺癌细胞A549过表达miRNA-200家族对细胞增殖活性的抑制作用 Fig 4 CCK-8 assay indicated that miRNA-200 family overexpression inhibited the proliferation of lung cancer A549 cells CCK-8: Cell counting kit-8; miRNA: microRNA; NC: Negative control. **P < 0.01 vs miRNA-NC group. n=3, x±s |
2.5 PD-L1是miRNA-200家族的靶基因
荧光素酶报告基因实验证实,miRNA-200a和miRNA-141模拟物能使pGL3-F1的荧光素酶活性下降,与阴性对照组相比差异均有统计学意义(P均<0.01),但对pGL3-F2的荧光素酶活性无影响;miRNA-200b、miRNA-200c和miRNA-429模拟物能使pGL3-F2的荧光素酶活性下降,与阴性对照组相比差异均有统计学意义(P均<0.01),但对pGL3-F1的荧光素酶活性无影响(图 5)。

|
图 5 荧光素酶报告基因实验证实PD-L1是miRNA-200家族靶基因 Fig 5 Luciferase assay confirmed that PD-L1 was the target gene of miRNA-200 family PD-L1: Programmed death ligand 1; miRNA: microRNA; NC: Negative control. pGL3-F1: The luciferase reporter vector contains miRNA-200a and miRNA-141 binding sites; pGL3-F2: The luciferase reporter vector contains miRNA-200b, miRNA-200c and miRNA-429 binding sites. **P < 0.01 vs miRNA-NC group. n=3, x±s |
上述结果提示,PD-L1是miRNA-200家族的靶基因,miRNA-200家族能下调PD-L1的表达,但5个miRNA-200家族成员的作用位点不同,miRNA-200a和miRNA-141共同作用于一个序列区,miRNA-200b、miRNA-200c和miRNA-429共同作用于一个序列区。
3 讨论PD-L1是一种相对分子质量为40 000的Ⅰ型跨膜蛋白,由CD274基因编码,因此又称为CD274或B7同源物1(B7 homolog 1,B7-H1)。PD-L1的主要功能是与其受体PD-1结合传递免疫抑制信号,减少淋巴结中抗原特异性CD8+ T淋巴细胞的增殖[6]。PD-L1在多种肿瘤中均有表达,特别是NSCLC、胃癌、胶质细胞瘤、黑素瘤、肾癌、前列腺癌、肝癌等[7-8]。在肿瘤细胞表面表达的PD-L1与T淋巴细胞表达的PD-1相互作用,能够保证肿瘤细胞的免疫逃避功能,促使肿瘤细胞生长。抑制PD-L1/PD-1通路能够提高CD8+ T细胞功能,并抑制调节性T淋巴细胞功能,从而达到抗肿瘤的目的[9]。根据这个原理,已开发出PD-L1或PD-1抗体类药物,用来阻断PD-L1与PD-1的相互作用,并因此增强宿主抗肿瘤免疫应答、抑制肿瘤生长。目前,已有多种抗PD-L1和抗PD-1的抗体被批准用于临床试验或临床前研究中,并表现出令人期待的效果[10-11]。
关于NSCLC中PD-L1的表达已有较多文献报道,但各结果间差异较大。Miyazawa等[12]研究表明,PD-L1在肺鳞癌(44%)和大细胞癌(67%)中阳性率高于腺癌(21%);在腺癌的各亚型中,PD-L1阳性率在腺泡型腺癌为57%,实体型腺癌为55%,明显高于乳头型腺癌和腺泡型腺癌。该研究还发现,PD-L1阳性表达与男性(P=0.001)、吸烟者(P=0.027)、病理分期晚(P=0.018)、静脉浸润阳性(P=0.001)、淋巴管浸润阳性(P=0.011)等相关,但与年龄、临床分期、胸膜浸润、表皮生长因子受体突变不相关。本研究通过免疫组织化学染色对138例NSCLC的癌组织及癌旁组织PD-L1进行检测,发现癌组织中PD-L1总阳性率为58.7%(81/138),大细胞癌阳性率(66.7%,10/15)略高于鳞癌(57.9%,33/57)和腺癌(57.6%,38/66)。PD-L1的表达水平与患者性别、年龄、肿瘤大小、组织学类型不相关,而与淋巴结转移、脉管侵犯、临床TNM分期密切相关,有淋巴结转移、有微血管和淋巴管侵犯、临床分期较晚的患者PD-L1阳性率明显升高。本研究结果提示,PD-L1可能与NSCLC的恶性进展密切相关。
PD-L1阳性表达的调控机制非常复杂,还有很多影响因素没有确定。研究发现,PD-L1受很多癌基因和抑癌基因调控,如PD-L1的表达会被抑癌基因PTEN抑制,在神经胶质瘤中敲除PTEN则能够通过激活PI3K/AKT下游mTOR-S6K1信号通路增加PD-L1的转录表达[13]。此外,PD-L1在肺癌细胞中与miRNA的关系也极为密切,一些miRNA如miRNA-34、miRNA-200、miRNA-197等能显著影响PD-L1抗体的疗效[14]。研究PD-L1和miRNA之间的关系将有助于阐明PD-L1表达的调控机制和研发有效的靶向治疗策略。
为深入研究NSCLC中PD-L1表达差异的影响因素及其机制,本研究检测了138例NSCLC中miRNA-200家族5个miRNA(miRNA-200a、miRNA-200b、miRNA-200c、miRNA-429、miRNA-141)的表达,发现NSCLC中miRNA-200家族水平均低于癌旁组织,并且这些miRNA均与PD-L1存在反向平行关系,即PD-L1表达阳性的患者具有更低水平的miRNA-200家族表达,提示miRNA-200家族与PD-L1表达相关。本研究在高表达PD-L1的肺癌细胞A549中过表达miRNA-200家族,发现随miRNA-200家族水平升高PD-L1表达水平下调,提示miRNA-200家族能负调控NSCLC细胞的PD-L1表达,而且这种负调控抑制了癌细胞的增殖活性。荧光素酶报告基因检测结果确认PD-L1是miRNA-200家族全部5个miRNA的靶基因,但其作用位点有所不同。本研究结果阐明PD-L1受miRNA-200家族的直接调控,为设计NSCLC靶向治疗策略提供了参考依据。
志谢 南通大学附属医院为本研究提供病例资料和标本,特此感谢!
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70: 7-30. DOI:10.3322/caac.21590 |
| [2] |
ANDRATSCHKE N, KRAFT J, NIEDER C, TAY R, CALIFANO R, SOFFIETTI R, et al. Optimal management of brain metastases in oncogenic-driven non-small cell lung cancer (NSCLC)[J]. Lung Cancer, 2019, 129: 63-71. DOI:10.1016/j.lungcan.2018.12.009 |
| [3] |
REMON J, PASSIGLIA F, AHN M J, BARLESI F, FORDE P M, GARON E B, et al. Immune checkpoint inhibitors in thoracic malignancies:review of the existing evidence by an IASLC expert panel and recommendations[J]. J Thorac Oncol, 2020, 15: 914-947. DOI:10.1016/j.jtho.2020.03.006 |
| [4] |
LINGLING Z, JIEWEI L, LI W, DANLI Y, JIE Z, WEN L, et al. Molecular regulatory network of PD-1/PD-L1 in non-small cell lung cancer[J/OL]. Pathol Res Pract, 2020, 216: 152852. doi: 10.1016/j.prp.2020.152852.
|
| [5] |
KIM I G, HU X G, WANG H J, KIM B W, HONG S Y, SHEN X Y. The 7th/8th American Joint Committee on Cancer and the modified Union for International Cancer Control staging system for hepatocellular carcinoma[J]. Yonsei Med J, 2019, 60: 140-147. DOI:10.3349/ymj.2019.60.2.140 |
| [6] |
DISKIN B, ADAM S, CASSINI M F, SANCHEZ G, LIRIA M, AYKUT B, et al. PD-L1 engagement on T cells promotes self-tolerance and suppression of neighboring macrophages and effector T cells in cancer[J]. Nat Immunol, 2020, 21: 442-454. DOI:10.1038/s41590-020-0620-x |
| [7] |
PATEL S P, KURZROCK R. PD-L1 expression as a predictive biomarker in cancer immunotherapy[J]. Mol Cancer Ther, 2015, 14: 847-856. DOI:10.1158/1535-7163.MCT-14-0983 |
| [8] |
JIANG Y, CHEN M, NIE H, YUAN Y. PD-1 and PD-L1 in cancer immunotherapy:clinical implications and future considerations[J]. Hum Vaccin Immunother, 2019, 15: 1111-1122. DOI:10.1080/21645515.2019.1571892 |
| [9] |
ZHANG J, DANG F, REN J, WEI W. Biochemical aspects of PD-L1 regulation in cancer immunotherapy[J]. Trends Biochem Sci, 2018, 43: 1014-1032. DOI:10.1016/j.tibs.2018.09.004 |
| [10] |
ITO A, KONDO S, TADA K, KITANO S. Clinical development of immune checkpoint inhibitors[J/OL]. Biomed Res Int, 2015, 2015: 605478. doi: 10.1155/2015/605478.
|
| [11] |
ZIELINSKI C C. A phase Ⅰ study of MEDI4736, NNT-PD-L1 antibody in patients with advanced solid tumors[J]. Transl Lung Cancer Res, 2014, 3: 406-407. |
| [12] |
MIYAZAWA T, MARUSHIMA H, SAJI H, KOJIMA K, HOSHIKAWA M, TAKAGI M, et al. PD-L1 expression in non-small-cell lung cancer including various adenocarcinoma subtypes[J]. Ann Thorac Cardiovasc Surg, 2019, 25: 1-9. |
| [13] |
ZHAO L, LI C, LIU F, ZHAO Y, LIU J, HUA Y, et al. A blockade of PD-L1 produced antitumor and antimetastatic effects in an orthotopic mouse pancreatic cancer model via the PI3K/Akt/mTOR signaling pathway[J]. Onco Targets Ther, 2017, 10: 2115-2126. DOI:10.2147/OTT.S130481 |
| [14] |
GRENDA A, KRAWCZYK P. New dancing couple:PD-L1 and microRNA[J]. Scand J Immunol, 2017, 86: 130-134. DOI:10.1111/sji.12577 |
 2020, Vol. 41
2020, Vol. 41


