根治性膀胱切除联合盆腔淋巴结清扫术是治疗肌层浸润性膀胱癌及高危非肌层浸润性膀胱癌的“金标准”[1]。膀胱切除后,需进行尿流改道,输尿管皮肤造口或回肠代膀胱术等非可控性尿流改道的患者需终身佩戴集尿袋,影响患者生活质量。因此,原位新膀胱术受到患者青睐。随着泌尿外科全面进入微创时代,腹腔镜全膀胱切除术凭借出血少、疼痛小和恢复快等优势,正逐步取代开放手术。由于腹腔镜器械自身的不足,腔镜下缝合是手术中的难点,尤其是在体内制作回肠新膀胱和尿道新膀胱吻合时。因此腹腔镜根治性膀胱切除术(laparoscopic radical cystectomy,LRC)和原位回肠新膀胱术多限于有丰富手术经验的术者开展。达芬奇(da Vinci)手术机器人系统在保留腹腔镜微创特点的基础上,借助其在3D视野和仿真手腕操作等方面的优势,在狭小的骨盆中进行大量精细的分离和缝合等操作时更易于保留神经和重建尿控结构,使手术操作难度明显降低,达到切除肿瘤、保护功能和预防并发症的“三连胜”(trifecta)目标。本研究回顾性分析2019年1月至2019年12月我院行机器人辅助腹腔镜根治性膀胱切除术(robot-assisted laparoscopic radical cystectomy,RARC)联合原位回肠新膀胱术治疗的膀胱癌患者的围手术期资料和短期随访结果,探讨该术式的疗效和安全性。
1 资料和方法 1.1 临床资料选择2019年1月至2019年12月在我院行RARC联合原位回肠新膀胱术治疗的膀胱癌患者22例。22例患者均为男性,年龄为32~71岁(中位年龄63岁),BMI为20.13~29.64 kg/m2(中位数24.58 kg/m2),美国麻醉医师协会(American Society of Anesthesiologists,ASA)评分为1~3分(中位数2分)。术前行胸部CT平扫、上尿路CT尿路造影等检查,排查盆腔淋巴转移或远处转移。术前通过膀胱镜或诊断性经尿道膀胱肿瘤电切术获得病理标本,确诊为浸润性膀胱癌或T1期高级别膀胱癌伴有原位癌。术前1 d流质饮食,术前当晚给予复方聚乙二醇电解质溶液行肠道准备。
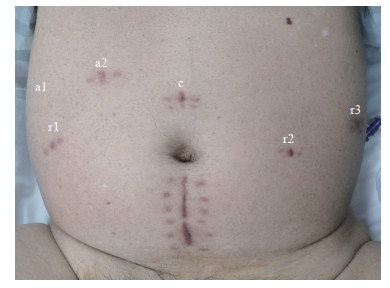
1.2 手术方法行气管插管全身麻醉,患者取35°头低脚高平卧位。采用四臂达芬奇手术机器人系统(da Vinci Si),使用30°和0°镜头。取脐上4 cm处做腹正中12 mm纵切口,置入气腹针建立气腹,气腹压力为13 mmHg(1 mmHg=0.133 kPa),置入12 mm镜头套管;按类似机器人辅助腹腔镜根治性前列腺切除术的套管布局,直视下置入3个8 mm机械臂套管和2个12 mm辅助套管(图 1)。如行单孔RARC,则经脐取7 cm纵切口,并置入单孔多通道操作套管。
|
图 1 RARC中6套管布局和切口位置 Fig 1 Position of the six trocars and incisions for RARC RARC: Robot-assisted laparoscopic radical cystectomy; c: 12-mm camera lens trocar; r1, r2, r3: Robotic arm trocars; a1, a2: Assistant trocars |
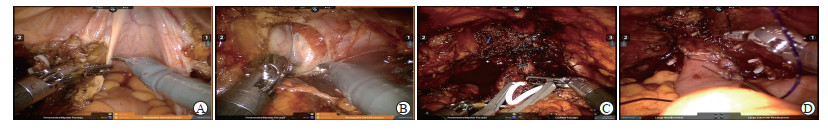
手术步骤:(1)探查腹腔脏器,分离双侧输尿管至膀胱。(2)于精囊腺表面打开腹膜,分离精囊腺背侧至Denonvilliers筋膜(图 2A)。(3)沿脐韧带外侧打开腹膜,结扎并离断双侧输精管,向内推开膀胱,暴露盆底筋膜,打开盆底筋膜至前列腺尖部(图 2B)。(4)上抬膀胱,分离输尿管、脐动脉、膀胱上动脉和膀胱侧血管束,依次用Hem-o-lok夹夹闭后切断,检视输尿管残端,并送术中冰冻切片检查。(5)于Denonvilliers筋膜反折处横行切开筋膜并向下推开,用Hem-o-lok夹夹闭前列腺侧血管束,逐步分离至前列腺尖部。(6)于膀胱顶部离断脐动脉并向下分离,显露耻骨后间隙,切断耻骨前列腺韧带,缝扎背静脉复合体并悬吊于耻骨联合。(7)精细分离前列腺前后唇,用Hem-o-lok夹夹闭尿道并离断(图 2C),保留尽可能多的尿道残端,尿道切缘送冰冻切片检查。将膀胱前列腺复合体装入标本袋,置于腹腔内。检查创面,缝扎止血。(8)进行常规淋巴结清扫,范围包括髂外、髂内、闭孔和部分髂总淋巴结。如术前影像学检查怀疑盆腔淋巴结转移,则向上扩大至主动脉分叉和骶前淋巴结。将清扫的淋巴结按部位标记,装入标本袋。(9)分离乙状结肠背侧,将左侧输尿管拖至右侧备用。经脐下取7 cm正中切口取出所有标本。(10)经取出标本的切口拖出肠管,距回盲部15~20 cm处截取45~55 cm回肠,用吻合器侧侧吻合恢复肠道连续性。截取肠段远侧35~45 cm去管化构建IUPU新膀胱(北大医院改良新膀胱)[2]或USC-Studer新膀胱(南加州大学改良新膀胱)[3],预留新膀胱尿道吻合口。双侧输尿管分别或采用并口法吻合于新膀胱输入袢并内置输尿管支架管。重新上机并连接机械臂,用Rocco缝线重建尿道后方结构并减少新膀胱尿道吻合张力,双针倒刺线连续缝合完成新膀胱尿道吻合(图 2D)。重新置入三腔导尿管,并检查新膀胱水密性。冲洗创面,彻底止血,创面留置负压引流管。
|
图 2 RARC联合原位回肠新膀胱术手术步骤 Fig 2 Procedures of RARC combined with orthotopic ileal neobladder A: Dissect the posterior wall of the bladder when lifting the bladder; B: Open the peritoneum outside the umbilical artery and open the pelvic fascia after pushing the bladder inward; C: Separate the apex of prostate and resect the urethra; D: Perform vesicourethral anastomosis by double-needle barbed suture. RARC: Robot-assisted laparoscopic radical cystectomy |
1.3 术后管理
术后给予预防性抗炎、营养支持治疗,用2%碳酸氢钠溶液持续冲洗膀胱,监测血常规、肝肾功能、电解质、降钙素原等血液学指标,依据加速康复外科(enhanced recovery after surgery,ERAS)原则鼓励患者术后早期下床活动,常规不留置胃管,肛门排气后逐步恢复饮食。根据负压引流液减少情况,排除尿瘘后拔除负压引流管。IUPU新膀胱术后14 d拔除单J管,再7 d后拔除导尿管;USC-Studer新膀胱术后10 d拔除导尿管,嘱患者加强提肛训练,定时定量排尿并记录排尿日记,术后2个月复查上尿路CT尿路造影并拔除双J管。
1.4 观察指标观察并记录手术方法、手术时间、术后拔管时间、并发症发生情况等围手术期资料,记录术后病理结果。随访期间复查上尿路CT造影观察肾积水和膀胱容量,记录肿瘤复发情况和尿控效果。
1.5 统计学处理采用SPSS 16.0软件处理数据。符合正态分布的计量资料以x±s表示,不符合正态分布的计量资料以中位数表示;计数资料以例数和百分数表示。
2 结果 2.1 手术情况本组22例手术均顺利完成,无术中转开放手术者。其中4例为单孔RARC,2例为全腔镜下原位回肠新膀胱术。手术时间为320~600 min,平均(420±36)min。术中出血量为100~400 mL,平均(150±17)mL,围手术期均未输血。术后1~2 d(中位数2 d)下床活动,1~3 d(中位数2 d)恢复肠道通气,5~21 d(中位数10 d)拔除负压引流管,10~25 d(中位数14 d)拔除导尿管。
2.2 围手术期并发症本组患者均无术中肠道损伤、术后肠梗阻等肠道并发症,无切口感染。2例患者因导尿管堵塞导致新膀胱前壁漏尿,分别延长留置导尿管14 d和20 d后自行愈合。所有患者术后查引流液乳糜反应均为阳性,给予补充白蛋白和低脂饮食后均恢复,无淋巴囊肿形成。
2.3 病理结果输尿管及尿道切缘术中冰冻切片和术后标本病理结果均为阴性。所有患者术后病理结果均为尿路上皮癌,高级别21例,低级别1例。病理分期:T1期8例,T2期12例,T3a期2例;N0期20例,N1期2例。术后病理确诊盆腔淋巴转移2例,后续给予辅助化学治疗。
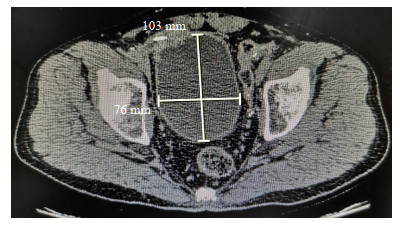
2.4 随访结果术后随访3~15个月(中位随访时间8个月),未出现肿瘤复发,无患者死亡。术后2个月复诊时行上尿路计算机断层扫描尿路造影等检查,未见中重度肾积水,膀胱容量满意(图 3)。20例(90.1%)患者恢复日间自主控尿(使用≤1片尿垫),单次尿量为200~300 mL;17例(77.3%)患者通过夜间闹铃定时排尿,恢复夜间自主控尿(使用≤1片尿垫)。1例患者术后4个月因憋气后突发内疝导致肠坏死行手术治疗;2例患者术后6个月左右出现排尿困难,尿流率5~6 mL/s,复查膀胱镜见尿道吻合口轻度狭窄,周围肠黏液附着,嘱其间歇自我导尿后缓解。
|
图 3 术后2个月复查计算机断层扫描尿路造影示膀胱形态良好、容量满意 Fig 3 Satisfactory bladder morphology and capacity were confirmed 2 months postoperatively through computed tomography urography |
3 讨论
RARC不仅具有传统LRC手术创伤小、出血少、术后恢复快的优点,而且凭借传统腹腔镜无法比拟的稳定精准器械定位、高清3D显示效果、多向仿真手腕操作特性及能够减轻术者疲劳的人体工程学设计,使术者在狭小的盆腔内长时间进行精细操作时更加得心应手。一项前瞻性多中心研究发现,RARC与开放根治性膀胱切除术相比具有相似的2年无进展生存期,但RARC组出血量更少,术后住院时间更短[4]。本组患者均未输血,术后恢复佳。术后病理确诊盆腔淋巴转移2例,后续给予辅助化学治疗。随访3~15个月未发现肿瘤复发和患者死亡,这可能与本组患者分期较早且随访时间短有关。手术时间较长,为320~600 min,这可能与机器人上机准备时间长、术者学习曲线和助手配合熟练程度等有关[5]。与传统腹腔镜手术相比,RARC要求助手具有熟练的腹腔镜操作功底,术中吸引、辅助暴露创面和施放Hem-o-lok夹时要求一步到位、干净利落,助手的熟练操作可明显加速手术过程。此外,由于主刀医师与助手的“异地”属性,主刀只能“言传”,无法“身教”,需要助手熟悉RARC的整个手术操作,与主刀医师默契配合;同时,助手在长时间的手术过程中需时刻保持注意力高度集中,这也对助手的体力和精力提出了更高的要求。
RARC的套管布局与机器人辅助根治性前列腺切除术类似,围绕术区呈W样扇形铺开。但RARC的镜头孔更靠近头侧,这有利于后入路分离膀胱时通过上抬膀胱充分暴露双侧膀胱前列腺复合体的侧血管蒂。术中紧贴膀胱前列腺复合体进行非热性离断,可以有效保留双侧神经血管束,有助于术后性功能的恢复[6]。根据术者习惯,辅助套管置于患者左右侧均可;只有在进行完全体内尿流改道时,至少有1个辅助套管需置于左侧,或者利用“套管内套管”(trocar in trocar)技术,才能完成远端回肠的切割与吻合。本组中4例患者接受了单孔RARC,术中虽然存在器械冲突等困难,但通过改变切口方向(由横切口变为纵切口)、优化器械相对位置等措施,均顺利完成手术。行单孔RARC时,由于机械臂不能充分三角化,且没有第3机械臂提供稳定且充分的牵拉,术中视野暴露不佳,需要经腹壁穿线牵拉,同时借鉴侧入路的方法[7],从右往左逐步分离膀胱。
原位新膀胱术是整个手术过程中最烦琐、最耗时、并发症最多的部分。新膀胱的制作方法和外观形态多种多样,国内外常见的回肠新膀胱有U形、Y形[7]、Hautmann和Studer新膀胱等。由于在缝制新膀胱的过程中涉及到大量缝合操作,在腹腔镜时代只有少数经验极其丰富的术者才能纯手工完成体内缝制新膀胱。部分术者通过腔内吻合器制作U形新膀胱简化缝合,但同时也会出现吻合钉相关的并发症,如结石形成等[8]。多数术者选择将肠管拖出体外,完成新膀胱制作后,再放回体内完成尿道新膀胱吻合。手术机器人系统在体内缝合方面的巨大优势降低了手术医师在体内缝合新膀胱的难度,目前已有多例完全体内制作新膀胱的报道[9],并取得了良好的疗效。本组中20例患者采用体外制作新膀胱,重新上机后行尿道新膀胱吻合;2例采用完全体内制作USC-Studer新膀胱并吻合,该过程所花费的时间较前者至少增加2 h。手术时间明显延长、持续气腹状态和大角度的头低脚高位会增加患者的麻醉风险[10],因此如何平衡麻醉风险和手术创新一直是学者们讨论的热点。相信随着病例的累积和腔内缝合技术的精进,手术时间将会不断缩短。
据报道RARC的手术并发症发生率高达57.2%,而ERAS的应用能明显降低总体并发症和主要并发症的发生率,尤其是术后肠梗阻的发生[11]。本组患者均给予ERAS的关键处理,如术前不再进行3 d的肠道准备、不留置胃管、少使用阿片类镇痛药、早期充分的胃肠外营养支持、促胃肠动力药物、嚼口香糖、穿戴下肢抗血栓弹力袜、早期活动等,术后所有患者均未发生肠梗阻,所有患者均快速恢复饮食。与开放手术相比,RARC术后切口感染率明显降低(5.0% vs 28.6%),而切口保护套的使用甚至能将切口感染率降至0[12]。本组患者均使用切口保护套,不仅术后未出现切口感染等并发症,而且术中起到了良好的肌肉牵引作用,有利于新膀胱的制作和输尿管吻合。
尿控功能的恢复是评估术后早期效果的重要指标。借助机器人系统的优势,术中可精准解剖前列腺尖部,将尿道充分剥离,其近端甚至能到达精阜处,在不保留前列腺尖部的前提下维持足够长度的尿道残端。通过悬吊背静脉复合体于耻骨联合及重建Denonvilliers筋膜,重建尿道周围的尿控结构,从而稳定尿道的方向与位置[13]。此外,Rocco缝线的牵引固定作用还可减少尿道新膀胱吻合口的张力,减少吻合口瘢痕形成,同时有利于确切吻合尿道和回肠新膀胱,减少吻合口漏尿[14]。双重折叠的球形新膀胱形成低压、大容量的储尿囊,也为术后尿控功能的恢复创造了有利的条件。Satkunasivam等[15]行尿流动力学检查提示Studer新膀胱平均容量为514 mL,平均灌注227 mL时出现轻度憋尿感,平均残余尿量为82 mL,新膀胱顺应性良好。本组患者术后2个月复查上尿路CT尿路造影,根据新膀胱直径估算膀胱平均容量约为300 mL,通过鼓励患者加强提肛训练,日间控尿率达90.9%(20/22)。
综上所述,根据围手术期资料和短期的随访结果,RARC联合原位回肠新膀胱术治疗膀胱癌在临床上安全可行,通过加强训练和改善技巧可进一步缩短手术时间。该手术短期肿瘤控制和尿控效果满意,后续需通过病例累积和长期随访进一步评估该术式的远期疗效。
| [1] |
STEIN J P, LIESKOVSKY G, COTE R, GROSHEN S, FENG A C, BOYD S, et al. Radical cystectomy in the treatment of invasive bladder cancer:long-term results in 1, 054 patients[J]. J Clin Oncol, 2001, 19: 666-675. DOI:10.1200/JCO.2001.19.3.666 |
| [2] |
HONG P, DING G P, HAO H, YANG K L, ZHUANG L Y, CAI L, et al. Laparoscopic radical cystectomy with extracorporeal neobladder:our initial experience[J]. Urology, 2019, 124: 286-291. DOI:10.1016/j.urology.2018.11.017 |
| [3] |
CHOPRA S, DE CASTRO ABREU A L, BERGER A K, SEHGAL S, GILL I, ARON M, et al. Evolution of robot-assisted orthotopic ileal neobladder formation:a step-by-step update to the University of Southern California (USC) technique[J]. BJU Int, 2017, 119: 185-191. DOI:10.1111/bju.13611 |
| [4] |
PAREKH D J, REIS I M, CASTLE E P, GONZALGO M L, WOODS M E, SVATEK R S, et al. Robot-assisted radical cystectomy versus open radical cystectomy in patients with bladder cancer (RAZOR):an open-label, randomised, phase 3, non-inferiority trial[J]. Lancet, 2018, 391: 2525-2536. DOI:10.1016/S0140-6736(18)30996-6 |
| [5] |
LENFANT L, CAMPI R, PARRA J, GRAFFEILLE V, MASSON-LECOMTE A, VORDOS D, et al. Robotic versus open radical cystectomy throughout the learning phase:insights from a real-life multicenter study[J]. World J Urol, 2020, 38: 1951-1958. DOI:10.1007/s00345-019-02998-y |
| [6] |
HABERMAN K, WITTIG K, YUH B, RUEL N, LAU C, WILSON T G, et al. The effect of nerve-sparing robot-assisted radical cystoprostatectomy on erectile function in a preoperatively potent population[J]. J Endourol, 2014, 28: 1352-1356. DOI:10.1089/end.2014.0315 |
| [7] |
ASIMAKOPOULOS A D, CAMPAGNA A, GAKIS G, CORONA MONTES V E, PIECHAUD T, HOEPFFNER J L, et al. Nerve sparing, robot-assisted radical cystectomy with intracorporeal bladder substitution in the male[J]. J Urol, 2016, 196: 1549-1557. DOI:10.1016/j.juro.2016.04.114 |
| [8] |
FERRIERO M, GUAGLIANONE S, PAPALIA R, MUTO G L, GALLUCCI M, SIMONE G. Risk assessment of stone formation in stapled orthotopic ileal neobladder[J]. J Urol, 2015, 193: 891-896. DOI:10.1016/j.juro.2014.09.008 |
| [9] |
BENAMRAN D, PHÉ V, DROUIN S J, PERROT O, GRÉGORIS A, PARRA J, et al. Functional outcomes obtained with intracorporeal neobladder after robotic radical cystectomy for cancer: a narrative review[J/OL]. J Robot Surg, 2020. doi: 10.1007/s11701-020-01070-x.
|
| [10] |
CHEN K, WANG L, WANG Q, LIU X, LU Y, LI Y, et al. Effects of pneumoperitoneum and steep Trendelenburg position on cerebral hemodynamics during robotic-assisted laparoscopic radical prostatectomy: a randomized controlled study[J/OL]. Medicine (Baltimore), 2019, 98: e15794. doi: 10.1097/MD.0000000000015794.
|
| [11] |
TAN W S, TAN M Y, LAMB B W, SRIDHAR A, MOHAMMED A, BAKER H, et al. Intracorporeal robot-assisted radical cystectomy, together with an enhanced recovery programme, improves postoperative outcomes by aggregating marginal gains[J]. BJU Int, 2018, 121: 632-639. DOI:10.1111/bju.14073 |
| [12] |
HUYNH D, HENDERSON A, HADEN T, JONES A, POKALA N. Feasibility and safety study for the use of wound protectors during robotic radical cystectomy and ileal conduit[J]. J Robot Surg, 2017, 11: 187-191. DOI:10.1007/s11701-016-0640-6 |
| [13] |
MINEO BIANCHI F, ROMAGNOLI D, D'AGOSTINO D, SALVAGGIO A, GIAMPAOLI M, CORSI P, et al. Posterior muscle-fascial reconstruction and knotless urethro-neo bladder anastomosis during robot-assisted radical cystectomy:description of the technique and its impact on urinary continence[J]. Arch Ital Urol Androl, 2019, 91: 5-10. DOI:10.4081/aiua.2019.1.5 |
| [14] |
ALMASSI N, ZARGAR H, GANESAN V, FERGANY A, HABER G P. Management of challenging urethro-ileal anastomosis during robotic assisted radical cystectomy with intracorporeal neobladder formation[J]. Eur Urol, 2016, 69: 704-709. DOI:10.1016/j.eururo.2015.09.037 |
| [15] |
SATKUNASIVAM R, SANTOMAURO M, CHOPRA S, PLOTNER E, CAI J, MIRANDA G, et al. Robotic intracorporeal orthotopic neobladder:urodynamic outcomes, urinary function, and health-related quality of life[J]. Eur Urol, 2016, 69: 247-253. DOI:10.1016/j.eururo.2015.06.041 |
 2020, Vol. 41
2020, Vol. 41


