糖尿病是一种全身慢性代谢性疾病,2015年流行病学调查数据显示全球成人糖尿病的患病率约为8.8%,且预计未来25年内该比例将增长至13.6%[1]。2013年我国慢性病及其危险因素监测结果显示,18岁及以上人群糖尿病患病率为10.4%,其中以2型糖尿病(type 2 diabetes mellitus,T2DM)为主;随着我国人口老龄化加剧、人民生活方式低体力化、超重及肥胖人群比例增加,糖尿病患病率可能会进一步升高[2]。糖尿病常引发多种严重的急、慢性并发症,包括糖尿病微血管病变、脑卒中及心肌梗死等[3]。糖尿病眼部并发症以角膜、晶状体及视网膜病变最常见,其中糖尿病视网膜病变(diabetic retinopathy,DR)最严重,是致盲的首要原因[4]。眼底荧光素血管造影检查(fundus fluorescein angiography,FFA)可通过荧光素渗漏的形态及程度判断DR分期,提高DR的诊断率,是现阶段最常用的DR诊断金标准[5]。但FFA是一种有创检查,不能在血糖控制不佳、严重过敏体质、心血管疾病或肝肾功能不全的糖尿病患者中开展,所造成的对DR诊断及分期的判断困难常导致糖尿病患者丧失DR的最佳治疗时机。
角膜共聚焦显微镜(corneal confocal microscopy,CCM)是一种新型光学显微镜,以非侵入性的方式观察眼表组织在细胞水平的损伤,快速获取高分辨率图像和微观结构,被广泛运用于眼表疾病的诊断及眼表组织结构特征与变化的研究。角膜是眼球的重要组成部分,其中角膜神经的作用尤为重要。角膜神经可保持角膜的健康,一旦受损会导致角膜感觉、营养、代谢的障碍,引起点状角膜炎、角膜溃疡延迟愈合、干眼等。Schultz等[6]于1981年首次提出糖尿病角膜病变的概念,并发现糖尿病所致的角膜病变发病率高达47%~64%。有研究表明,T2DM患者具有泪膜稳定性差、泪液分泌功能下降、角结膜损害、角膜神经损伤等特点[7]。目前,在临床工作中CCM多用于感染性角结膜疾病的无创性诊断和角膜营养不良的组织形态学观察,然而对于糖尿病角膜神经病变与DR关系的研究较少。本研究应用CCM采集各个分期DR患者的角膜神经纤维图像,并利用ImageJ软件中NeuronJ插件半自动追踪系统对其进行量化,以期了解T2DM患者角膜神经病变及其与DR的相关性。
1 资料和方法 1.1 研究对象选取2017年3月至2019年8月于我院就诊的T2DM伴或不伴DR患者58例(58眼)作为研究对象(病例组),男33例、女25例,年龄48~76岁,平均年龄(60.16±7.25)岁。根据2002年糖尿病视网膜病变国际临床分级标准[8],无明显糖尿病视网膜病变(no diabetic retinopathy,NDR)患者16例(16眼)、非增殖期糖尿病视网膜病变(non-proliferative diabetic retinopathy,NPDR)患者21例(21眼)、增殖期糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)患者21例(21眼)。另选年龄相仿的健康人15例(15眼)作为对照(健康对照组)。所有研究对象均行常规裂隙灯检查、散瞳查眼底、眼底照相、CCM检查,病例组均行FFA检查。
病例组纳入标准:已明确诊断为T2DM患者。排除标准:(1)有眼科手术及外伤史;(2)有角膜等眼表疾病;(3)有角膜接触镜佩戴史;(4)有高眼压或青光眼病史;(5)裂隙灯检查显示角膜组织存在异常;(6)屈光间质不清;(7)因患者个人因素无法配合检查者。所有研究对象均签署了知情同意书,本研究获得海军军医大学(第二军医大学)长海医院伦理委员会批准。
1.2 检查方法(1) 裂隙灯检查:对受检者运用眼科裂隙灯行眼前节检查。
(2) 眼底照相:对受检者用复方托吡卡胺滴眼液(日本参天制药株氏会社)充分散瞳,然后用Kowa nonmyd α-D彩色眼底照相机进行眼底照相。
(3) FFA检查:对病例组受检者用复方托吡卡胺滴眼液充分散瞳后,从肘静脉推注5 mL 0.01%荧光素钠注射液,排除过敏反应后再推注10%荧光素钠注射液5 mL。采用德国海德堡HRA2眼底血管造影仪行荧光造影检查,分别在静脉期、动静脉期采集图像。
(4) CCM检查:采用德国海德堡HRT-3激光共聚焦角膜显微镜观察角膜神经丛。该系统放大倍率为800,分辨率1 μm,激光波长670 nm,图像面积为400 μm×400 μm。受检者坐于操纵台前,受检眼以盐酸丙美卡因(美国爱尔康公司)进行表面麻醉。调整操纵台高度,使下颌与前额分别固定在下颌托和前额托上,嘱受检者注视固视灯,预设置两者接触的焦平面深度为0。前移物镜至其与角膜轻微接触,微调物镜位置,观察受检者角膜各区域,转动焦平面调节环以获得不同深度的图像,选取角膜中央的清晰图像进行图像分析。所有操作均由同一位经验丰富的医师完成。
1.3 图像处理将采集的图像用ImageJ图像分析软件打开,应用NeuronJ插件半自动追踪系统对图像进行定量观察,并计算角膜神经纤维参数[9],包括:(1)角膜神经纤维长度(corneal nerve fiber length,CNFL):每平方毫米图像中神经纤维长度;(2)角膜神经纤维主干密度(corneal nerve fiber density,CNFD):每平方毫米图像中神经纤维主干数量;(3)角膜神经纤维分支密度(corneal nerve branch density,CNBD):每平方毫米图像中神经纤维主干的分支数量。
1.4 统计学处理应用SPSS 19.0软件进行统计学分析,呈正态分布的计量资料以x±s表示,呈偏态分布的的计量资料以中位数(下四分位数,上四分位数)表示。各组间性别比较采用列联表χ2检验。各组间年龄呈方差齐性,采用单因素方差分析进行比较。各组间角膜神经纤维参数CNFD、CNBD呈方差齐性,采用单因素方差分析进行组间比较;CNFL呈方差不齐性,采用非参数Mann-Whitney检验进行各组间比较。角膜神经纤维参数与年龄、DR严重程度的相关性采用Spearman相关分析。检验水准(α)为0.05。
2 结果 2.1 研究对象的一般资料16例NDR患者中男7例、女9例,平均年龄为(62.06±7.76)岁;21例NPDR患者中男14例、女7例,平均年龄为(61.05±7.63)岁;21例PDR患者中男12例、女9例,平均年龄为(57.86±6.07)岁。15例健康对照者中男10例、女5例,平均年龄为(59.67±8.02)岁。4组的年龄(F=1.171,P=0.327)及性别(χ2=2.441,P=0.486)差异均无统计学意义。
2.2 各组角膜神经纤维参数CNFL比较健康对照组及T2DM DR患者的角膜神经纤维图像见图 1。与健康对照组比较,病例组中NDR、NPDR和PDR患者CNFL均降低(P均<0.01);病例组中,随DR病情进展,CNFL逐步降低(P均<0.01)。见表 1。
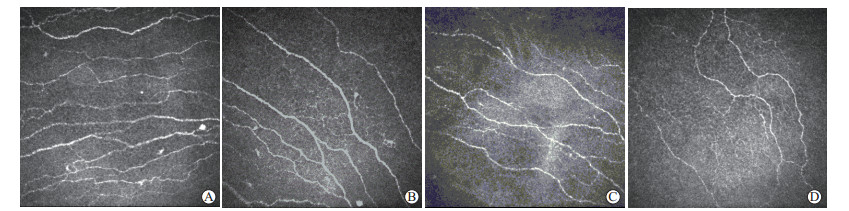
|
图 1 健康对照组及T2DM DR患者的角膜神经纤维图像 Fig 1 Images of the corneal nerve fiber in healthy controls and T2DM DR patients With the severity increase of DR, the length and density of the corneal nerve fiber decreased. A: Healthy group; B: NDR; C: NPDR; D: PDR. T2DM: Type 2 diabetes mellitus; DR: Diabetic retinopathy; NDR: No diabetic retinopathy; NPDR: Non-proliferative diabetic retinopathy; PDR: Proliferative diabetic retinopathy |
|
|
表 1 健康对照组及T2DM DR患者角膜神经纤维参数比较 Tab 1 Comparison of corneal nerve fiber parameters in healthy controls and T2DM DR patients |
2.3 各组角膜神经纤维参数CNFD比较
与健康对照组比较,病例组中NDR、NPDR和PDR患者CNFD均降低(P均<0.01);病例组中,随DR病情进展,CNFD逐步降低(P均<0.01)。见表 1。
2.4 各组角膜神经纤维参数CNBD比较与健康对照组比较,病例组中NDR、NPDR和PDR患者CNBD均降低(P均<0.01);与NDR患者比较,PDR患者CNBD降低(P<0.01);与NPDR患者比较,PDR患者CNBD降低(P<0.05);NDR患者与NPDR患者CNBD差异无统计学意义(P>0.05)。见表 1。
2.5 角膜神经纤维参数与年龄和DR严重程度的相关分析Spearman相关分析结果显示,角膜神经纤维参数CNFL、CNFD、CNBD与年龄均无关(P均>0.05),而与DR严重程度均呈负相关(P均<0.01)。见表 2。
|
|
表 2 角膜神经纤维参数与年龄及DR严重程度的相关分析 Tab 2 Correlation between corneal nerve parameters with age and DR severity |
3 讨论
糖尿病是一种发病率高且严重危害人类健康的慢性代谢性疾病。据统计,超过50%的糖尿病患者存在并发症,且随病程的延长并发症发生率呈明显上升趋势[10]。糖尿病可导致一系列眼部并发症,糖尿病角膜病变是其常见的并发症之一。既往的临床研究主要集中于DR等方面,随着对糖尿病及其眼部并发症认识的深入、CCM的运用、眼科手术的发展及人们对生活质量要求的提高,糖尿病角膜病变也引起广大眼科医师及糖尿病患者的重视。
角膜是人体神经支配密度最高的组织,每平方毫米约有7 000个伤害感受器,一旦损伤可导致角膜敏感性下降及触觉阈值上升[11],从而造成泪液分泌减少及泪液蒸发过快,引起点状角膜炎、角膜溃疡延迟愈合、干眼等一系列眼部并发症。糖尿病患者有泪液分泌量减少、泪膜稳定性下降、角膜荧光素染色阳性率增加等临床表现[7]。Dogru等[12]和Wang等[13]研究发现,T2DM大鼠的角膜敏感性较正常对照组大鼠下降。近年来,随着CCM在眼科临床工作中的广泛应用,观察角膜各层微观形态的改变已成为眼科医师临床诊断角膜疾病不可或缺的手段之一,但目前国内外仍缺乏对于糖尿病角膜神经病变及其与DR严重程度相关性的研究。本研究旨在探讨T2DM患者角膜神经病变及其与DR的相关性,如果两者存在相关性,当患者无法行FFA检查或因屈光间质不清等原因窥不清眼底时,眼科医师可依据患者的角膜神经纤维参数与DR的相关性,为其DR的诊断及治疗提供帮助。
本研究结果显示,在T2DM患者中,NDR患者的角膜神经纤维参数CNFL、CNFD、CNBD均较健康对照组下降。Petropoulos等[14]在1型糖尿病患者中也得出相同结果。Dogru等[12]和Wang等[13]对T2DM大鼠的研究结果显示,T2DM大鼠的角膜神经纤维变细且其分支较正常对照组减少。本研究发现T2DM患者角膜神经病变的出现早于DR。同时,随着DR病情的进展患者CNFL、CNFD均进一步下降,与Bitirgen等[15]的研究结果相同。本研究结果提示T2DM患者糖尿病角膜神经病变与DR的严重程度呈负相关。在临床上,当患者无法行FFA检查时,角膜神经纤维参数可作为指导DR治疗的参考指标,以便及时治疗以阻止DR的进展。对于角膜神经纤维参数CBND,本研究结果显示CBND在NDR患者与NPDR患者间差异无统计学意义,在NPDR患者与PDR患者间差异有统计学意义;但Bitirgen等[15]的研究结果与此相反,显示CBND在NDR患者与NPDR患者间差异有统计学意义,在NPDR患者与PDR患者间差异无统计学意义。分析原因,我们认为可能由于量化方法的不同所致。目前海德堡HRT-3激光共聚焦显微镜无自带量化角膜神经的软件,Bitirgen等[15]使用CCMetrics全自动图像追踪软件对图像进行分析量化,本研究采用的是NeuronJ半自动图像追踪系统,NeuronJ软件的优点在于可自动与手动结合对图像进行追踪,避免在图像量化过程中产生遗漏和误差。
目前,糖尿病角膜神经病变的发病机制尚不清楚,研究认为可能与长期严重的高血糖导致的代谢障碍、微循环障碍和自身免疫功能紊乱有关[16]。临床工作中,眼科医师除了重视DR的诊断及治疗外,还应加强对糖尿病角膜神经病变的检查,以便早期发现由糖尿病角膜神经病变引起的眼部并发症,有效预防及控制其发生、发展。视网膜激光光凝术及眼底手术治疗均可对角膜造成损害[17],因此在对糖尿病患者进行眼部手术及激光治疗时,眼科医师应充分考虑到这些治疗方法对其眼表功能的损害,综合设计治疗方案以达到最优化的治疗效果,尽可能减少糖尿病患者因角膜神经损害引起的一系列眼部不适。
综上所述,本研究应用CCM观察发现,在T2DM患者尚未发生DR时可能已存在糖尿病角膜神经的损害,并且糖尿病角膜神经病变与DR的严重程度呈负相关。本研究还存在一些不足。首先,本研究的样本量偏小,可能导致研究结果存在一定偏倚;其次,目前国内外对量化角膜神经纤维仍缺乏统一标准,通过量化标准及测量方法的统一可以达到减少误差的效果,但这一问题仍待进一步解决。
| [1] |
CHAWLA A, CHAWLA R, JAGGI S. Microvasular and macrovascular complications in diabetes mellitus:distinct or continuum?[J]. Indian J Endocrinol Metab, 2016, 20: 546-551. DOI:10.4103/2230-8210.183480 |
| [2] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J]. 中国实用内科杂志, 2018, 38: 292-344. |
| [3] |
JIA W, WENG J, ZHU D, JI L, LU J, ZHOU Z, et al; Chinese Diabetes Society. Standards of medical care for type 2 diabetes in China 2019[J/OL]. Diabetes Metab Res Rev, 2019, 35: e3158. doi: 10.1002/dmrr.3158.
|
| [4] |
BARILE S, VAN CAUWENBERGE F, RAKIC J M. La rétinopathie diabétique[diabetic retinopathy][J]. Rev Med Liege, 2005, 60(5/6): 487-489.
|
| [5] |
刘青, 艾明. 光学相干断层扫描血管成像(OCTA)和荧光素血管造影(FFA)对比观察增生型糖尿病视网膜病变(PDR)[J]. 眼科新进展, 2017, 37: 52-55. |
| [6] |
SCHULTZ R O, VAN HORN D L, PETERS M A, KLEWIN K M, SCHUTTEN W H. Diabetic keratopathy[J]. Trans Am Ophthalmol Soc, 1981, 79: 180-199. |
| [7] |
刘芳.2型糖尿病眼表损害的临床特点[D].长春: 吉林大学, 2016.
|
| [8] |
WILKINSON C P, FERRIS F L 3rd, KLEIN R E, LEE P P, AGARDH C D, DAVIS M, et al; Global Diabetic Retinopathy Project Group. Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales[J]. Ophthalmology, 2003, 110: 1677-1682.
|
| [9] |
DELL'OMO R, CIFARIELLO F, DE TURRIS S, ROMANO V, DI RENZO F, DI TARANTO D. Confocal microscopy of corneal nerve plexus as an early marker of eye involvement in patients with type 2 diabetes[J]. Diabetes Res Clin Pract, 2018, 142: 393-400. DOI:10.1016/j.diabres.2018.06.010 |
| [10] |
LIU F, BAO Y, HU R, ZHANG X, LI H, ZHU D, et al. Screening and prevalence of peripheral neuropathy in type 2 diabetic outpatients:a randomized multicentre survey in 12 city hospitals of China[J]. Diabetes Metab Res Rev, 2010, 26: 481-489. DOI:10.1002/dmrr.1107 |
| [11] |
TAVAKOLI M, PETROPOULOS I N, MALIK R A. Assessing corneal nerve structure and function in diabetic neuropathy[J]. Clin Exp Optom, 2012, 95: 338-347. DOI:10.1111/j.1444-0938.2012.00743.x |
| [12] |
DOGRU M, KATAKAMI C, INOUE M. Tear function and ocular surface changes in noninsulin-dependent diabetes mellitus[J]. Ophthalmology, 2001, 108: 586-592. DOI:10.1016/S0161-6420(00)00599-6 |
| [13] |
WANG F, GAO N, YIN J, YU F S. Reduced innervation and delayed re-innervation after epithelial wounding in type 2 diabetic Goto-Kakizaki rats[J]. Am J Pathol, 2012, 181: 2058-2066. DOI:10.1016/j.ajpath.2012.08.029 |
| [14] |
PETROPOULOS I N, GREEN P, CHAN A W, ALAM U, FADAVI H, MARSHALL A. Corneal confocal microscopy detects neuropathy in patients with type 1 diabetes without retinopathy or microalbuminuria[J/OL]. PLoS One, 2015, 10: e0123517. doi: 10.1371/journal.pone.0123517.
|
| [15] |
BITIRGEN G, OZKAGNICI A, MALIK R A, KERIMOGLU H. Corneal nerve fibre damage precedes diabetic retinopathy in patients with type 2 diabetes mellitus[J]. Diabet Med, 2014, 31: 431-438. DOI:10.1111/dme.12324 |
| [16] |
NATHAN D M. Long-term complications of diabetes mellitus[J]. N Engl J Med, 1993, 328: 1676-1685. DOI:10.1056/NEJM199306103282306 |
| [17] |
刘瑞, 李冰, 盛敏杰. 活体共聚焦显微镜在干燥综合征眼表形态观察中的应用[J]. 国际眼科杂志, 2016, 16: 2213-2216. DOI:10.3980/j.issn.1672-5123.2016.12.10 |
 2020, Vol. 41
2020, Vol. 41


