2. 上海曜欣门诊部, 上海 200023
2. Yaoxin Outpatient Department, Shanghai 200023, China
胸腺瘤由胸腺上皮分化而来,临床上少见,发病率为1.5/100 000[1-2],但它是前纵隔常见的原发肿瘤。尽管胸腺瘤的侵袭性较低,5年生存率约为90%[3],但仍会发生局部播散,转移灶常常局限在胸膜、膈肌、心包等胸腔结构内,胸腔以外的转移少见[4]。胸腺瘤病理组织学分型分为A型(髓质型或梭型细胞胸腺瘤)、AB型(混合型胸腺瘤)、B1型(富含淋巴细胞的胸腺瘤、淋巴细胞型胸腺瘤、皮质为主型胸腺瘤或类器官胸腺瘤)、B2型(皮质型胸腺瘤)、B3型(上皮型、非典型、类鳞状上皮胸腺瘤或分化好的胸腺癌)及C型(胸腺癌),临床分期目前应用最广的是Masaoka分期(Ⅰ~Ⅳ期)[5]。手术切除是胸腺瘤的主要治疗手段,但即使完全切除局部复发率仍达10%~30%[6-7]。放射治疗被广泛应用于胸腺瘤的治疗中。胸腺瘤对放射治疗较为敏感,但是因多次复发反复外照射的患者可能会发生较严重的放射性肺炎[7]。放射性125I密封籽源(放射性粒子)瘤内植入是一种近距离放射治疗手段,对周围正常组织的损伤较小,其疗效在前列腺肿瘤中已得到验证[8]。本研究回顾性分析在复旦大学附属华东医院接受放射性125I密封籽源瘤内植入治疗的42例局部复发胸腺瘤患者资料,探讨125I密封籽源植入治疗局部复发胸腺瘤的近期疗效及安全性。
1 资料和方法 1.1 研究对象收集2015年1月至2018年12月复旦大学附属华东医院肿瘤微创治疗部收治的局部复发胸腺瘤患者资料,要求具备完整的临床资料和随访信息。纳入标准:(1)胸部CT等影像学证据确认有可测量的局部复发病灶;(2)病理证实为胸腺瘤;(3)根据美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)制定的体能状态评分标准[9]得分为0分或1分;(4)凝血功能正常;(5)患者自愿接受125I密封籽源植入治疗、心肺功能等一般情况耐受治疗。排除标准:(1)临床预计生存时间<3个月;(2)临床信息不完整或随访数据不完整;(3)同时患有其他恶性肿瘤或严重潜在疾病,如心血管疾病等;(4)精神障碍等不能配合治疗者。
1.2 仪器及设备125I密封籽源由上海欣科医药有限公司提供,外形为圆柱形钛合金封装体,长度为4.5 mm,直径为0.8 mm,平均光子能量为27~35 keV,组织穿透距离为1.7 cm,初始剂量率为7 cGy/h,半衰期为59.6 d。粒子植入器为Mick枪(美国Radio-nuclear公司)。影像引导设备使用64排螺旋CT扫描仪(德国西门子公司)、MyLabTwice超声仪(深圳百胜医疗科技有限公司)及放射性粒子治疗计划系统(treatment planning system,TPS;北京启麟科技有限公司)。
1.3 治疗方法术前完善血常规、凝血功能、心肺功能等常规检查,并进行胸部CT扫描,使用TPS制定放射性粒子植入计划。125I密封籽源计划处方剂量一般为120~130 Gy,参考点选择在靶区周边外扩0.5 cm处,定义90%等剂量曲线为参考点剂量,目标为使90%靶区接受90%处方剂量,用剂量体积直方图评估合格后实施。
患者根据需要固定体位,常规消毒、铺巾,局部麻醉后,采用18 G穿刺针穿刺。遵循巴黎原则[10],尽量采用针间距1 cm的平行排列方式进针,若进针路径可能穿刺到重要的器官、血管和神经,则采用交叉布针的方法以降低重要部位的穿刺风险。逐层后退式植入粒子,粒子间距为1 cm。植入后再行CT扫描,将粒子分布等相关数据导入TPS,进行剂量验证,如出现靶区冷点则需要进行补植。本研究采用的粒子中位粒子活度为1.5×107 Bq,范围为(1.1~1.9)×107 Bq;中位粒子数为40粒,范围为15~80粒。患者术后平卧6 h,予以止血等一般支持治疗,监测血压。
1.4 疗效评价方法 1.4.1 影像学评估治疗前及治疗后2、4、6个月通过胸部CT扫描观察肿瘤变化。肿瘤体积按照公式V=(π/6)×A×B×C计算,式中V为肿瘤体积,A、B、C分别为肿瘤横断面、冠状面和矢状面的3条最大径[11]。以胸部CT测量数据为依据,采用2009年实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1版[12]进行评估。完全缓解(complete response,CR):所有目标病灶消失;部分缓解(partial response,PR):基线病灶长径总和缩小≥30%;疾病进展(progressive disease,PD):基线病灶长径总和增加≥20%或出现新病灶;疾病稳定(stable disease,SD):基线病灶长径总和缩小但未达PR或增加但未达PD。客观缓解率(%)=(CR例数+PR例数)/总病例数×100%。
1.4.2 局部疼痛症状评估治疗前及治疗后2、4、6个月时采用疼痛数字评价量表(numerical rating scale,NRS)[13]评估局部疼痛症状,记录治疗前后NRS评分并进行对比。疼痛缓解度定义为治疗前后NRS差值与治疗前评分的比值(以百分数表示)[14],疼痛缓解度<25%为无缓解(0度),25%~49%为轻微缓解(Ⅰ度),50%~74%为中度缓解(Ⅱ度),75%~99%为明显缓解(Ⅲ度),100%为完全缓解(Ⅳ度)。患者达到中度缓解或以上(Ⅱ度及以上)的比例被定义为疼痛缓解率。
1.5 不良反应不良反应包括手术并发症及术后放射损伤,手术并发症包括胸腔内持续性出血、感染,放射损伤以美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)急性放射损伤分级标准和晚期放射损伤分级标准[15]进行评价。
1.6 统计学处理采用SPSS 13.0软件进行统计学分析。对患者肿瘤体积和NRS评分进行正态性检验,符合正态分布的数据以x±s表示,治疗前后的差异采用配对样本t检验进行分析;非正态分布的数据以中位数(范围)表示,治疗前后的差异采用Wilcoxon符号秩检验进行分析。检验水准(α)为0.05。
2 结果 2.1 患者基线特征共纳入符合条件的患者42例,其中男23例,女19例;年龄为35~61岁,中位年龄为44岁;ECOG体能状态评分0分18例,1分24例;肿瘤最大径2.5~5.6 cm,平均(3.76±1.24)cm。所有患者均为手术后局部复发,经手术或穿刺病理证实为胸腺瘤,其中B2型14例,B3型26例,B2、B3混合型2例。24例患者具有局部疼痛症状,其中NRS评分1~3分者6例,4~6分者16例,7~9分者2例。所有患者均行125I密封籽源植入治疗,均随访半年以上。
2.2 治疗后肿瘤影像学变化治疗前后的典型CT图像见图 1。42例患者治疗前肿瘤体积为(37.2±8.4)cm3,其中最大者达96.2 cm3;治疗后2、4、6个月患者肿瘤体积分别缩小至(18.6±4.2)、(15.3±4.0)、(14.9±3.7)cm3,与治疗前相比差异均有统计学意义(P均<0.05)。治疗后2个月,随访结果显示CR 9例、PR 30例、SD 3例、PD 0例,客观缓解率(CR+PR)为92.9%(39/42);治疗后6个月(放射性粒子经过约3个半衰期),随访结果显示CR 13例、PR 27例、SD 2例、PD 0例,客观缓解率为95.2%(40/42)。其中有2例目标病灶CR患者及3例目标病灶PR患者,在后续随访过程中出现新发胸膜转移病灶,后期再次行粒子植入治疗。
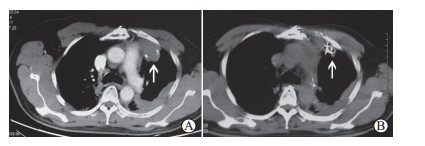
|
图 1 局部复发胸腺瘤125I密封籽源植入治疗前和治疗后6个月时CT图像 A:治疗前,CT检查显示前纵隔低密度病灶(箭头所示);B:治疗后6个月,CT检查显示原病灶区肿瘤体积明显缩小,125I粒子在肿瘤组织内无移位(箭头所示). CT:计算机断层扫描 |
2.3 治疗后疼痛状态变化
治疗前共24例患者有局部疼痛症状,中位NRS评分为4(1~9)分,治疗后2、4、6个月时中位NRS评分分别下降至1(0~6)、1(0~5)、1(0~5)分,与治疗前相比差异均有统计学意义(P均<0.05)。按照NRS疼痛缓解标准,24例伴有疼痛的患者治疗6个月后3例获得Ⅰ度缓解、6例获得Ⅱ度缓解、8例获得Ⅲ度缓解、7例获得Ⅳ度缓解,疼痛缓解率(Ⅱ度及以上缓解)为87.5%(21/24)。
2.4 不良反应情况2例患者术后出现低热,体温最高约38 ℃,经对症治疗后症状缓解;1例患者术中出现少量气胸,肺组织压缩量约25%,经吸氧等保守治疗后好转;无胸腔内出血等明显粒子植入相关并发症。未见明显粒子移位。根据RTOG急性放射损伤分级标准,2例患者发生局部皮肤1级放射损伤,经对症处理后好转,无其他急性放射损伤和晚期放射损伤。
3 讨论手术切除是胸腺瘤最主要的治疗方式,所有潜在可切除的肿瘤都应争取通过手术彻底切除。从临床分期来看,Ⅰ期患者手术切除率为100%,局部复发比较少见,仅为3%;Ⅱ期患者当胸腺肿瘤突破包膜及侵犯纵隔脂肪组织时,局部复发率达11%;Ⅲ期患者切除后复发率更是高达30%[16]。从病理组织学分型来看,B2、B3型复发率高,术后复发和转移与手术切除的完整性密切相关[3]。胸腺瘤的复发以局部复发为主,大多数复发位置位于胸腔内,最常见的复发部位为胸膜[7]。大部分复发患者由于肿瘤位置复杂,或由于自身身体状况等原因,无法再次行手术治疗。因此放射治疗在局部复发胸腺瘤的治疗中占有重要地位。
胸腺瘤是中度放射敏感性肿瘤,放射治疗可提高局部复发患者的局部控制率和总生存率[17]。但是胸腺的位置靠近心脏和肺这两个重要器官,常规放射治疗技术引起的不良反应限制了其在胸腺瘤治疗中的应用。大于30 Gy的放射治疗剂量可能会增加如放射性肺炎、放射性心包炎等不良反应的发生,尤其是对于反复复发的胸腺瘤患者,多次放射治疗导致局部剂量的累积,会造成严重的放射性肺炎等后遗症,影响患者的生存质量,部分患者无法耐受新的复发部位再次接受放射治疗[18-19]。近年来近距离放射治疗逐渐受到重视,125I密封籽源能持续释放低剂量γ射线直接作用于DNA双链,使DNA断裂;并且可使机体内水分子电离,产生自由基,自由基与生物大分子相互作用引起组织细胞损伤。由于粒子放射活度小,局部照射可以增加肿瘤与正常组织的剂量配比,使肿瘤受到较高的辐照剂量,而肿瘤之外的正常组织辐射剂量锐减,从而减少了周围正常组织的损伤[20]。
本研究结果显示,放射性125I密封籽源植入治疗局部复发胸腺瘤后取得较好的近期临床疗效,植入后2个月后客观缓解率高达92.9%(39/42),术后局部疼痛症状也得到很好的缓解。本研究中所有患者均在局部麻醉下进行治疗,不良反应较轻,累计有2例低热、1例气胸、2例局部皮肤1级放射性损伤,其余未出现明显不良反应。说明125I密封籽源植入治疗局部复发胸腺瘤安全、可靠,不良反应可控。回顾本研究中治疗后6个月仍然为SD的2例患者,因肿瘤比较接近心脏并伴随心脏的搏动而移动,考虑到穿刺风险比较大,实际植入的粒子分布相对TPS计划有所欠缺,无法做到均匀分布,经过补种后仍有盲区,因而肿瘤消退不明显。相对而言,肿瘤比较浅表的患者由于穿刺风险较小,可以严格按照TPS计划做到植入粒子的均匀分布,取得较好的近期临床效果。上述结果提示125I密封籽源植入技术的临床效果与粒子分布相关,这就要临床医师尽可能按照TPS计划布针,使得肿瘤得到均匀的照射,避免局部剂量过高或过低,以取得较好的临床效果,并将风险降到最低。此外,本研究中5例患者虽然经过治疗后局部控制良好,但随访发现有新发病灶,故仍需要定期随访,尽可能早期发现新发复发灶并进行针对性处理,以免贻误治疗时机。
综上所述,放射性125I密封籽源瘤内植入治疗局部复发胸腺瘤近期临床疗效明确,不良反应少,安全性高,且易于开展,为临床上一些不能实施传统治疗的局部复发胸腺瘤患者提供了新的治疗手段。
| [1] |
ENGELS E A. Epidemiology of thymoma and associated malignancies[J]. J Thorac Oncol, 2010, 5(10 Suppl 4): S260-S265. |
| [2] |
ZHANG X, GU Z, FANG W, Members of the Chinese Alliance for Research in Thymomas. Minimally invasive surgery in thymic malignances:the new standard of care[J]. J Thorac Dis, 2018, 10(Suppl 14): S1666-S1670. |
| [3] |
ZHAO Y, SHI J, FAN L, HU D, YANG J, ZHAO H. Surgical treatment of thymoma:an 11-year experience with 761 patients[J]. Eur J Cardiothorac Surg, 2016, 49: 1144-1149. DOI:10.1093/ejcts/ezv288 |
| [4] |
KONDO K. Therapy for thymic epithelial tumors[J]. Gen Thorac Cardiovasc Surg, 2014, 62: 468-474. DOI:10.1007/s11748-014-0420-z |
| [5] |
DETTERBECK F C, NICHOLSON A G, KONDO K, VAN SCHIL P, MORAN C. The Masaoka-Koga stage classification for thymic malignancies:clarification and definition of terms[J]. J Thorac Oncol, 2011, 6(7 Suppl 3): S1710-S1716. |
| [6] |
YUAN Z Y, GAO S G, MU J W, XUE Q, MAO Y S, WANG D L, et al. Long-term outcomes of 307 patients after complete thymoma resection[J/OL]. Chin J Cancer, 2017, 36: 46. doi: 10.1186/s40880-017-0213-8.
|
| [7] |
RIMNER A, GOMEZ D R, WU A J, SHI W, YORKE E D, MOREIRA A L, et al. Failure patterns relative to radiation treatment fields for stage Ⅱ-Ⅳ thymoma[J]. J Thorac Oncol, 2014, 9: 403-409. DOI:10.1097/JTO.0000000000000099 |
| [8] |
MAKI S, ITOH Y, KUBOTA S, OKADA T, NAKAHARA R, ITO J, et al. Clinical outcomes of 125I brachytherapy with and without external-beam radiation therapy for localized prostate cancer:results from 300 patients at a single institution in Japan[J]. J Radiat Res, 2017, 58: 870-880. DOI:10.1093/jrr/rrx051 |
| [9] |
体能状态评分ECOG评分法[J/CD].中华普通外科学文献(电子版), 2012, 6: 556.
|
| [10] |
LEUNG S. Perineal template techniques for interstitial implantation of gynecological cancers using the Paris system of dosimetry[J]. Int J Radiat Oncol Biol Phys, 1990, 19: 769-774. DOI:10.1016/0360-3016(90)90508-H |
| [11] |
SMITH J A, WILD A T, SINGHI A, RAMAN S P, QIU H, KUMAR R, et al. Clinicopathologic comparison of high-dose-rate endorectal brachytherapy versus conventional chemoradiotherapy in the neoadjuvant setting for resectable stages Ⅱ and Ⅲ low rectal cancer[J/OL]. Int J Surg Oncol, 2012, 2012: 406568. doi: 10.1155/2012/406568.
|
| [12] |
EISENHAUER E A, THERASSE P, BOGAERTS J, SCHWARTZ L H, SARGENT D, FORD R, et al. New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45: 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [13] |
HJERMSTAD M J, FAYERS P M, HAUGEN D F, CARACENI A, HANKS G W, LOGE J H, et al. Studies comparing numerical rating scales, verbal rating scales, and visual analogue scales for assessment of pain intensity in adults:a systematic literature review[J]. J Pain Symptom Manage, 2011, 41: 1073-1093. DOI:10.1016/j.jpainsymman.2010.08.016 |
| [14] |
吉爱军, 施如春, 俞晨, 李苏平. 门诊癌性疼痛患者强阿片类药物应用的疗效分析[J]. 中国肿瘤外科杂志, 2018, 10: 174-177. |
| [15] |
殷蔚伯, 谷铣之. 肿瘤放射治疗学[M]. 3版. 北京: 中国协和医科大学出版社, 2002: 1108-1111.
|
| [16] |
DETTERBECK F C. Evaluation and treatment of stage Ⅰ and Ⅱ thymoma[J]. J Thorac Oncol, 2010, 5(10 Suppl 4): S318-S322. |
| [17] |
LOMBE D C, JEREMIC B. A review of the place and role of radiotherapy in thymoma[J]. Clin Lung Cancer, 2015, 16: 406-412. DOI:10.1016/j.cllc.2015.05.003 |
| [18] |
MOU H, LIAO Q, HOU X, CHEN T, ZHU Y. Clinical characteristics, risk factors, and outcomes after adjuvant radiotherapy for patients with thymoma in the United States:analysis of the surveillance, epidemiology, and end results (SEER) registry (1988-2013)[J]. Int J Radiat Biol, 2018, 94: 495-502. DOI:10.1080/09553002.2018.1454618 |
| [19] |
JACKSON M W, PALMA D A, CAMIDGE D R, JONES B L, ROBIN T P, SHER D J, et al. The impact of postoperative radiotherapy for thymoma and thymic carcinoma[J]. J Thorac Oncol, 2017, 12: 734-744. DOI:10.1016/j.jtho.2017.01.002 |
| [20] |
TANDERUP K, MÉNARD C, POLGAR C, LINDEGAARD J C, KIRISITS C, PÖTTER R. Advancements in brachytherapy[J]. Adv Drug Deliv Rev, 2017, 109: 15-25. DOI:10.1016/j.addr.2016.09.002 |
 2020, Vol. 41
2020, Vol. 41


