2. 海军军医大学(第二军医大学)东方肝胆外科医院肝外一科, 上海 200438
2. Department of Hepatic Surgery(Ⅰ), Eastern Hepatobiliary Surgery Hospital, Naval Medical University(Second Military Medical University), Shanghai 200438, China
腺苷是三磷酸腺苷(adenosine triphosphate,ATP)的核心构成分子,与多种能量代谢过程密切相关,如葡萄糖稳态及脂肪分解等[1]。腺苷激酶(adenosine kinase,ADK)是一种磷酸转移酶,其功能是将腺苷进行磷酸化修饰生成一磷酸腺苷(adenosine monophosphate,AMP)[2],在腺苷系统的调节中起着核心作用。ADK是细胞内清除腺苷的主要途径之一,抑制ADK可提高细胞内腺苷水平并增强腺苷的生物学作用[3]。ADK在哺乳动物肝脏、肾脏等多个器官表达[4]。目前,ADK及腺苷代谢通路已被证实在多种肿瘤生长、心血管功能调节及炎症反应中扮演了重要角色[5]。然而,ADK在高脂饮食诱导的糖耐量异常与肝脏脂肪变性过程中的作用尚未见报道。
甲状腺素结合球蛋白(thyroxine-binding globulin,TBG)是哺乳动物体内成熟肝细胞的特异性标记蛋白[6]。研究证实,携带TBG启动子和内含子的腺相关病毒可启动下游基因在成熟肝细胞中特异性表达[7]。本研究在高脂饮食诱导的小鼠糖耐量异常与非酒精性脂肪肝模型中,利用腺相关病毒特异性上调肝细胞ADK表达,观察ADK表达对高脂饮食相关的糖耐量异常与非酒精性脂肪肝的影响。
1 材料和方法 1.1 实验动物、病毒与试剂12周龄雄性健康C57BL/6J小鼠购自北京维通利华公司[动物生产许可证号:SCXK(京)2019-0009],饲喂于SPF级洁净动物房。普通及高脂饲料均购自美国Research Diet公司。利用携带TBG启动子的腺相关病毒载体pENN-AAV8-TBG-RBG构建特异性上调肝细胞ADK表达的腺相关病毒,腺相关病毒的包装与纯化均委托汉恒生物科技(上海)有限公司完成。H-E染液与油红O染液购自美国Sigma-Aldrich公司。TRIzol试剂购自美国Invitrogen公司。反转录PCR试剂盒与SyBR Green PCR试剂盒购自北京康为世纪生物科技有限公司。ADK兔多克隆抗体与β-actin兔单克隆抗体购自美国Cell Signaling Technology公司。三酰甘油定量检测试剂盒购自英国Abcam公司。
1.2 腺相关病毒注射与高脂饮食模型构建将20只小鼠随机分为AAV8-TBG组与AAV8-TBG-ADK组(每组10只),分别通过尾静脉注射AAV8-TBG或AAV8-TBG-ADK病毒,剂量为2×1011 vg/只(vg为viral genome)。经尾静脉注射病毒3 d后,将每组小鼠再分别随机分为2个亚组(每组5只),分别接受普通饮食或60%热量来自于脂肪的高脂饮食,饲喂8周。
1.3 葡萄糖耐量试验小鼠禁食12 h后称体质量,并按照1.5 g/kg的剂量腹腔注射质量分数为50%的葡萄糖溶液。分别于注射后0、30、60、90和120 min剪尾取血,使用OneTouch Ⅱ血糖仪检测血糖水平。
1.4 蛋白质印迹分析处死小鼠,取肝组织。将肝组织裂解后经BCA法进行蛋白定量。将蛋白样本行SDS-PAGE,采用电转膜法将蛋白转移至NC膜上。采用5%脱脂牛奶封闭1 h后,分别加入ADK和β-actin一抗4 ℃孵育过夜,之后加入二抗室温孵育1 h。经显影后定量分析蛋白条带光密度值。
1.5 qRT-PCR将液氮冷冻的小鼠肝组织研磨后用TRIzol试剂提取组织总RNA,使用反转录PCR试剂盒合成cDNA。采用SyBR Green PCR试剂盒检测样本中糖异生相关基因葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6P)、磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK),以及脂肪酸合成相关基因胆固醇调节元件结合蛋白1(sterol-regulatory element binding protein-1,SREBP-1)、乙酰辅酶A羧化酶1(acetyl-CoA carboxylase-1,ACC-1)、脂肪酸合成酶(fatty acid synthase,FAS)与硬脂酰辅酶A脱氢酶1(stearoyl-CoA desaturase-1,SCD-1)的mRNA表达水平。以β-actin为内参,计算目的基因的相对表达水平。引物均由TaKaRa公司合成,具体序列见表 1。
|
|
表 1 qRT-PCR检测使用的引物序列 Tab 1 Primer sequences for qRT-PCR |
1.6 肝脏组织学检查及三酰甘油测定
肝组织经4%多聚甲醛溶液固定过夜,石蜡包埋,用切片机切为3 μm厚的切片,贴附于载玻片上,使用H-E染色法进行染色。肝组织经冰冻切片机切片并贴附于载玻片上,使用油红O染色法进行染色。染色后在光学显微镜下观察肝脏的组织形态和肝组织的脂滴沉积情况。使用三酰甘油定量检测试剂盒检测肝组织中三酰甘油的含量。
1.7 统计学处理利用GraphPad Prism 6软件进行统计学分析和绘图。所有实验数据均以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(两两比较采用Bonferroni检验)。检验水准(α)为0.05。
2 结果 2.1 AAV8-TBG-ADK特异性上调肝细胞ADK表达水平经尾静脉注射AAV8-TBG或AAV8-TBG-ADK腺相关病毒后,取小鼠肝组织,采用蛋白质印迹法和qRT-PCR检测ADK蛋白与mRNA表达水平。结果显示,肝组织ADK蛋白和mRNA表达水平均较AAV8-TBG组上调,差异有统计学意义(P<0.05,图 1)。
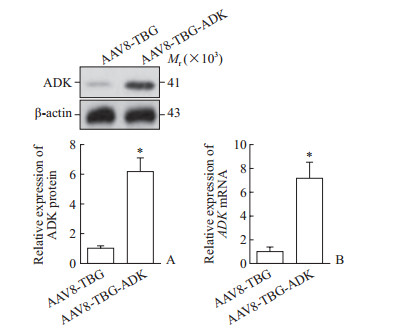
|
图 1 AAV8-TBG-ADK上调小鼠肝脏ADK表达 Fig 1 Hepatic overexpression of ADK mediated by AAV8-TBG-ADK in mice A: Hepatic ADK protein expression levels were determined by Western blotting; B: Hepatic ADK mRNA levels were determined by qRT-PCR. AAV: Adeno-associated virus; TBG: Thyroxine-binding globulin; ADK: Adenosine kinase. *P < 0.05 vs AAV8-TBG group. n=5, x±s |
2.2 特异性上调肝细胞ADK表达对小鼠葡萄糖耐量异常与体质量的影响
小鼠经尾静脉注射AAV8-TBG腺相关病毒后再以高脂饮食饲喂8周,葡萄糖耐量较饲喂普通饮食组出现明显异常(P<0.05,图 2A),体质量也明显增加(P<0.05,图 2B)。注射AAV8-TBG-ADK特异性上调ADK表达后再以高脂饮食饲喂的小鼠葡萄糖耐量较注射AAV8-TBG后再以高脂饮食饲喂的小鼠明显改善(P<0.05,图 2A),然而注射AAV8-TBG-ADK的小鼠与注射AAV8-TBG的小鼠经高脂饮食饲喂后体质量差异无统计学意义(P>0.05,图 2B)。上述结果提示ADK过表达不影响高脂饮食导致的小鼠体质量改变,但可改善高脂饮食诱导的小鼠葡萄糖耐量异常。
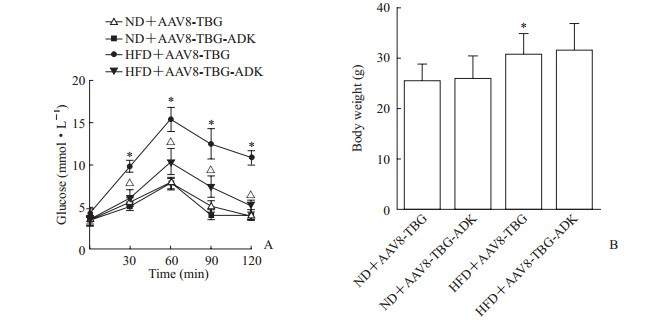
|
图 2 特异性上调肝细胞ADK表达对高脂饮食导致的小鼠葡萄糖耐量异常及体质量的影响 Fig 2 Effects of hepatocyte-specific ADK overexpression on high fat diet induced glucose intolerance and body weight in mice A: Glucose homeostasis was assessed by glucose tolerance test; B: Body weight. AAV: Adeno-associated virus; TBG: Thyroxine-binding globulin; ADK: Adenosine kinase; ND: Normal diet; HFD: High fat diet. *P < 0.05 vs ND+AAV8-TBG group; △P < 0.05 vs HFD+AAV8-TBG group. n=5, x±s |
2.3 特异性上调肝细胞ADK表达对高脂饮食诱导的小鼠非酒精性脂肪肝的影响
小鼠经尾静脉注射腺相关病毒后再以高脂饮食饲喂8周,H-E染色结果显示小鼠肝脏出现明显的脂质沉积(图 3A),油红O染色结果显示小鼠肝脏脂质含量明显增加(图 3B)。注射AAV8-TBG-ADK特异性上调ADK表达后,高脂饮食饲喂小鼠的肝脏脂滴较AAV8-TBG组明显减少(图 3A、3B)。肝脏三酰甘油定量检测发现,AAV8-TBG-ADK上调ADK表达后可减少高脂饮食导致的肝脏三酰甘油沉积(图 3C)。上述结果提示ADK过表达可减轻高脂饮食诱导的小鼠肝脏脂肪变性。
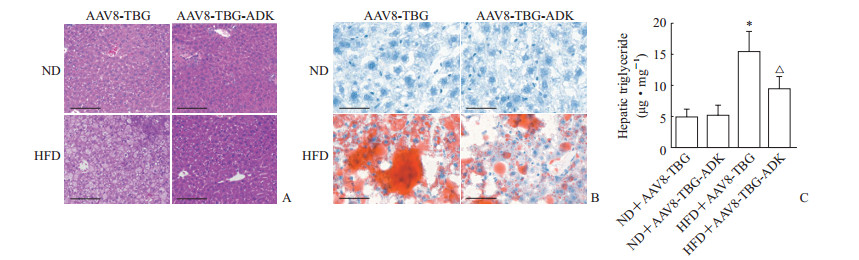
|
图 3 特异性上调肝细胞ADK表达对高脂饮食导致的小鼠非酒精性脂肪肝的影响 Fig 3 Effects of hepatocyte-specific ADK overexpression on high fat diet induced non-alcoholic fatty liver in mice A: Representative images of Hematoxylin-Eosin (H-E) staining; B: Representative images of oil red O staining; C: Hepatic triglyceride content was quantified by the commercial kit. ADK: Adenosine kinase; ND: Normal diet; HFD: High fat diet; AAV: Adeno-associated virus; TBG: Thyroxine-binding globulin. Scale bar=100 μm (A, B). *P < 0.05 vs ND+AAV8-TBG group; △P < 0.05 vs HFD+AAV8-TBG group. n=5, x±s |
2.4 特异性上调肝细胞ADK表达对小鼠肝脏糖异生与脂肪酸合成相关基因表达的影响
qRT-PCR结果显示,高脂饮食上调了小鼠肝脏糖异生关键酶G6P与PEPCK的mRNA表达水平(P<0.05,图 4A),也上调了脂肪酸合成的关键基因SREBP-1、ACC-1、FAS与SCD-1的mRNA表达水平(P<0.05,图 4B)。利用AAV8-TBG-ADK上调ADK表达后可降低高脂饮食导致的肝脏糖异生与脂肪酸合成关键基因的表达水平(图 4A、4B,P<0.05)。上述结果提示ADK过表达改善高脂饮食诱导的葡萄糖耐量异常与肝脏脂肪变性可能是通过抑制肝脏糖异生和脂肪酸合成实现的。
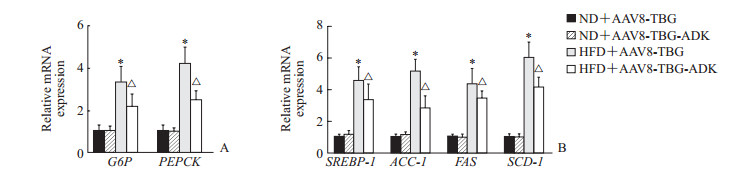
|
图 4 特异性上调肝细胞ADK表达对小鼠肝脏糖异生与脂肪酸合成相关基因表达的影响 Fig 4 Effects of hepatocyte-specific ADK overexpression on mRNA expression levels of gluconeogenesis and fatty acid synthesis-related genes in mice A: The mRNA levels of gluconeogenesis related genes (G6P and PEPCK) in liver tissues were analyzed by qRT-PCR; B: The mRNA levels of fatty acid synthesis related genes (SREBP-1, ACC-1, FAS and SCD-1) in liver tissues were analyzed by qRT-PCR. ADK: Adenosine kinase; ND: Normal diet; HFD: High fat diet; AAV: Adeno-associated virus; TBG: Thyroxine-binding globulin; G6P: Glucose-6-phosphatase; PEPCK: Phosphoenolpyruvate carboxykinase; SREBP-1: Sterol-regulatory element binding protein-1; ACC-1: Acetyl-CoA carboxylase-1; FAS: Fatty acid synthase; SCD-1: Stearoyl-CoA desaturase-1. *P < 0.05 vs ND+AAV8-TBG group; △P < 0.05 vs HFD+AAV8-TBG group. n=5, x±s |
3 讨论
肥胖、胰岛素抵抗、葡萄糖耐量异常及非酒精性脂肪肝等代谢性疾病严重威胁着我国居民健康[8]。肝脏是机体调节营养物质代谢和能量稳态的中心器官,高脂饮食导致的肝脏糖异生与脂质新生异常增高是造成肥胖相关的葡萄糖耐量与肝脏脂肪变性的重要原因,有效抑制肝脏糖异生与脂质新生被认为是改善肥胖个体葡萄糖与脂肪酸代谢紊乱的新的治疗策略[9]。然而,肥胖情况下肝脏糖异生与脂质新生增强的分子机制尚未完全阐明。
ADK是一种受细胞内能量状态调节的代谢酶[10]。它在生物体内普遍存在并高度保守,其蛋白相对分子质量约为22 000~26 000[11]。ADK在调节蛋白磷酸化网络、心肌细胞能量代谢平衡、神经元分化与成熟、线粒体稳态及肿瘤发生与发展等多种生物学过程中扮演了极其重要的角色[12-15]。ADK在肝脏、骨骼肌等多种代谢性器官中高表达[16],可能在多种器官中发挥糖脂代谢调节作用,影响机体糖脂代谢的稳态。Boison等[17]发现ADK全身敲除小鼠在幼年时期表现为严重的自发性肝脏脂肪变性。Annes等[18]发现使用ADK特异性抑制剂抑制其活性可促进胰岛β细胞复制和胰岛素分泌。Flückiger-Isler和Walter[19]发现阻断ADK活性会刺激肝糖原的合成与释放。Zhang等[20]发现ADK敲除可以阻断巨噬细胞胆固醇外排而减轻高脂饮食导致的动脉粥样硬化。上述研究结果均提示ADK可能是一个重要的机体糖脂代谢调节分子。然而,ADK是否调节高脂饮食导致的葡萄糖耐量异常及非酒精性脂肪肝尚未见报道。本研究利用肝细胞特异性表达的腺相关病毒载体特异性地上调小鼠肝细胞中ADK表达水平,观察ADK过表达对高脂饮食诱导的肥胖小鼠葡萄糖耐量和肝脏脂肪变性的影响。研究结果表明,ADK过表达可减轻肥胖小鼠的葡萄糖耐量异常与肝脏脂肪变性等糖脂代谢紊乱,并且该作用独立于体质量的变化,这揭示了肝脏ADK在肥胖等代谢性疾病中发挥保护作用。
肝脏糖异生与脂质新生异常增高可导致葡萄糖耐量异常与肝脏脂肪变性[21]。本研究发现,肝脏ADK过表达可抑制高脂饮食诱导的肝脏糖异生关键酶G6P与PEPCK mRNA表达,也可抑制肝脏脂质新生关键酶SREBP-1、ACC-1、FAS和SCD-1 mRNA的表达。这些结果表明,肝脏ADK过表达减轻肥胖小鼠葡萄糖耐量异常与肝脏脂肪变性很可能是通过抑制肝脏糖异生与脂质新生过程而实现的。
综上所述,本研究发现小鼠肝脏过表达ADK可阻断肝脏糖异生与脂质新生关键酶表达,抑制高脂饮食导致的肝脏糖异生与脂质新生,减轻肥胖相关的葡萄糖耐量异常与肝脏脂肪变性。这些结果提示ADK在肥胖相关的葡萄糖耐量异常与肝脏脂肪变性过程中发挥保护性作用,可望成为防治肥胖相关糖脂代谢紊乱的新靶点。关于ADK过表达如何抑制肝细胞糖异生与脂质新生关键酶的表达、哪些转录因子或细胞内信号在这个过程发挥调节作用等问题,有待后续工作进一步阐明。
| [1] |
CAMICI M, GARCIA-GIL M, TOZZI M G. The inside story of adenosine[J/OL]. Int J Mol Sci, 2018, 19: 784. doi: 10.3390/ijms19030784.
|
| [2] |
赖秋安, 胡建军, 孙久荣. 腺苷酸激酶与细胞凋亡[J]. 生物化学与生物物理进展, 2001, 28: 444-446. DOI:10.3321/j.issn:1000-3282.2001.04.002 |
| [3] |
MILLER R L, ADAMCZYK D L, MILLER W H, KOSZALKA G W, RIDEOUT J L, BEACHAM L M 3rd, et al. Adenosine kinase from rabbit liver. Ⅱ. Substrate and inhibitor specificity[J]. J Biol Chem, 1979, 254: 2346-2352.
|
| [4] |
KAPLAN G B, COYLE T S. Adenosine kinase inhibitors attenuate opiate withdrawal via adenosine receptor activation[J]. Eur J Pharmacol, 1998, 362: 1-8. DOI:10.1016/S0014-2999(98)00724-9 |
| [5] |
KOWALUK E A, JARVIS M F. Therapeutic potential of adenosine kinase inhibitors[J]. Expert Opin Investig Drugs, 2000, 9: 551-564. DOI:10.1517/13543784.9.3.551 |
| [6] |
MARSHALL J S, PENSKY J, WILLIAMS S. Studies on human thyroxine-binding globulin. 8. Isoelectric focusing evidence for microheterogeneity of thyroxine-binding globulin[J]. Arch Biochem Biophy, 1973, 156: 456-462. DOI:10.1016/0003-9861(73)90294-4 |
| [7] |
姚荔嘉, 邓星, 丁晨虹, 冯仁鑫, 谢渭芬. 腺相关病毒介导的肝细胞核因子1α过表达改善四氯化碳诱导的小鼠肝纤维化[J]. 第二军医大学学报, 2017, 38: 1098-1105. YAO L J, DENG X, DING C H, FENG R X, XIE W F. Overexpression of hepatocyte nuclear factor 1α mediated by adeno-associated virus attenuates carbon tetrachloride-induced hepatic fibrosis in mice[J]. Acad J Sec Mil Med Univ, 2017, 38: 1098-1105. |
| [8] |
HU F B. 中国肥胖与2型糖尿病的发病趋势及其政策的影响[J]. 中华内科杂志, 2014, 53: 5-8. DOI:10.3760/cma.j.issn.0578-1426.2014.01.002 |
| [9] |
乔旭霞. 肥胖对非酒精性脂肪肝患者糖脂代谢的影响[J]. 重庆医学, 2011, 40: 1090-1092. |
| [10] |
BOISON D. Adenosine kinase:exploitation for therapeutic gain[J]. Pharmacol Rev, 2013, 65: 906-943. DOI:10.1124/pr.112.006361 |
| [11] |
BOISON D, SHEN H Y. Adenosine kinase is a new therapeutic target to prevent ischemic neuronal death[J]. Open Drug Discov J, 2010, 2: 108-118. |
| [12] |
SAHIN B, KANSY J W, NAIRN A C, SPYCHALA J, EALICK S E, FIENBERG A A, et al. Molecular characterization of recombinant mouse adenosine kinase and evaluation as a target for protein phosphorylation[J]. Eur J Biochem, 2004, 271: 3547-3555. DOI:10.1111/j.1432-1033.2004.04291.x |
| [13] |
FISHER M N, NEWSHOLME E A. Properties of rat heart adenosine kinase[J]. Biochem J, 1984, 221: 521-528. DOI:10.1042/bj2210521 |
| [14] |
DE OLIVEIRA R R, MORALES-NETO R, ROCCO S A, SFORÇA M L, POLO C C, TONOLI C C C, et al. Adenosine kinase couples sensing of cellular potassium depletion to purine metabolism[J/OL]. Sci Rep, 2018, 8: 11988. doi: 10.1038/s41598-018-30418-5.
|
| [15] |
王颖颖, 李飞飞, 杨书云, 沈勤. 腺苷激酶在乳腺癌中的表达及临床意义[J]. 南通大学学报(医学版), 2014, 34: 475-477. |
| [16] |
ANTONIOLI L, BLANDIZZI C, PACHER P, HASKÓ G. Immunity, inflammation and cancer:a leading role for adenosine[J]. Nat Rev Cancer, 2013, 13: 842-857. DOI:10.1038/nrc3613 |
| [17] |
BOISON D, SCHEURER L, ZUMSTEG V, RÜLICKE T, LITYNSKI P, FOWLER B, et al. Neonatal hepatic steatosis by disruption of the adenosine kinase gene[J]. Proc Natl Acad Sci USA, 2002, 99: 6985-6990. DOI:10.1073/pnas.092642899 |
| [18] |
ANNES J P, RYU J H, LAM K, CAROLAN P J, UTZ K, HOLLISTER-LOCK J, et al. Adenosine kinase inhibition selectively promotes rodent and porcine islet β-cell replication[J]. Proc Natl Acad Sci USA, 2012, 109: 3915-3920. DOI:10.1073/pnas.1201149109 |
| [19] |
FLÜCKIGER-ISLER R E, WALTER P. Stimulation of rat liver glycogen synthesis by the adenosine kinase inhibitor 5-iodotubercidin[J]. Biochem J, 1993, 292(Pt 1): 85-91. |
| [20] |
ZHANG M, ZENG X, YANG Q, XU J, LIU Z, ZHOU Y, et al. Ablation of myeloid ADK (adenosine kinase) epigenetically suppresses atherosclerosis in ApoE-/-(apolipoprotein E deficient) mice[J]. Arterioscler Thromb Vasc Biol, 2018, 38: 2780-2792. DOI:10.1161/ATVBAHA.118.311806 |
| [21] |
GOODPASTER B H, SPARKS L M. Metabolic flexibility in health and disease[J]. Cell Metab, 2017, 25: 1027-1036. DOI:10.1016/j.cmet.2017.04.015 |
 2020, Vol. 41
2020, Vol. 41


