肾盂输尿管连接部梗阻(ureteropelvic junction obstruction,UPJO)是引起泌尿系统上尿路梗阻的常见病因。1949年Anderson和Hynes[1]首先实施离断式肾盂成形术并将其推广,使肾盂成形术成为治疗UPJO的“金标准”。UPJO外科治疗方式经历长期发展,形成了开放肾盂成形术、腔内治疗术、腹腔镜肾盂成形术和机器人辅助腹腔镜肾盂成形术等术式。然而,对于先前手术失败、需再次手术干预的UPJO病例,目前尚未形成治疗标准。由于术后靶组织周围瘢痕、粘连严重,挽救性肾盂成形术是一项极具挑战性的重建、修复工作。机器人辅助腹腔镜肾盂成形术的安全性与可行性已得到广泛认可,机器人手术系统以其3D高清镜头及多向旋转仿真腕关节内固定系统,在重建及挽救性手术中发挥着巨大优势[2-3]。解放军总医院第一医学中心泌尿外科在成熟开展机器人辅助腹腔镜肾盂成形术的基础上,对27例复发性UPJO患者行挽救性机器人辅助腹腔镜肾盂成形术,取得良好疗效,现报告如下。
1 资料和方法 1.1 临床资料回顾性分析2015年8月至2018年7月解放军总医院第一医学中心泌尿外科收治的27例复发性UPJO患者的临床资料。27例患者中,男20例,女7例;年龄12~63岁,中位年龄31岁;BMI 17.9~31.8 kg/m2,平均(24.6±3.6)kg/m2;梗阻位于左侧18例,右侧9例;既往开放肾盂成形术手术史13例,腹腔镜肾盂成形术手术史11例,机器人辅助腹腔镜肾盂成形术手术史1例,经皮肾镜肾盂切开手术史2例。一次肾盂成形术手术史26例,二次肾盂成形术手术史1例。患者临床症状主要表现为腰部胀痛、泌尿系感染等,其中2例伴有发热,3例伴有结石;8例无明显不适,经体格检查再次发现UPJO。
所有患者术前均行静脉肾盂造影(intravenous pyelography,IVP)、计算机断层扫描泌尿系造影(computed tomography urography,CTU)或磁共振泌尿系水成像(magnetic resonance urography,MRU),观察肾盂输尿管连接部及其周围结构的解剖、梗阻程度;对于伴发肾结石的患者,明确结石数量、大小及位置。术前行发射计算机断层显像(emission computed tomography,ECT)评估双肾功能,肾功能控制满意后,择期行机器人辅助腹腔镜肾盂成形术。
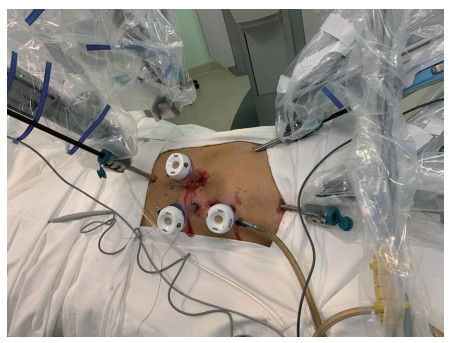
1.2 手术方法27例患者均使用达芬奇手术机器人系统(da Vinci Si)行经腹腔入路挽救性机器人辅助腹腔镜肾盂成形术。患者全身麻醉后留置导尿管并夹闭以充盈膀胱,取健侧卧位,常规消毒铺单,建立气腹。于脐头侧2横指处纵行切开皮肤,置入12 mm机器人套管作为镜头通道,置入镜头。直视下放置3个8 mm机器人套管作为机械臂通道。第1机械臂通道位于右侧锁骨中线肋缘下方2指偏内侧镜头套管上方8 cm处,并与其处于同一垂线;第2机械臂通道位于右侧锁骨中线偏外侧镜头套管外下方8 cm处,第1、2机械臂通道形成以镜头通道为顶点、顶角为120°的等腰三角形;第3机械臂通道位于第2机械臂通道内下方8 cm处第1机械臂通道与镜头通道的延长线上。于脐正中稍下方放置12 mm套管作为辅助通道(图 1)。床旁机械臂系统自患者头侧、沿躯干长轴方向垂直进入,与各套管对接,在镜头直视下第1机械臂置入单极弯剪,第2机械臂置入Maryland双极抓钳,第3机械臂置入专业抓钳。
|
图 1 机器人辅助腹腔镜肾盂成形术套管分布及体位 Fig 1 Trocar placement and position for robot-assisted laparoscopic pyeloplasty |
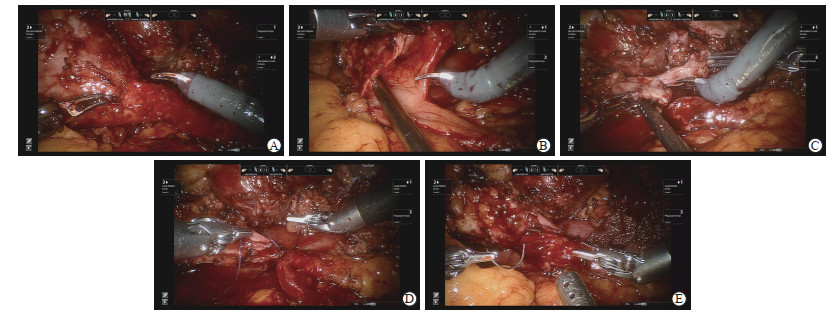
因患者既往有肾盂成形术手术史,术中需仔细松解术野内粘连。沿结肠旁沟外打开侧腹膜,离断结肠韧带,将结肠翻向内下,充分显露肾脏中下极。可见肾盂呈扩张状态,锐性结合钝性打开肾筋膜并分离肾盂、输尿管表面组织,显露肾盂及输尿管上段(图 2A)。术中可见肾盂与输尿管周围粘连较严重,仔细游离输尿管并注意保护其血供。探查可见肾盂扩张明显,先在肾盂外侧低位做一切口引流出积液。自外下向内上弧形裁剪肾盂,保持肾盂输尿管连接处最内侧暂不完全离断,纵行切开输尿管外侧壁超过狭窄部位2 cm左右(图 2B)。以4-0可吸收缝线将肾盂瓣的最低位与切开的输尿管最低位缝合,剪去多余肾盂及输尿管上段狭窄段(图 2C)。以连续缝合的方式吻合输尿管及肾盂后壁,连续缝合2针锁边1次,再将肾盂其余开口处关闭(图 2D)。经吻合口放置6 F双J管,先将一端置入输尿管,再将另一端置入肾盂,确认位置无误后打开夹闭的导尿管。以4-0可吸收缝线间断缝合吻合口前壁(图 2E)。降低气腹压,检查肾周无活动性出血后,吻合口旁放置引流管1根,以Hem-o-lok夹夹闭侧腹膜。清点器械、纱布无误后拔出套管,逐层缝合穿刺口。
|
图 2 机器人辅助腹腔镜肾盂成形术关键操作步骤 Fig 2 Intraoperative key operational steps of robot-assisted laparoscopic pyeloplasty A: Exposure of ureteropelvic junction; B: Incision of lateral ureteral wall; C: Trimming pelvis and ureteral stricture; D: Anastomosis of renal pelvis and posterior ureteral wall; E: Anastomosis of anterior ureteral wall |
1.3 观察指标
记录围手术期情况。术后定期复查超声及尿常规,必要时行CTU或ECT检查。
1.4 统计学处理以27例患者的临床资料建立数据库,使用SPSS 22.0软件进行数据分析。呈正态分布的计量资料以x±s表示,呈偏态分布的计量资料以中位数表示;计数资料以例数表示。
2 结果 2.1 手术情况27例复发性UPJO患者临床资料见表 1。27例手术均获成功,无一例术中转开放手术且均未输血。手术时间为105~360 min,平均(159.7±54.2)min;术中出血量为10~100 mL,平均(36.3±20.2)mL;术后导尿管留置时间为2~10 d,平均(4.2±2.4)d;引流管留置时间为3~7 d,平均(4.7±1.8)d;术后住院时间为3~12 d,平均(4.4±2.9)d。1例术后出现尿漏,保持引流管引流通畅,10 d后尿漏消失予以拔除引流管;1例术后出现血尿,经保守治疗后痊愈。术后8周取出双J管。术后常规病理结果显示:尿路上皮黏膜慢性炎26例,平滑肌及纤维组织增生1例。
|
|
表 1 27例复发性UPJO患者临床资料 Tab 1 Clinical data of 27 patients with recurrent UPJO |
2.2 随访结果
术后随访12~36个月,平均(21.2±9.8)个月。26例肾积水明显改善或消失,肾功能得到不同程度恢复,达到手术治愈标准;1例肾实质变薄,梗阻未见减轻,输尿管镜检查见吻合口出现狭窄环,再置入双J管2个月取出后缓解。
3 讨论1949年Anderson和Hynes[1]首先实施开放离断式肾盂成形术治疗先天性UPJO。此术式主要包括切除狭窄段输尿管、裁剪扩张肾盂和输尿管黏膜对位吻合,其治疗成功率约为90%,成为治疗UPJO的“金标准”[4]。然而开放肾盂成形术存在手术切口过长、组织损伤严重、住院时间长、并发症发生率较高等缺点。1993年Schuessler等[5]率先开展腹腔镜肾盂成形术。由于早期腹腔镜下缝合技巧不甚娴熟、技术体系尚未完善,因此手术成功率较低。随着腹腔镜手术技巧的提升,以及腹腔镜器械的迅速发展,腹腔镜肾盂成形术得以推广。腹腔镜肾盂成形术具有治疗成功率高、创伤小、疼痛轻、术后恢复时间短、并发症发生率低等优势。Ost等[6]报道了100例行腹腔镜肾盂成形术治疗的UPJO患者资料,其成功率为88%~96%;Moon等[7]报道了170例腹腔镜肾盂成形术病例,成功率为96.2%,已与开放手术相当。然而,腹腔镜肾盂成形术需要在狭小空间内进行裁剪、缝合、打结等操作,难度较高,尤其是对于小儿UPJO患者[8]。这些因素导致腹腔镜肾盂成形术的学习曲线较长,一定程度制约了腹腔镜肾盂成形术的进一步普及。
对于肾盂成形术术后复发性UPJO患者,开放肾盂成形术、内镜下肾盂切开球囊扩张术及腹腔镜肾盂成形术均为有效的挽救性治疗方式[9-11]。然而,开放肾盂成形术创伤大、恢复期长,同时易致组织粘连与纤维化,增加了术后再发狭窄的风险;而内镜下肾盂切开球囊扩张术的成功率明显低于挽救性腹腔镜肾盂成形术[11-12]。多项研究证实了再次行腹腔镜肾盂成形术治疗复发性UPJO是安全、可行的,其成功率为77.8%~100.0%[13-15]。然而,对于复发性UPJO患者行挽救性腹腔镜肾盂成形术是一项挑战,术者须具备精湛的腹腔镜手术技巧,挽救性腹腔镜肾盂成形术难以广泛开展。
近年来机器人手术发展迅速,为复发性UPJO患者的治疗提供了新选择。作为腹腔镜系统的进一步发展,手术机器人系统较传腹腔镜视野更为清晰、操作更加精细平稳,使得术者更易于开展复杂手术。1999年Sung等[16]报道了首例机器人辅助腹腔镜肾盂成形术。2007年Schwentner等[17]报道了单中心92例机器人辅助腹腔镜肾盂成形术,其中初次手术80例,二次手术12例,成功率为96.7%;对于初发和复发UPJO患者,机器人辅助腹腔镜肾盂成形术成功率均较高,且并发症发生率低。Nishi等[15]研究表明,对于既往有肾盂成形术史的患者,挽救性机器人辅助腹腔镜肾盂成形术成功率依然较高且术后恢复时间短,尿漏、再次狭窄等并发症发生率低;对于UPJO伴随输尿管上段结石的患者,机器人辅助腹腔镜肾盂成形术疗效更为确切。Atug等[18]报道了7例成人复发性UPJO患者行机器人辅助腹腔镜肾盂成形术,并将其结果与37例初发UPJO患者进行比较,结果表明再次肾盂成形术组平均手术时间较长,但术中出血量、成功率与初次肾盂成形术组相似。
对于既往一次甚至二次肾盂成形术手术失败再行挽救性肾盂成形术的患者而言,难点在于肾周自然解剖层次已被破坏,无法预知其周围结构;不同术者操作习惯差异较大,致使肾盂输尿管连接部的解剖结构变化很大;加之术后组织修复形成瘢痕、粘连,解剖结构的暴露与组织分离较为困难,再次手术时更易损伤肾盂和输尿管,手术难度与风险显著增高。
手术机器人系统3D镜头放大倍数为10~15倍,这一高清3D图像优势使术者能够获得更佳的纵深感、层次感及空间定位[19],术者可以清晰地辨别靶组织周围形成的瘢痕与粘连,这在一定程度上克服了复发性UPJO患者解剖层次不易显露的难题。挽救性肾盂成形术应以锐性与钝性相结合的方式松解瘢痕与粘连,充分游离狭窄处两侧的肾盂及输尿管以降低吻合口张力,必要时可部分游离、下拉肾脏。注意保护输尿管血供,保留输尿管周围筋膜,因其是输尿管血供的来源。尽量减少机器人器械对吻合口黏膜的直接钳夹,因输尿管黏膜损伤可能与远期纤维化有关,可夹持拟剪裁部位肾盂及输尿管组织以避免损伤。该手术系统为组织的精细离断提供了视野保证,能够有效减少术中出血并避免损伤,从而降低手术风险。
机器人机械臂采用仿真手腕(EndoWrist)技术,腕部具有前、后、左、右、旋前、旋后及环转7个自由度,能够实现多角度自由转动,突破了人手及腹腔镜器械的局限,为术者操作提供了前所未有的灵活度,使术者能够在深部及狭小的空间内精准地进行分离、缝合、打结等操作,一定程度上克服了复发性UPJO患者肾盂输尿管活动度受限所致的重建困难。挽救性肾盂成形术建议采用经腹腔入路,因其具有更多的解剖标志及更大的操作空间,有利于分离瘢痕组织并减少副损伤,一定程度规避瘢痕及粘连,同时对肾腹侧、肾中上极和肾门部自然解剖结构破坏较小,可以较直接地显露这些部位。游离输尿管应从正常输尿管节段开始,因该处粘连较轻,有利于标准游离平面的辨别。全程无张力吻合是手术成功的关键,对于吻合口后壁和多余肾盂的缝合,推荐连续缝合以减少尿漏的风险,吻合口前壁以间断缝合为宜。
手术机器人具有震颤滤过系统,可以滤除术者生理性颤动产生的无效操作,增强了稳定性, 使手术更加精细、平稳,从而避免损伤组织结构。对于UPJO手术失败需再次行肾盂成形术的患者,存在容易损伤输尿管和肾盂这一问题,我们使用第3机械臂的专业抓钳辅助显露。第3机械臂有助于牵拉、暴露组织,对于复杂性上尿路重建手术至关重要。良好的显露与稳定的牵拉能够有效地避免对输尿管和肾盂的损伤,同时使得缝合操作更加顺畅。机器人手术术者为坐位操作,显著降低了劳动强度,适合挽救性肾盂成形术等复杂、长时间手术。对于肾功能稳定的复发性UPJO患者,严重组织水肿、粘连可能与间隔时间较短有关,因此挽救性手术与前次手术间隔时间应>1年。
本研究对27例因肾盂成形术后再发持续性尿路梗阻而行挽救性机器人辅助腹腔镜肾盂成形术的患者进行临床分析与随访研究,结果表明机器人辅助腹腔镜肾盂成形术对该类患者安全、有效。本研究病例数相对较少,且为回顾性分析,远期疗效有待进一步随访观察。达芬奇手术机器人系统为术者提供了一个较满意的平台,挽救性机器人辅助腹腔镜肾盂成形术安全、可行且效果肯定,为既往认为失去手术机会的复发性UPJO患者争取到进一步治疗的机会。在设备与技术条件允许的情况下,我们推荐将机器人辅助腹腔镜肾盂成形术作为复发性UPJO患者的优选治疗方式。
| [1] |
ANDERSON J C, HYNES W. Retrocaval ureter; a case diagnosed pre-operatively and treated successfully by a plastic operation[J]. Br J Urol, 1949, 21: 209-214. DOI:10.1111/j.1464-410X.1949.tb10773.x |
| [2] |
GÖĞÜŞ C, KARAMÜRSEL T, TOKATLI Z, YAMAN O, OZDILER E, GÖĞÜŞ O. Long-term results of Anderson-Hynes pyeloplasty in 180 adults in the era of endourologic procedures[J]. Urol Int, 2004, 73: 11-14. DOI:10.1159/000078796 |
| [3] |
HEMAL A K, MISHRA S, MUKHARJEE S, SURYAVANSHI M. Robot assisted laparoscopic pyeloplasty in patients of ureteropelvic junction obstruction with previously failed open surgical repair[J]. Int J Urol, 2008, 15: 744-746. DOI:10.1111/j.1442-2042.2008.02091.x |
| [4] |
TOBIS S, VENIGALLA S, BALAKUMARAN K, SCOSYREV E, LLOYD G L, GOLIJANIN D J, et al. Analysis of a large single-center experience with robot-assisted pyeloplasty[J]. Int J Urol, 2013, 20: 230-234. DOI:10.1111/j.1442-2042.2012.03119.x |
| [5] |
SCHUESSLER W W, GRUNE M T, TECUANHUEY L V, PREMINGER G M. Laparoscopic dismembered pyeloplasty[J]. J Urol, 1993, 150: 1795-1799. DOI:10.1016/S0022-5347(17)35898-6 |
| [6] |
OST M C, KAYE J D, GUTTMAN M J, LEE B R, SMITH A D. Laparoscopic pyeloplasty versus antegrade endopyelotomy:comparison in 100 patients and a new algorithm for the minimally invasive treatment of ureteropelvic junction obstruction[J]. Urology, 2005, 66(5 Suppl): 47-51. |
| [7] |
MOON D A, EL-SHAZLY M A, CHANG C M, GIANDUZZO T R, EDEN C G. Laparoscopic pyeloplasty:evolution of a new gold standard[J]. Urology, 2006, 67: 932-936. DOI:10.1016/j.urology.2005.11.024 |
| [8] |
王林辉, 陈伟, 杨庆, 刘冰, 孙颖浩. 后腹腔镜离断式肾盂成形术(附25例报告)[J]. 临床泌尿外科杂志, 2010, 25: 95-97. DOI:10.3969/j.issn.1001-1420.2010.02.005 |
| [9] |
THOMAS J C, DEMARCO R T, DONOHOE J M, ADAMS M C, POPE J C 4th, BROCK J W 3rd. Management of the failed pyeloplasty:a contemporary review[J]. J Urol, 2005, 174: 2363-2366. DOI:10.1097/01.ju.0000180420.11915.31 |
| [10] |
MOTOLA J A, BADLANI G H, SMITH A D. Results of 212 consecutive endopyelotomies:an 8-year followup[J]. J Urol, 1993, 149: 453-456. DOI:10.1016/S0022-5347(17)36116-5 |
| [11] |
PREMINGER G M, CLAYMAN R V, NAKADA S Y, BABAYAN R K, ALBALA D M, FUCHS G J, et al. A multicenter clinical trial investigating the use of a fluoroscopically controlled cutting balloon catheter for the management of ureteral and ureteropelvic junction obstruction[J]. J Urol, 1997, 157: 1625-1629. DOI:10.1016/S0022-5347(01)64813-4 |
| [12] |
DIMARCO D S, GETTMAN M T, MCGEE S M, CHOW G K, LEROY A J, SLEZAK J, et al. Long-term success of antegrade endopyelotomy compared with pyeloplasty at a single institution[J]. J Endourol, 2006, 20: 707-712. DOI:10.1089/end.2006.20.707 |
| [13] |
BASIRI A, BEHJATI S, ZAND S, MOGHADDAM S M. Laparoscopic pyeloplasty in secondary ureteropelvic junction obstruction after failed open surgery[J]. J Endourol, 2007, 21: 1045-1051. DOI:10.1089/end.2006.0414 |
| [14] |
NAKADA S Y, MCDOUGALL E M, CLAYMAN R V. Laparoscopic pyeloplasty for secondary ureteropelvic junction obstruction:preliminary experience[J]. Urology, 1995, 46: 257-260. DOI:10.1016/S0090-4295(99)80205-2 |
| [15] |
NISHI M, TSUCHIDA M, IKEDA M, MATSUDA D, IWAMURA M. Laparoscopic pyeloplasty for secondary ureteropelvic junction obstruction:long-term results[J]. Int J Urol, 2015, 22: 368-371. DOI:10.1111/iju.12686 |
| [16] |
SUNG G T, GILL I S, HSU T H S. Robotic-assisted laparoscopic pyeloplasty:a pilot study[J]. Urology, 1999, 53: 1099-1103. DOI:10.1016/S0090-4295(99)00030-8 |
| [17] |
SCHWENTNER C, PELZER A, NEURURER R, SPRINGER B, HORNINGER W, BARTSCH G, et al. Robotic Anderson-Hynes pyeloplasty:5-year experience of one centre[J]. BJU Int, 2007, 100: 880-885. DOI:10.1111/j.1464-410X.2007.07032.x |
| [18] |
ATUG F, BURGESS S V, CASTLE E P, THOMAS R. Role of robotics in the management of secondary ureteropelvic junction obstruction[J]. Int J Clin Pract, 2006, 60: 9-11. |
| [19] |
YOSHIDA T, INOUE H, HARA E, UMEZAWA A, OHTSUKA K, ENDO S, et al. Newly developed 3D endoscopic system:preliminary experience[J]. Endoscopy, 2003, 35: 181-184. DOI:10.1055/s-2003-37015 |
 2020, Vol. 41
2020, Vol. 41


