肾部分切除术已逐渐成为局限性肾肿瘤的推荐术式[1]。达芬奇(da Vinci)手术机器人系统凭借其3D高清视野、更多灵活性和自由度的器械,使得腹腔镜下分离、切割更加精准,缝合更加迅速,大大突破了常规腹腔镜的局限性,更适用于高复杂程度的肾部分切除手术[2]。机器人辅助腹腔镜肾部分切除术(robot-assisted laparoscopic partial nephrectomy,RAPN)的适应证不仅由T1a期扩大到T1b期,对于T2期肾肿瘤、完全内生型肾肿瘤、肾门部位肿瘤等更复杂的肿瘤也有信心完成[3]。由于特殊的解剖位置关系,肾门肿瘤肾部分切除术具有更高的技术要求和更大的挑战性,如何在完整切除肾门肿瘤的同时,尽可能保护肾功能、减少手术并发症,一直是近几年的研究热点。目前已有众多研究对肾门肿瘤肾部分切除术的手术入路、肿瘤切除技巧、缝合技术及围手术期结果进行了分析,但不同研究对肾门肿瘤的定义存在一定差异[4-6],在同一研究中也普遍存在肾门组和非肾门组肿瘤最大径和肿瘤复杂程度评分差别过大的情况[5, 7-8],因而存在一定的局限性。我们在临床工作中发现一类特殊部位的肾门肿瘤,即肾门(hilar)偏上极(upper)骑跨肾血管及肾门前后唇(straddling)的肿瘤,简称HUS部位肾门肿瘤,因瘤体位于肾门上极且几乎横跨肾脏腹侧及背侧,术中显露更加困难,缝合技术要求高,往往因为无法充分显露或缝合不确切而中转开放手术。现总结RAPN治疗HUS部位肾门肿瘤的疗效和安全性。
1 资料和方法 1.1 临床资料回顾性分析2016年2月至2018年12月于我院接受RAPN治疗的患者资料,排除良性肾肿瘤和孤独肾,筛选出典型HUS部位肾门肿瘤13例(HUS组),并根据R.E.N.A.L.评分[9]筛选出与之得分相当的13例非HUS部位肾门肿瘤(非HUS组)作为对照。两组患者均为主动体格检查或意外检查时发现肾肿瘤,术前均行肾脏动静脉计算机断层扫描血管成像(computed tomography angiography,CTA)了解肿瘤与血管的位置关系,评估为局限性肾肿瘤,并完成R.E.N.A.L.评分。按照肿瘤偏腹侧或偏背侧选择经腹腔或后腹腔途径,HUS组9例行经腹腔RAPN,非HUS组11例行经腹腔RAPN,其余患者行经后腹腔RAPN。所有患者均经术后病理确诊T1期肾癌。
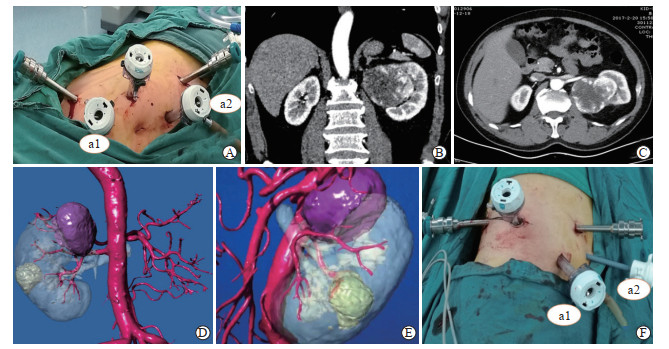
1.2 手术方法经腹腔RAPN的术前准备、体位、套管布置参见我们既往的报道[10],均采用2个12 mm辅助孔(图 1A),右侧额外增加1个5 mm托举肝脏的辅助孔。结合HUS部位肿瘤的特点(图 1B~1E),对关键手术步骤作进一步介绍。以右侧为例,游离肾区腹膜粘连,切断肝结肠韧带,打开侧腹膜,将右半结肠推向内侧,显露十二指肠和下腔静脉,沿下腔静脉寻找并游离右肾静脉,在右肾静脉后方仔细寻找右肾动脉并适当游离,必要时根据术前CTA检查寻找异位肾动脉。必要时游离输尿管以避免损伤。打开肾周脂肪囊,将肾脏上下极、腹侧和背侧充分游离,直至可将肾脏向内侧或内下侧翻转,精细解剖、辨认肾门结构,通常需要清除肾门部位的脂肪,显露肾盂输尿管走行和肾脏动静脉的解剖关系。HUS部位肾门肿瘤通常位于肾门上方,肿瘤一侧紧贴肾门大血管及其分支,可利用单极电凝轻灼肾脏表面标记肿瘤边界,必要时术中超声辅助。用无损伤血管钳“哈巴狗钳”阻断肾动脉主干(和/或肾静脉),将游离的肾脏适当旋转,使肿瘤视野充分暴露以便切割和缝合;用单极电剪从肾门侧肿瘤边缘锐性切开肾皮质及髓质,助手利用吸引器吸除创面渗血;术者用双极电钳、助手用无损伤抓钳钳夹肿瘤边缘适当牵拉保持一定张力,再用单极电剪一边锐性剪切,一边适当推剥、钝性分离,常可显露肿瘤的假包膜;然后沿肿瘤包膜逐步分离至基底部,再顺势反向上挑,完整切除肿瘤。切除HUS部位肾门肿瘤通常需要打开集合系统,其间遇到明显的肾段动脉可予以夹闭,肾静脉属支通常可暂时压迫止血,后续再彻底缝合止血。肿瘤完整切除后,用3-0可吸收倒刺线沿创面基底部缝合以闭合剪开的静脉系统及集合系统,用2-0可吸收倒刺线“人”字形或“花边式”缝合肾实质创面,缝合线收紧后用Hem-o-lok夹妥善固定。松开肾动脉阻断夹,检查缝合创面有无渗血,同时观察剩余肾实质血供恢复情况。将肾脏恢复正常解剖位置并缝线固定。用标本袋完整取出标本,留置腹腔引流管。左侧HUS部位肾门肿瘤手术过程见图 2。
|
图 1 机器人体位、套管布置及术前影像图 Fig 1 Operative position, location of trocars and preoperative imaging data A: The operative position and location of trocars for transperitoneal RAPN. Two assistant ports (a1 and a2) were shown in this image. B, C: Contrast-enhanced computed tomography images of HUS renal tumors. D, E: Three-dimensional reconstruction images of HUS renal tumors. F: The operative position and location of trocars for retroperitoneal RAPN. Two assistant ports (a1 and a2) were shown in this image. RAPN: Robot-assisted laparoscopic partial nephrectomy; HUS: Hilar tumors close to the upper pole of kidney and straddling renal pedicle |

|
图 2 左侧HUS部位肾门肿瘤手术过程 Fig 2 Intraoperative images of left HUS renal tumors A: Renal artery and vein were clamped with bulldogs; B: Meticulous tumor dissection was carried out by blunt and sharp dissection in order to ensure grossly negative margins; C: Part of the venule in the kidney was cut off and the collecting system was damaged; D: Tumor bed after resection with limited tissue; E: Closure of the inner layer required precise suturing to achieve hemostasis and repairing any previously identified entry into the collecting system; F: The outer layer suture was mainly for repairing the edges of renal defect straddling renal pedicle following the marker line in the image. HUS: Hilar tumors close to the upper pole of kidney and straddling renal pedicle |
经后腹腔途径RAPN步骤基本同国内文献报道[11]。采取健侧卧位,腰部垫高,先取髂棘上长1~2 cm小切口,打开腰背筋膜,手指钝性分离腹膜后间隙,自制球囊扩张腹膜后空间。腋后线第12肋下约1 cm处置入8 mm机器人套管,髂棘上切口置入镜头套管,连接气腹,直视下经腋后线套管利用钝性分离推开腹膜,于腋前线肋弓下缘置入另一个8 mm机器人套管。镜头孔和腹侧8 mm套管连线中点偏腹侧放置12 mm和5 mm两个辅助套管(图 1F)。清理腹膜后脂肪,打开Gerota筋膜,游离肾周脂肪,充分显露肿瘤及其边界,腰大肌侧肾门处寻找并游离肾动脉,助手用“哈巴狗钳”阻断肾动脉,将肾脏适当旋转,使肿瘤和肾脏创面尽可能朝向术者内窥镜视野,先沿肿瘤边缘锐性剪切肾实质,逐步探明肿瘤基底部,显露肿瘤假包膜,靠近集合系统或肾门血管处可尝试钝性剥离,完整切除肿瘤后用3-0可吸收倒刺线沿创面基底部缝合以闭合剪开的静脉系统及集合系统,应避免进针过深,再以2-0可吸收倒刺线缝合肾实质创面。
1.3 观察指标收集并对比两组患者临床基本资料、围手术期关键指标[手术时间、肾脏热缺血时间、术中出血量、输血情况、术后住院时间、术后短期肾功能变化、切缘阳性率、并发症发生率、“三连胜”(trifecta)达标率]。所有RAPN手术时间均不包含机械臂准备时间。“三连胜”达标定义为同时满足切缘阴性、肾脏热缺血时间≤25 min、无围手术期并发症[12]。
1.4 术后随访所有患者均于术后1个月进行腹部MRI或CT平扫检查,然后每3个月复查1次至术后1年,第2年每6个月复查1次,其后每年复查1次,记录复发转移情况和死亡情况。
1.5 统计学处理利用SPSS 21.0软件进行统计学分析。符合正态分布的计量资料以x±s表示,采用独立样本t检验进行两组间比较;不符合正态分布的计量资料以中位数(范围)表示,采用非参数检验进行两组间比较;计数资料以例数和百分数表示,采用χ2检验或Fisher确切概率法进行两组间比较。所有检验均采用双侧检验,检验水准(α)为0.05。
2 结果 2.1 患者基本信息和肿瘤特征HUS组男8例、女5例,年龄为31~64(50.92±10.16)岁,BMI为(22.94±2.64)kg/m2;R.E.N.A.L.评分为(9.31±1.07)分,肿瘤最大直径为(4.52±1.14)cm,肿瘤位于左侧9例、右侧4例;既往腹腔或肾结石微创手术史3例,合并其他疾病(高血压、糖尿病、冠心病、心房颤动、泌尿系统结石)5例。非HUS组男10例、女3例,年龄为24~71(48.92±13.75)岁,BMI为(23.86±4.56)kg/m2;R.E.N.A.L.评分为(9.15±1.26)分,肿瘤最大直径为(4.83±1.22)cm,肿瘤位于左侧7例、右侧6例;既往腹腔或肾结石微创手术史2例,合并其他疾病9例。两组患者的年龄、性别、BMI、肿瘤部位(左侧/右侧)、肿瘤最大直径、R.E.N.A.L.评分、合并疾病、既往腹部或肾结石微创手术史、术前血红蛋白、估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)、术后病理类型及临床分期差异均无统计学意义(P均>0.05),具有较好的可比性(表 1)。
|
|
表 1 两组肾门肿瘤患者基本资料对比 Tab 1 Comparison of baseline characteristics of renal hilar tumor patients between the two groups |
2.2 围手术期及随访结果对比
13例HUS部位肾门肿瘤RAPN中,3例中转开放肾部分切除术(其中2例术中输血),共3例术中输血。术后2例发生Clavien-DindoⅢ级并发症,其中1例术后急性出血,行超选择肾动脉栓塞术成功止血,复查肾功能良好;另1例术后第6天发生急性肺栓塞(三级分支血管),经治疗后于术后第15天顺利出院。非HUS组13例均顺利完成RAPN,术中输血2例。1例发生术后Clavien-DindoⅡ级并发症,表现为血尿、腹膜后血肿,经输血、保守治疗后好转。由表 2可见,与非HUS组相比,HUS组的手术时间[(132.92±22.33)min vs(110.85±20.97)min]和肾脏热缺血时间[(28.08±6.29)min vs(22.15±5.87)min]均较长,差异均有统计学意义(P均<0.05)。HUS组术中出血量高于非HUS组[(320.00±243.31)mL vs(181.54±117.04)mL],但差异无统计学意义(P=0.077)。两组患者输血比例、术后住院时间、术后短期肾功能变化、切缘阳性率、并发症发生率、“三连胜”(trifecta)达标率差异均无统计学意义(P均>0.05)。HUS组和非HUS组术后中位随访时间分别为16(2~34)个月和15(3~33)个月,随访期间两组患者均无肿瘤复发转移、无死亡。
|
|
表 2 两组肾门肿瘤患者围手术期结果对比 Tab 2 Comparison of perioperative data of renal hilar tumor patients between the two groups |
3 讨论
多数文献将肾门肿瘤定义为术前影像学或术中发现肿瘤位于肾门位置,与肾动脉和(或)肾静脉相接触但未侵犯的肾皮质肿瘤[5, 13]。因肿瘤毗邻肾蒂血管和集合系统,肾部分切除术过程中出现血管损伤被迫切除肾脏或肿瘤破裂造成切缘阳性的风险较高;肿瘤切除后的创面缝合极为困难,术后出血、漏尿、肾积水等并发症发生率较高;肾脏热缺血时间过长或肾门部位分支血管受损,导致术后肾功能恢复不理想。随着腹腔镜及达芬奇腹腔镜技术的不断发展,已有不少文献分析了肾门肿瘤施行腹腔镜肾部分切除术或RAPN的可行性和安全性[5, 13-15],以及肾门肿瘤施行RAPN和开放肾部分切除术的比较[16]。上述研究均认为肾门肿瘤行微创肾部分切除术是安全可行的,但也强调需要挑选合适的病例,并且需要术者具有娴熟的腔镜操作技术。
肾部分切除术的首要目标是根治肿瘤,其次是尽可能保护残余肾组织的功能,并且尽可能减少手术并发症。病理切缘是评价肿瘤是否完全切除的关键指标,单中心大样本研究显示,术者经验不足、肾门部位肿瘤、术前肾功能不良是切缘阳性的独立危险因素[17]。多项研究认为肾门肿瘤与非肾门肿瘤RAPN的术后切缘阳性率和复发转移病例数均无明显差异,但这些研究中所涉及的病例包含了10%~20%的良性肾肿瘤[5, 7],可能会导致生存随访偏倚。本中心从2015年2月开展机器人腹腔镜手术,为了排除术者经验和良性肾肿瘤的影响,本研究仅纳入2016年2月之后的病例,并且全部病例经术后病理证实为肾癌,增加了可比性。最终两组患者切缘均为阴性,短期随访均无复发转移,这可能与本研究病例数少有关,也可能与HUS组3例RAPN果断改为开放手术有关。一项包含1 818例T1期肾癌患者的随访研究显示,肿瘤位于肾门部位是术后肿瘤复发的独立危险因素[18],因此,我们认为肾门肿瘤尤其是HUS部位肿瘤,术后应该密切随访。
肾脏热缺血时间是影响术后肾功能恢复和评价肾部分切除术的关键指标,目前多数研究认为肾脏热缺血时间最好控制在25 min内[12]。Lu等[8]研究显示,30例肾门肿瘤RAPN的热缺血时间为(39.9±24.0)min,长于170例非肾门肿瘤的热缺血时间[(21.8±16.0)min];Eyraud等[7]的研究也得出相同结论,并且多因素分析发现肾门部位肿瘤是热缺血时间延长的独立危险因素。一项meta分析也指出肾门肿瘤与肾脏热缺血时间延长相关[19]。本研究中HUS组肾脏热缺血时间长于非HUS组,与上述文献报道一致,这与HUS部位肾门肿瘤切除和缝合困难密切相关。多数研究认为肾门肿瘤的总手术时间比非肾门肿瘤手术时间明显延长[7-8],但也有文献报道两组手术时间差异无统计学意义[5]。本研究中HUS组手术时间长于非HUS组,这与HUS组术中需要将肾脏完全游离、显露肾门结构及缝合止血耗时长等因素有关。不同文献报道的术中出血量差异较大,Eyraud等[7]和Cacciamani等[19]的研究认为肾门肿瘤具有较多的术中出血量,而Dulabon等[5]和Lu等[8]的研究则认为肾门肿瘤和非肾门肿瘤的术中出血量并无明显差异。本研究中HUS组术中出血量为(320.00±243.31)mL,高于非HUS组的(181.54±117.04)mL,但差异无统计学意义,可能与样本量小有关。血管阻断方式的不同可能是导致上述结果的原因之一,我们发现,对于HUS部位或肾门部位的复杂肿瘤,术中经常会伴随肾静脉属支的破损,如果未阻断肾静脉,往往出血比较明显,不仅增加出血量,而且影响视野和操作。
本研究中HUS组有3例(23.08%)术中更改为开放肾部分切除术,既往也有类似报道,如Cacciamani等[19]研究显示肾门肿瘤RAPN中转开放肾部分切除术的概率是非肾门肿瘤的14.14倍(P=0.006)。此外,还有研究提示肾门肿瘤是RAPN中转根治性肾切除术的主要原因之一[20]。虽然本研究和其他一些研究[5, 7-8]均未发现肾门肿瘤与非肾门肿瘤在术中输血患者比例、术后并发症发生率、术后住院时间、术后肾功能改变方面有差异,但仍有文献指出肾门肿瘤是术后漏尿的相关因素之一[21]。因此,一旦术中集合系统破损,需要仔细缝合,必要时留置输尿管支架;术后监测引流量,必要时查引流液肌酐值,以尽早发现有无漏尿。
虽然本研究中HUS组和非HUS组的肾肿瘤复杂程度评估(R.E.N.A.L.评分)差异无统计学意义,但手术时间和肾脏热缺血时间差异明显,并且HUS组有3例中转开放手术。仔细分析不难发现,现有的术前影像学评分系统如R.E.N.A.L.评分、PADUA评分虽然提及了肾门部位肿瘤,但没有将肾门肿瘤具体量化评分,故而难以预测HUS部位肿瘤的手术难度和围手术期风险。此外,目前的研究均未对肾门肿瘤作出进一步的优化分类,如肿瘤位于肾门前唇、后唇、上方或下方手术难度有无区别。我们认为,肾门肿瘤是否偏上极是影响手术难度的关键因素之一,与一般的肾门肿瘤相比,HUS部位肾门肿瘤几乎横跨肾脏腹侧及背侧,无论经腹腔还是经后腹腔途径都难以充分显露瘤床,使得肿瘤切除、创面缝合更加困难。因此,有必要将该部位肾门肿瘤单独评估并探讨其手术策略。通过复习相关文献并结合本中心经验,我们总结了HUS部位肾门肿瘤RAPN的几点体会:(1)充分游离肾脏,以便将肾脏和肾蒂适当旋转,显露肾门位置并精细解剖,辨认输尿管、肾门血管走行。(2)切除肿瘤时,遵循确定边界、寻找层面、紧贴包膜、钝锐结合、适形切除的原则。先电凝标记肿瘤大致边界,从肾门侧前唇或后唇锐性剪开肾实质,然后借助双极抓钳和助手无损伤抓钳牵拉辅助(建议使用2个辅助孔或第3机械臂),仔细辨认肿瘤假包膜和基底部,紧贴血管和集合系统一侧的肿瘤推荐钝性分离剜除,这样既可最大限度保持动静脉血管和集合系统的完整性,又保留了尽可能多的肾实质。(3)分层精细缝合。第1层先用倒刺线精细关闭破损的集合系统和肾静脉属支,减少术后出血和漏尿的发生;第2层肾实质缝合,需要灵活应用“ V ”形缝合、“人”字形缝合、“花边式”缝合技术,必要时将可吸收止血纱铺垫于创面再缝合肾实质,进一步加强止血效果,同时避免缝线撕裂肾实质。(4)保证良好的阻断效果。阻断不完全或静脉属支破损后回流渗血会严重影响视野和手术进度,因此对于HUS部位肿瘤和复杂的肾门肿瘤,术前需了解有无异位分支动脉,对于供应瘤体部位的分支动脉可以直接夹闭,必要时术中同时阻断肾静脉,以确保术野清晰。
总之,肾门肿瘤特别是HUS部位肿瘤RAPN可能需要更长的手术时间和肾脏热缺血时间,并且术中更改手术方式的概率也较高。HUS部位肿瘤作为一类特殊的肾门肿瘤,对其施行RAPN的难度较大。本研究样本量较小,未来仍需要进一步探索HUS部位肿瘤合适的术前难度评估模型,不断改进和完善手术策略及技巧,并根据肿瘤特征和术者经验合理选择手术方式,重视术后随访。
| [1] |
LJUNGBERG B, ALBIGES L, ABU-GHANEM Y, BENSALAH K, DABESTANI S, FERNÁNDEZ-PELLO S, et al. European Association of Urology guidelines on renal cell carcinoma:the 2019 update[J]. Eur Urol, 2019, 75: 799-810. DOI:10.1016/j.eururo.2019.02.011 |
| [2] |
KHALIFEH A, AUTORINO R, HILLYER S P, LAYDNER H, EYRAUD R, PANUMATRASSAMEE K, et al. Comparative outcomes and assessment of trifecta in 500 robotic and laparoscopic partial nephrectomy cases:a single surgeon experience[J]. J Urol, 2013, 189: 1236-1242. DOI:10.1016/j.juro.2012.10.021 |
| [3] |
WALLIS C J, GARBENS A, CHOPRA S, GILL I S, SATKUNASIVAM R. Robotic partial nephrectomy:expanding utilization, advancing innovation[J]. J Endourol, 2017, 31: 348-354. DOI:10.1089/end.2016.0639 |
| [4] |
REISIGER K, VENKATESH R, FIGENSHAU R S, BAE K T, LANDMAN J. Complex laparoscopic partial nephrectomy for renal hilar tumors[J]. Urology, 2005, 65: 888-891. DOI:10.1016/j.urology.2004.11.026 |
| [5] |
DULABON L M, KAOUK J H, HABER G P, BERKMAN D S, ROGERS C G, PETROS F, et al. Multi-institutional analysis of robotic partial nephrectomy for hilar versus nonhilar lesions in 446 consecutive cases[J]. Eur Urol, 2011, 59: 325-330. DOI:10.1016/j.eururo.2010.11.017 |
| [6] |
袁建林, 孟平, 杨晓剑, 王延柱, 秦卫军, 张运涛, 等. 经腹腔和后腹腔入路机器人辅助腹腔镜下肾部分切除术治疗肾门肿瘤的临床研究[J]. 中华泌尿外科杂志, 2017, 38: 502-506. DOI:10.3760/cma.j.issn.1000-6702.2017.07.006 |
| [7] |
EYRAUD R, LONG J A, SNOW-LISY D, AUTORINO R, HILLYER S, KLINK J, et al. Robot-assisted partial nephrectomy for hilar tumors:perioperative outcomes[J]. Urology, 2013, 81: 1246-1251. DOI:10.1016/j.urology.2012.10.072 |
| [8] |
LU S Y, CHUNG H J, HUANG E Y, LIN T P, LIN A T L. The perioperative outcomes between renal hilar and non-hilar tumors following robotic-assisted partial nephrectomy (RAPN)[J]. J Chin Med Assoc, 2018, 81: 676-681. |
| [9] |
KUTIKOV A, UZZO R G. The R.E.N.A.L. nephrometry score:a comprehensive standardized system for quantitating renal tumor size, location and depth[J]. J Urol, 2009, 182: 844-853. DOI:10.1016/j.juro.2009.05.035 |
| [10] |
杨俊, 管维, 胡嘏, 王志华, 胡志全, 王少刚. 机器人时代肾部分切除术手术适应证的优化选择(附单术者85例报告)[J]. 微创泌尿外科杂志, 2017, 6: 19-23. |
| [11] |
吕香君, 张旭, 马鑫, 李宏召, 李新涛, 艾青, 等. 经后腹腔入路机器人肾部分切除术手术经验和临床疗效总结(附单中心189例病例报道)[J]. 微创泌尿外科杂志, 2016, 5: 65-68. DOI:10.3969/j.issn.2095-5146.2016.02.001 |
| [12] |
HUNG A J, CAI J, SIMMONS M N, GILL I S. "Trifecta" in partial nephrectomy[J]. J Urol, 2013, 189: 36-42. DOI:10.1016/j.juro.2012.09.042 |
| [13] |
GILL I S, COLOMBO J R Jr, FRANK I, MOINZADEH A, KAOUK J, DESAI M. Laparoscopic partial nephrectomy for hilar tumors[J]. J Urol, 2005, 174: 850-854. DOI:10.1097/01.ju.0000169493.05498.c3 |
| [14] |
LATTOUF J B, BERI A, D'AMBROS O F, GRÜLL M, LEEB K, JANETSCHEK G. Laparoscopic partial nephrectomy for hilar tumors:technique and results[J]. Eur Urol, 2008, 54: 409-416. DOI:10.1016/j.eururo.2008.04.007 |
| [15] |
ABREU A L, GILL I S, DESAI M M. Zero-ischaemia robotic partial nephrectomy (RPN) for hilar tumours[J]. BJU Int, 2011, 108(6 Pt 2): 948-954. |
| [16] |
MIYAKE H, HINATA N, IMAI S, FURUKAWA J, TANAKA K, FUJISAWA M. Partial nephrectomy for hilar tumors:comparison of conventional open and robot-assisted approaches[J]. Int J Clin Oncol, 2015, 20: 808-813. DOI:10.1007/s10147-015-0783-x |
| [17] |
MALKOÇ E, MAURICE M J, KARA Ö, RAMIREZ D, NELSON R J, DAGENAIS J, et al. Predictors of positive surgical margins in patients undergoing partial nephrectomy:a large single-center experience[J]. Turk J Urol, 2019, 45: 17-21. DOI:10.5152/tud.2018.57767 |
| [18] |
SHIM M, SONG C, PARK S, KIM A, CHOI S K, KIM C S, et al. Hilar location is an independent prognostic factor for recurrence in T1 renal cell carcinoma after nephrectomy[J]. Ann Surg Oncol, 2015, 22: 344-350. DOI:10.1245/s10434-014-4153-0 |
| [19] |
CACCIAMANI G E, GILL T, MEDINA L, ASHRAFI A, WINTER M, SOTELO R, et al. Impact of host factors on robotic partial nephrectomy outcomes:comprehensive systematic review and meta-analysis[J]. J Urol, 2018, 200: 716-730. |
| [20] |
KARA Ö, MAURICE M J, MOURACADE P, MALKOÇ E, DAGENAIS J, NELSON R J, et al. When partial nephrectomy is unsuccessful:understanding the reasons for conversion from robotic partial to radical nephrectomy at a tertiary referral center[J]. J Urol, 2017, 198: 30-35. DOI:10.1016/j.juro.2017.01.019 |
| [21] |
POTRETZKE A M, KNIGHT B A, ZARGAR H, KAOUK J H, BAROD R, ROGERS C G, et al. Urinary fistula after robot-assisted partial nephrectomy:a multicentre analysis of 1791 patients[J]. BJU Int, 2016, 117: 131-137. DOI:10.1111/bju.13249 |
 2020, Vol. 41
2020, Vol. 41


