在哺乳动物体内,内源性氢气是由未消化的食物在肠道厌氧菌的作用下发酵产生,通过血液循环到达肺部,最后随呼吸排出[1]。氢气与血红蛋白的结合力远小于氧气,不能被人体大量吸收,因此长久以来氢气都被认为是一种生理惰性气体,未引起研究人员的重视。直到1975年,Dole等[2]通过将患有鳞状细胞癌的无毛小鼠放于高压氢气舱内(8 MPa,2.5%氧气,97.5%氢气)发现氢气可消退皮肤肿瘤,氢气对疾病的治疗作用才逐渐被认识和接受。由于氢气易燃、易爆,实施氢气治疗往往需要在医院配备专门的设备和技术人员。富氢水是将一定浓度的氢气溶于水中制成的,其为氢气在疾病预防和治疗中的广泛应用奠定了更方便、安全可行的基础。近年来,富氢水在临床上的应用引起关注,研究表明富氢水可减轻缺血、缺氧脑组织氧化应激反应[3]、心脏缺血再灌注损伤[4]、肠缺血再灌注损伤[5]、急性胰腺炎等多种炎性状态[6],提示氢气具有较好的抗氧化和抗炎活性。本文就富氢水在炎症治疗中的作用及其对部分信号通路的调节机制作一综述。
1 富氢水对一些疾病炎性状态的治疗作用 1.1 类风湿关节炎Ishibashi等[7]研究发现,类风湿关节炎患者饮用高浓度(4~5 mg/L)富氢水(剂量为530 mL/d)连续4周后,血浆中8-羟基脱氧鸟苷(8-hydroxy-2 deoxyguanosine,8-OHdG)及CRP水平均降低,抗瓜氨酸化蛋白抗体(anti-citrufllinated protein/peptide autoantibody,ACPA)指标恢复正常,提示氢分子可通过减轻机体氧化应激反应及炎症反应,显著改善患者的关节炎症状。
1.2 结肠炎Chen等[8]给予结肠炎模型BALB/c小鼠腹腔注射富氢水(0.4 MPa下使氢气溶解于生理盐水6 h并达到饱和状态,现用现配,保证氢气浓度为0.6 mmol/L)和口服乳果糖,提高小鼠体内氢气含量,实验结果显示富氢水干预后小鼠结肠TNF-α、IL-1β、丙二醛(malondialdehyde,MDA)和髓过氧化物酶(myeloperoxidase,MPO)水平均降低,提示富氢水可通过降低炎性因子的表达水平减轻小鼠结肠炎症状。乳果糖可能是通过提高内源性氢气含量进而达到减轻小鼠结肠炎症状的效果。
1.3 胰腺炎Chen等[6]给予利用L-精氨酸诱导的急性胰腺炎SD大鼠尾静脉注射6 mL/kg富氢生理盐水(0.4 MPa下制得氢气饱和生理盐水,使用时氢气浓度稳定在0.6 mmol/L以上),结果表明,富氢水能降低急性胰腺炎大鼠的血清淀粉酶活性,抑制中性粒细胞浸润、脂质过氧化和胰腺组织水肿,进而减轻急性胰腺炎症状;此外,富氢水还能促进胰腺腺泡细胞增殖、抑制细胞凋亡和转录因子NF-кB激活。以上结果表明,富氢水可能通过抑制氧化应激、细胞凋亡和NF-кB激活促进胰腺腺泡细胞增殖,从而减轻急性胰腺炎炎性症状。Ren等[9]给予急性胰腺炎模型BALB/c小鼠腹腔注射富氢水(0.4 MPa条件下制备氢气饱和生理盐水,氢气浓度为0.6 mmol/L),结果表明富氢水通过降低小鼠NF-κB、TNF-α、IL-1β的水平发挥急性胰腺炎治疗效果,并推测其可能是通过抑制核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎性小体的激活而发挥抗炎活性。
张德庆等[10]给予SD大鼠胰胆管逆行注射5%牛磺胆酸钠建立急性重症胰腺炎模型,1 h后尾静脉注射5 mL/kg富氢水(0.4 MPa下制备氢气饱和生理盐水,氢气浓度为0.75 mmol/L)。通过检测血清中MDA、MPO、谷胱甘肽(glutathione,GSH)、TNF-α、IL-6、IL-18的含量及胰腺组织中TNF-α和细胞黏附分子1(cell adhesion molecule-1,CAM-1)的表达水平,发现富氢水可抑制重症急性胰腺炎引起的氧化应激损伤、炎性递质的释放,从而减轻病理损伤。
此外,富氢水对牙周炎[11]、急性肝损伤[12]和脓毒症[13]等也有一定的抗炎作用。
2 氢分子抗炎作用的分子机制 2.1 减轻机体氧化应激状态研究显示炎症与氧化应激相辅相成、互相促进从而构成恶性循环,这主要表现在以下2个方面:(1)炎症可触发细胞衰老,释放活性氧(reactive oxygen species, ROS)[14],过量的ROS则引发机体氧化应激;(2)ROS可通过上调NF-κB信号通路促进炎性因子TNF-α的合成[15],TNF-α可活化烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide-phosphate,NADPH)氧化酶的表达,促进NADPH合成ROS[16],进一步加重机体的炎症反应。
在氢分子抗氧化方面,研究发现氢分子可调节氧化应激标志物水平,降低MDA、4-羟基壬烯醛(4-hydroxynonenal,4-HNE)、8-OHdG、MPO等脂质过氧化产物水平,同时增加超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化酶的活性[13, 17-19]。此外,氢分子还能通过抑制细胞程序性死亡改善氧化应激损伤。有报道显示氢分子治疗可减少末端脱氧核苷酸转移酶阳性细胞的数量,同时抑制caspase-3和caspase-12的激活,进而降低或阻断细胞凋亡,表明氢分子具有抗氧化活性[18]。
值得注意的是,目前有研究证明氢分子具有选择性抗氧化作用,即常温、常压下体内氢分子不能与氧及活性相对弱且具有重要信号转导作用的ROS如超氧阴离子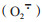
除具有选择性抗氧化活性外,氢气减轻炎症的机制还可能与其参与调节炎性基因的表达及相关信号转导通路有关。MAPK信号通路是真核生物细胞中重要的信号转导通路之一,主要包括ERK1/2、SAPK/JNK、p38-MAPK 3条途径,参与调控多种细胞生物学反应(增殖、分化及凋亡等)。其中p38-MAPK在转录和翻译水平参与了相关炎性介质的合成,是抗炎药物重要的作用靶点。
Cardinal等[22]在大鼠的肾脏移植实验中发现,肾移植后的大鼠口服富氢水不但可降低其炎性标志物TNF-α、IL-6、CAM-1和干扰素γ(interferon-γ,IFN-γ)等的mRNA表达水平,还可以通过抑制JNK、ERK1/2和p38等的活性抑制炎症相关的MAPK信号转导。Shi等[12]利用动物实验研究发现,富氢水可通过JNK和p38-MAPK信号通路抑制炎症和凋亡,从而减轻急性坏死性胰腺炎伴随的急性肝损伤症状。Guo等[23]构建严重烧伤SD大鼠模型,经腹腔注射富氢水(10 mL/kg)处理后,模型大鼠肾组织中MDA和MPO含量减少,内源性抗氧化酶活性提升,MPO水平和血清炎性介质的释放降低,其作用机制是氢通过清除氧自由基抑制ERK的磷酸化激活。Chen等[24]探究富氢水对颈动脉球囊损伤引起的内膜增生时发现,富氢水能抑制大鼠血管平滑肌细胞的增殖和迁移,增加血管平滑肌细胞的凋亡,并可通过抑制Ras-ERK1/2-MEK1/2通路和激活Akt通路缓解颈动脉球囊损伤。
2.2.2 抑制NF-κB信号通路NF-κB通常以无活性的二聚体形式存在,而炎症刺激会激活NF-κB信号通路,被激活的NF-κB迅速转移至细胞核内,促进细胞调节因子、趋化因子、细胞黏附分子、免疫受体及炎症级联反应多种酶的转录和表达,因此NF-κB也被认为是免疫系统的中心调节物。
惠康丽等[25]使用SD大鼠建立血管阻塞全脑缺血再灌注模型,建模同时给予腹腔注射富氢水(5 mL/kg),发现再灌注24 h后富氢水可降低大鼠海马区域TNF-α水平和NF-κB免疫组织化学染色阳性细胞数,提示富氢水可通过减轻促炎因子TNF-α的表达抑制炎性蛋白激酶信号NF-κB的转导,缓解大鼠全脑缺血后再灌注时脑组织的炎性反应。同样,Li等[26]也通过腹腔注射给予全脑缺血再灌注损伤大鼠富氢水,分别在注射后6、24、96 h检测NF-κB、TGF-β1、TNF-α的表达和调节性T淋巴细胞的数量,结果发现全脑缺血再灌注损伤大鼠NF-κB和TNF-α表达上调、TGF-β1表达下调、调节性T淋巴细胞数量减少,而富氢水干预后可以很好地逆转这种趋势,有效促进大鼠脑复苏,进一步证实了富氢水缓解全脑缺血再灌注损伤炎症反应的作用与抑制NF-κB信号转导通路密切相关。Wang等[27]采用心室一次注射β-淀粉样蛋白(amyloid-β,Aβ)诱导SD大鼠阿尔茨海默病模型,每日给予大鼠注射富氢水(5 mL/kg),结果发现富氢水可通过降低大脑海马区IL-1β、JNK和NF-κΒ蛋白的表达水平及8-OHdG的含量减轻阿尔茨海默病引起的神经炎症反应。
2.2.3 调节其他细胞信号通路Liu等[28]研究发现,在脂多糖诱发的视网膜病变小胶质细胞模型中,富氢水处理后miRNA-9、miRNA-21、miRNA-199和髓样分化因子88(myeloid differentiation factor 88,Myd88)表达量下调。其中Myd88是一类特殊的接头分子,其羧基端与Toll样受体4(Toll-like receptor 4,TLR4)的TIR区域结合而活化。活化后的Myd88可以激活细胞质内的炎性因子受体,并通过TGF-β激酶与IKK信号连接,最终使NF-κB进入到细胞核中介导炎性细胞因子的激活[29],提示富氢水可通过下调TLR4炎性信号通路和调控炎性介质的表达减轻脂多糖诱导的眼部损伤。
另有研究发现,富氢水能直接中和过量ROS,减轻Aβ诱导的细胞凋亡,通过激活组蛋白/非组蛋白去乙酰化酶(silencing information regulator 1,SIRT1)-AMP依赖的蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)信号通路,上调叉头框蛋白O3a(forkhead box O3a,FOXO3a)的表达,减轻Aβ诱导的线粒体膜电位损失[30]。其中,FOX转录因子在调控机体生长发育、代谢、细胞周期、凋亡等方面具有重要作用,去磷酸化状态的FOXO3a可促进神经细胞凋亡,在PI3K-Akt通路被激活时亦发挥重要作用[31];SIRT1在抵抗炎症反应、氧化应激等方面均发挥重要作用[32]。
3 小结已有大量研究证明,在不同的病理状态下富氢水可通过多种机制发挥抗炎作用。与传统的炎症治疗药物相比,富氢水或氢饱和生理盐水具有以下优点:(1)在临床和动物实验中不存在使用过量的情况,目前尚未发现氢气不良反应的相关报道;(2)氢气可选择性清除细胞毒性较强的·OH、ONOO-等ROS,而不影响细胞毒性较弱的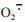
虽然关于富氢水治疗炎症的研究初步提示氢分子具有抑制炎症的潜能,但尚有诸多问题需要解决,如富氢水治疗肥胖和其他代谢性疾病相关的药物动力学,包括最佳干预剂量和干预方式等。此外,还需要利用动物实验和临床研究从不同层次深入研究富氢水对不同疾病炎症的作用,并运用分子生物学方法阐明氢分子在信号转导通路或蛋白水平调控的作用机制,为临床广泛应用富氢水提供更多的理论基础。
| [1] |
谭永星. 氢气医学及其对神经系统性疾病治疗作用的研究进展[J]. 华夏医学, 2016, 29: 193-197. |
| [2] |
DOLE M, WILSON F R, FIFE W P. Hyperbaric hydrogen therapy: a possible treatment for cancer[J]. Science, 1975, 190: 152-154. DOI:10.1126/science.1166304 |
| [3] |
BAI X, LIU S, YUAN L, XIE Y, LI T, WANG L, et al. Hydrogen-rich saline mediates neuroprotection through the regulation of endoplasmic reticulum stress and autophagy under hypoxia-ischemia neonatal brain injury in mice[J]. Brain Res, 2016, 1646: 410-417. DOI:10.1016/j.brainres.2016.06.020 |
| [4] |
ZHANG G, GAO S, LI X, ZHANG L, TAN H, XU L, et al. Pharmacological postconditioning with lactic acid and hydrogen rich saline alleviates myocardial reperfusion injury in rats[J/OL]. Sci Rep, 2015, 5: 9858. doi: 10.1038/srep09858.
|
| [5] |
SHIGETA T, SAKAMOTO S, LI X K, CAI S, LIU C, KUROKAWA R, et al. Luminal injection of hydrogen-rich solution attenuates intestinal ischemia-reperfusion injury in rats[J]. Transplantation, 2015, 99: 500-507. DOI:10.1097/TP.0000000000000510 |
| [6] |
CHEN H, SUN Y P, LI Y, LIU W W, XIANG H G, FAN L Y, et al. Hydrogen-rich saline ameliorates the severity of L-arginine-induced acute pancreatitis in rats[J]. Biochem Biophys Res Commun, 2010, 393: 308-313. DOI:10.1016/j.bbrc.2010.02.005 |
| [7] |
ISHIBASHI T, SATO B, RIKITAKE M, SEO T, KUROKAWA R, HARA Y, et al. Consumption of water containing a high concentration of molecular hydrogen reduces oxidative stress and disease activity in patients with rheumatoid arthritis: an open-label pilot study[J/OL]. Med Gas Res, 2012, 2: 27. doi: 10.1186/2045-9912-2-27.
|
| [8] |
CHEN X, ZHAI X, SHI J, LIU W W, TAO H, SUN X, et al. Lactulose mediates suppression of dextran sodium sulfate-induced colon inflammation by increasing hydrogen production[J]. Dig Dis Sci, 2013, 58: 1560-1568. DOI:10.1007/s10620-013-2563-7 |
| [9] |
REN J D, MA J, HOU J, XIAO W J, JIN W H, WU J, et al. Hydrogen-rich saline inhibits NLRP3 inflammasome activation and attenuates experimental acute pancreatitis in mice[J/OL]. Mediators Inflamm, 2014, 2014: 930894. doi: 10.1155/2014/930894.
|
| [10] |
张德庆, 祝建红. 静脉注射含饱和氢气生理盐水对大鼠急性重症胰腺炎的作用及其机制[J]. 中华医学杂志, 2012, 92: 2436-2440. |
| [11] |
KASUYAMA K, TOMOFUJI T, EKUNI D, TAMAKI N, AZUMA T, IRIE K, et al. Hydrogen-rich water attenuates experimental periodontitis in a rat model[J]. J Clin Periodontol, 2011, 38: 1085-1090. DOI:10.1111/j.1600-051X.2011.01801.x |
| [12] |
SHI Q, CHEN C, DENG W H, WANG P, ZUO T, ZHAO L, et al. Hydrogen-rich saline attenuates acute hepatic injury in acute necrotizing pancreatitis by inhibiting inflammation and apoptosis, involving JNK and p38 mitogen-activated protein kinase-dependent reactive oxygen species[J]. Pancreas, 2016, 45: 1424-1431. DOI:10.1097/MPA.0000000000000678 |
| [13] |
XIE K, YU Y, PEI Y, HOU L, CHEN S, XIONG L, et al. Protective effects of hydrogen gas on murine polymicrobial sepsis via reducing oxidative stress and HMGB1 release[J]. Shock, 2010, 34: 90-97. DOI:10.1097/SHK.0b013e3181cdc4ae |
| [14] |
JURK D, WILSON C, PASSOS J F, OAKLEY F, CORREIA-MELO C, GREAVES L, et al. Chronic inflammation induces telomere dysfunction and accelerates ageing in mice[J/OL]. Nat Commun, 2014, 2: 4172. doi: 10.1038/ncomms5172.
|
| [15] |
PAN W, YU H, HUANG S, ZHU P. Resveratrol protects against TNF-α-induced injury in human umbilical endothelial cells through promoting sirtuin-1-induced repression of NF-κB and p38 MAPK[J/OL]. PLoS One, 2016, 11: e0147034. doi: 10.1371/journal.pone.0147034.
|
| [16] |
BABU D, LECLERCQ G, GOOSSENS V, VANDEN BERGHE T, VAN HAMME E, VANDENABEELE P, et al. Mitochondria and NADPH oxidases are the major sources of TNF-α/cycloheximide-induced oxidative stress in murine intestinal epithelial MODE-K cells[J]. Cell Signal, 2015, 27: 1141-1158. DOI:10.1016/j.cellsig.2015.02.019 |
| [17] |
SUN Q, KAWAMURA T, MASUTANI K, PENG X, SUN Q, STOLZ D B, et al. Oral intake of hydrogen-rich water inhibits intimal hyperplasia in arterialized vein grafts in rats[J]. Cardiovasc Res, 2012, 94: 144-153. DOI:10.1093/cvr/cvs024 |
| [18] |
OHARAZAWA H, IGARASHI T, YOKOTA T, FUJⅡ H, SUZUKI H, MACHIDE M, et al. Protection of the retina by rapid diffusion of hydrogen: administration of hydrogen-loaded eye drops in retinal ischemia-reperfusion injury[J]. Invest Ophthalmol Vis Sci, 2010, 51: 487-492. DOI:10.1167/iovs.09-4089 |
| [19] |
CUI W, GAO C, FANG P, LIN G, SHEN W. Alleviation of cadmium toxicity in Medicago sativa by hydrogen-rich water[J]. J Hazard Mater, 2013, 260: 715-724. DOI:10.1016/j.jhazmat.2013.06.032 |
| [20] |
OHSAWA I, ISHIKAWA M, TAKAHASHI K, WATANABE M, NISHIMAKI K, YAMAGATA K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13: 688-694. DOI:10.1038/nm1577 |
| [21] |
HIRAOKA A, INABA H, SUZUKI E, KASAI K, SUZUKI H, SHINOHARA A, et al. In vitro physicochemical properties of neutral aqueous solution systems (water products as drinks) containing hydrogen gas, 2-carboxyethyl germanium sesquioxide, and platinum nanocolloid as additives[J]. J Health Sci, 2010, 56: 167-174. DOI:10.1248/jhs.56.167 |
| [22] |
CARDINAL J S, ZHAN J, WANG Y, SUGIMOTO R, TSUNG A, MCCURRY K R, et al. Oral hydrogen water prevents chronic allograft nephropathy in rats[J]. Kidney Int, 2010, 77: 101-109. DOI:10.1038/ki.2009.421 |
| [23] |
GUO S X, FANG Q, YOU C G, JIN Y Y, WANG X G, HU X L, et al. Effects of hydrogen-rich saline on early acute kidney injury in severely burned rats by suppressing oxidative stress induced apoptosis and inflammation[J/OL]. J Transl Med, 2015, 13: 183. doi: 10.1186/s12967-015-0548-3.
|
| [24] |
CHEN Y, JIANG J, MIAO H, CHEN X, SUN X, LI Y. Hydrogen-rich saline attenuates vascular smooth muscle cell proliferation and neointimal hyperplasia by inhibiting reactive oxygen species production and inactivating the Ras-ERK1/2-MEK1/2 and Akt pathways[J]. Int J Mol Med, 2013, 31: 597-606. DOI:10.3892/ijmm.2013.1256 |
| [25] |
惠康丽, 韩云飞, 周玉弟, 李丹, 苗晓蕾, 嵇晴, 等. 富氢液对大鼠全脑缺血再灌注损伤的影响[J]. 医学研究生学报, 2011, 24: 573-577. DOI:10.3969/j.issn.1008-8199.2011.06.004 |
| [26] |
LI Q, YU P, ZENG Q, LUO B, CAI S, HUI K, et al. Neuroprotective effect of hydrogen-rich saline in global cerebral ischemia/reperfusion rats: up-regulated tregs and down-regulated miR-21, miR-210 and NF-κB expression[J]. Neurochem Res, 2016, 41: 2655-2665. DOI:10.1007/s11064-016-1978-x |
| [27] |
WANG C, LI J, LIU Q, YANG R, ZHANG J H, CAO Y P, et al. Hydrogen-rich saline reduces oxidative stress and inflammation by inhibit of JNK and NF-κB activation in a rat model of amyloid-beta-induced Alzheimer's disease[J]. Neurosci Lett, 2011, 491: 127-132. DOI:10.1016/j.neulet.2011.01.022 |
| [28] |
LIU G D, ZHANG H, WANG L, HAN Q, ZHOU S F, LIU P. Molecular hydrogen regulates the expression of miR-9, miR-21 and miR-199 in LPS-activated retinal microglia cells[J]. Int J Ophthalmol, 2013, 6: 280-285. |
| [29] |
JIANG Q, YI M, GUO Q, WANG C, WANG H, MENG S, et al. Protective effects of polydatin on lipopolysaccharide-induced acute lung injury through TLR4-MyD88-NF-κB pathway[J]. Int Immunopharmacol, 2015, 29: 370-376. DOI:10.1016/j.intimp.2015.10.027 |
| [30] |
LIN C L, HUANG W N, LI H H, HUANG C N, HSIEH S, LAI C, et al. Hydrogen-rich water attenuates amyloid β-induced cytotoxicity through upregulation of Sirt1-FoxO3a by stimulation of AMP-activated protein kinase in SK-N-MC cells[J]. Chem Biol Interact, 2015, 240: 12-21. DOI:10.1016/j.cbi.2015.07.013 |
| [31] |
NHO R S, HERGERT P. FoxO3a and disease progression[J]. World J Biol Chem, 2014, 5: 346-354. DOI:10.4331/wjbc.v5.i3.346 |
| [32] |
POLJSAK B, MILISAV I. NAD+ as the link between oxidative stress, inflammation, caloric restriction, exercise, DNA repair, longevity, and health span[J]. Rejuvenation Res, 2016, 19: 406-415. DOI:10.1089/rej.2015.1767 |
| [33] |
SAITOH Y, YOSHIMURA Y, NAKANO K, MIWA N. Platinum nanocolloid-supplemented hydrogendissolved water inhibits growth of human tongue carcinoma cells preferentially over normal cells[J]. Exp Oncol, 2009, 31: 156-162. |
 2020, Vol. 41
2020, Vol. 41


