2. 空军杭州特勤疗养中心疗养三区, 杭州 310002;
3. 长江航运总医院高压氧科, 武汉 430010;
4. 长江航运总医院CT室, 武汉 430010;
5. 长江航运总医院重症监护室, 武汉 430010;
6. 海军军医大学(第二军医大学)海军特色医学中心援潜救生医学与装备技术训练队, 上海 200433
2. The Third District of Air Force Special Service Sanatorium, Hangzhou 310002, Zhejiang, China;
3. Department of Hyperbaric Oxygen, General Hospital of the Yangtze River Shipping, Wuhan 430010, Hubei, China;
4. CT Room, General Hospital of the Yangtze River Shipping, Wuhan 430010, Hubei, China;
5. Intensive Care Unit, General Hospital of the Yangtze River Shipping, Wuhan 430010, Hubei, China;
6. Military Diving Rescue and Equipment Technique Training Center, Naval Special Medical Center, Naval Medical University (Second Military Medical University), Shanghai 200433, China
新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)已成为一种全球大流行的传染性疾病。由于缺乏特异性抗病毒药物, 支持治疗是其主要治疗方法[1]。临床研究证明, COVID-19死亡患者以肺实质的典型病理变化, 以及最终发生进行性低氧血症、高乳酸血症、急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)和急性呼吸衰竭等为特征[2-5]。鼻导管和面罩吸氧、无创和有创通气、体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)等常压氧疗方法被广泛用于COVID-19治疗, 但重型患者死亡率依然居高不下, 甚至有报道称超过60%[3]。这提示现有氧疗对某些重型COVID-19患者缺氧的纠治效果不理想。
高压氧治疗(hyperbaric oxygen therapy, HBOT)是目前最强的无创氧疗方法, 设备性能稳定, 治疗程序和技术成熟, 并且可以一次性同时治疗多例患者, 已被临床广泛用于各种疾病所致难治性缺氧的治疗。自2020年2月11日起, 我们在长江航运总医院高压氧科对5例因常压氧疗无法遏制进行性低氧血症的重型COVID-19患者施行HBOT, 治疗后患者症状缓解、病情改善。现分析该5例患者的临床数据, 探讨HBOT治疗重型COVID-19的潜在机制。
1 资料和方法 1.1 病例资料简述5例患者严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)核酸检测均为阳性, 胸部CT检查均存在典型肺部影像学改变。
患者1:男, 69岁, 因“发热1 d ”入院, 既往有高血压、冠状动脉粥样硬化性心脏病、急性心肌梗死、冠状动脉支架置入术后。药物治疗包括甲泼尼龙(40 mg每天2次)、Ig(20 g/d)、头孢曲松钠(3 g/d)、阿比多尔(0.2 g每天3次), 5 d为1个疗程, 共2个疗程。鼻导管吸氧(3~5 L/min)2 d、面罩吸氧(5~8 L/min)14 d无法控制低氧血症进行性发展。因患者拒绝执行机械通气医嘱, 入院后第21天开始给予HBOT共8次。首次HBOT返回病房后改鼻导管吸氧3 d, 后继续面罩吸氧15 d。
患者2:男, 64岁, 因“咳嗽、发热5 d ”入院。既往有高血压、冠状动脉粥样硬化性心脏病、糖尿病。药物治疗包括甲泼尼龙(40 mg每天2次)、Ig(20 g/d)、头孢曲松钠(3 g/d)、阿比多尔(0.2 g每天3次)、利巴韦林(0.5 g/d)、白蛋白(10 g/d)、头孢曲松(3 g/d)1个疗程。鼻导管吸氧(3~5 L/min)1 d、面罩吸氧(5~8 L/min)6 d, 低氧血症仍呈进行性恶化, 于入院后第12天开始HBOT共5次。首次HBOT返回病房后改鼻导管吸氧4 d, 后继续面罩吸氧5 d。
患者3:男, 28岁, 因“咳嗽、咳痰12 d, 发热、咽痛和胸痛10 d ”入院。药物治疗包括甲泼尼龙(40 mg每天2次)、Ig(20 g/d)、头孢曲松钠(3 g/d)、阿比多尔(0.2 g每天3次)、利巴韦林(0.5 g/d)1个疗程, 鼻导管吸氧(3~5 L/min)2 d、面罩吸氧(5~8 L/min)12 d、无创机械通气2 d, 但患者肺部影像学病灶发展迅速伴随低氧血症恶化;于入院第17天接受无创机械通气, 低氧血症未见好转。入院后第19天开始给予HBOT共4次。首次HBOT返回病房后, 继续面罩吸氧2 d。
患者4:男, 53岁, 因“咳嗽1周、发热3 d ”入院。药物治疗包括甲泼尼龙(40 mg每天2次)、Ig(20 g/d)、头孢曲松钠(3 g/d)、阿比多尔(0.2 g每天3次)、利巴韦林(0.5 g/d)1个疗程, 鼻导管吸氧(3~5 L/min)1 d、面罩吸氧(5~8 L/min)12 d, 患者病情继续恶化, 于入院18 d行HBOT共3次。首次HBOT返回病房后, 继续面罩吸氧7 d。
患者5:女, 24岁, 因“发热3 d ”入院。药物治疗包括甲泼尼龙(40 mg每天2次)、Ig(20 g/d)、头孢曲松钠(3 g/d)、阿比多尔(0.2 g每天3次)、利巴韦林(0.5 g/d), 鼻导管吸氧(3~5 L/min)1 d、面罩吸氧(5~8 L/min)12 d。入院第14天并发心肌炎, 于入院后第19天开始予HBOT共3次。首次HBOT返回病房后, 继续面罩吸氧9 d。
1.2 HBOT治疗过程采用高压氧舱系统(GY2800D-A型, 烟台宏远氧业股份有限公司)每天9:00-10:30进行1次HBOT。患者通过指定通道进入治疗舱, 换内置式呼吸系统(Built-in-Breathing System, BIBS)面罩呼吸纯氧, 整个治疗过程持续吸氧, 无空气呼吸间歇。15 min匀速加压至2.0 ATA(绝对大气压, 表压为0.1 MPa;患者1)、1.6 ATA(表压为0.06 MPa, 患者2~5), 维持90 min(首次治疗)或60 min(随后治疗), 然后20 min减压至常压。减压结束后, 患者经指定通道出舱离开, 返回病房。高气压暴露过程中舱内保持通风。
1.3 数据收集回顾电子病历、护士记录、临床检查并询问患者, 收集胸痛、呼吸急促(活动、静息或平卧时)等呼吸道症状, 恶心、腹泻、纳差等消化道症状, 病房连续监测数据中每4 h、舱旁加压前和减压后脉搏血氧饱和度(pulse oxygen saturation, SpO2), 动脉血气分析结果, 血常规, 凝血功能, 高敏C-反应蛋白(high-sensitivity C-reactive protein, hs-CRP), 以及胸部CT数据。根据患者自评结果将症状分为轻度、中度、重度, 分别赋值1~3, 并对其总和进行分析。
1.4 统计学处理应用SPSS 21.0软件进行统计学分析。数据以x±s表示, 治疗前后比较采用配对t检验。采用双侧检验, 检验水准(α)为0.05。
2 结果 2.1 HBOT前后临床表现HBOT前5例患者均有轻微发热和咳嗽症状, 但不严重且不持续。对5例患者症状评分总和进行分析, HBOT前有明显呼吸急促症状, 且有一定程度的胸痛和消化道症状, 首次HBOT后上述症状均开始缓解(图 1)。4次HBOT后平卧位呼吸急促症状消失, 5次后消化道症状完全消失, 仅残存轻微胸痛、静息和活动状态下的呼吸急促症状。虽然2例患者只进行了3次HBOT, 1例患者4次, 但症状均逐日改善。完成HBOT疗程后, 患者呼吸频率较HBOT前下降[(20.80±2.28)min-1 vs(27.20±5.40)min-1], 差异有统计学意义(t=4.355, P=0.012)。
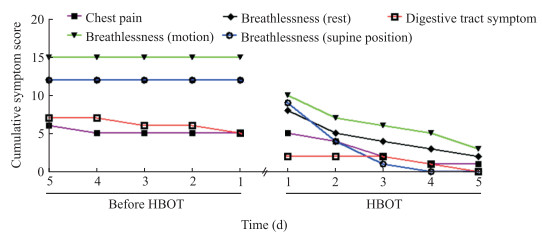
|
图 1 HBOT前后5例COVID-19患者症状评分总和的变化 Fig 1 Cumulative symptom score changes of five COVID-19 patients before and after HBOT HBOT: Hyperbaric oxygen therapy; COVID-19: Coronavirus disease 2019 |
2.2 无创血氧饱和度监测结果
如图 2所示, 病房监测5例患者的SpO2均为晨起时最低, 随后逐步升高, 夜间最高, 随着HBOT次数增加, 相同时间点的SpO2逐日升高, 日平均SpO2分别在第1次(患者5, 100%)、第2次(患者2, 95.40%)、第3次(患者3, 96.40%;患者4, 97.00%)、第6次(患者1, 96.80%)HBOT后恢复至95%以上。
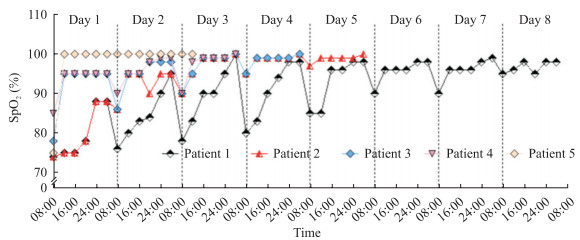
|
图 2 开始HBOT后5例COVID-19患者日间SpO2变化 Fig 2 Daily SpO2 changes of five COVID-19 patients after HBOT HBOT: Hyperbaric oxygen therapy; COVID-19: Coronavirus disease 2019; SpO2: Pulse oxygen saturation |
如图 3所示, 在每次HBOT加压前(9:00)和减压后即刻监测患者的SpO2发现, 首次HBOT加压前SpO2为(73.20±6.42)%, 较晨起时即8:00的(77.20±4.66)%更低。虽然5例患者在HBOT过程中SpO2均达到99%以上, 但首次HBOT减压后SpO2立即降至(93.60±0.07)%, 虽然与加压前比较升高(t=8.427, P=0.001), 但仍未达到正常参考值水平。回到病房后12:00患者的SpO2已经恢复到基础水平, 提示HBOT并没有使患者体内储存大量的氧。第2次和第3次HBOT加压前SpO2较首次加压前即刻相比均升高(t=7.333, P=0.002;t=5.489, P=0.005), 第3次HBOT加压前和减压后SpO2相比差异无统计学意义(t=4.083, P=0.055)。由于恢复良好, 日间SpO2连续2 d最低值均>95%, 2例患者仅接受了3次HBOT, 1例接受了4次HBOT, 第4天起数据样本量相应减少, 未再对加压前和减压后SpO2数据进行统计学分析。
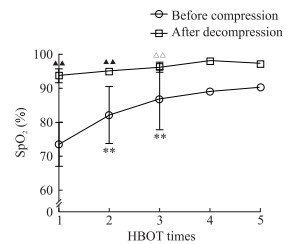
|
图 3 5例COVID-19患者每次HBOT加压前和减压后即刻SpO2变化 Fig 3 SpO2 changes of five COVID-19 patients immediately before and after HBOT therapy COVID-19: Coronavirus disease 2019 HBOT: Hyperbaric oxygen; SpO2: Pulse oxygen saturation. **P < 0.01 vs first day before compression; △△P < 0.01 vs first day after decompression; ▲▲P < 0.01 vs same day before compression. At the 1st-3rd HBOT n=5, x±s; at the 4th HBOT n=3, x; and at the 5th HBOT n=2, x |
2.3 动脉血气分析结果
开始每天1次的HBOT前, 5例患者在面罩吸氧条件下[吸入气氧分数(fractional inspired oxygen, FiO2)为0.4~0.6], 动脉血氧分压(arterial partial pressure of oxygen, PaO2)分别为37、65、60、78和68 mmHg(1 mmHg=0.133 kPa), 均处于中至重度呼吸衰竭状态。动脉血二氧化碳分压(arterial partial pressure of carbon dioxide, PaCO2)分别为30.4、37.0、30.0、32.0、28.0 mmHg, 除患者2外其余均低于正常值(正常参考值为35~45 mmHg)。由表 1可见, 动脉血氧饱和度(arterial oxygen saturation, SaO2)在开始每天1次的HBOT前明显低于正常值, 而HBOT疗程结束后显著上升, 恢复到正常值范围, 同时血乳酸水平也明显回降。提示机体因低氧血症存在一定程度的系统性无氧代谢。
|
|
表 1 COVID-19患者开始HBOT前和疗程结束后的动脉血气分析结果 Tab 1 Arterial blood gas analysis of COVID-19 patients before and after HBOT |
2.4 实验室检查结果
由表 2可见, 开始HBOT前淋巴细胞绝对值和淋巴细胞比例降低, 结束全部HBOT疗程后两者均回升(P均<0.05), 提示增加HBOT的整体疗效或许与细胞免疫功能改善有关;HBOT后中性粒细胞比例与HBOT前相比下降(P<0.05), 但中性粒细胞绝对值在HBOT前后差异无统计学意义(P>0.05)。开始HBOT前血纤维蛋白原和D-二聚体水平均升高, 而活化部分凝血活酶时间(activated partial thromboplastin time, APTT)缩短, 提示血液处于相对高凝状态, 是末梢循环障碍的表现。与HBOT前相比, 结束HBOT后纤维蛋白原水平降低(P<0.05), 同时D-二聚体水平回降、APTT延长但差异均无统计学意义(P均>0.05)。开始HBOT前血液hs-CRP水平为(30.36±1.27)mg/L, 结束全部HBOT后降低至(7.76±6.95)mg/L, 差异有统计学意义(t=7.148, P<0.01)。
|
|
表 2 COVID-19患者开始HBOT前和疗程结束后白细胞和凝血功能检查结果 Tab 2 White blood cell and coagulation function of COVID-19 patients before and after HBOT |
2.5 影像学检查结果
胸部CT检查显示, 5例患者HBOT前均有重型COVID-19典型肺部影像学改变, 双肺多发斑点状软组织密度影, 气管通畅, 双肺血管纹理增粗并见多发片状高密度影;完成全部HBOT后, 肺部病灶明显改善, 双肺多发软组织密度影和片状高密度影减少。典型图像见图 4。
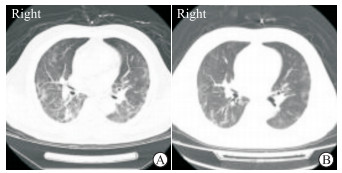
|
图 4 HBOT前后COVID-19患者胸部计算机断层扫描检查结果 Fig 4 Chest computed tomography imaging of COVID-19 patients before and after HBOT Patient 2. A: 1 d before HBOT; B: 2 d after HBOT for four times. HBOT: Hyperbaric oxygen therapy; COVID-19: Coronavirus disease 2019 |
3 讨论
HBOT是一种在高气压环境下实施的氧疗技术, 是临床氧疗方法的一种。虽然国内外临床HBOT共识推荐了多种疾病作为HBOT适应证[5-6], 但除了气泡栓塞性疾病外, HBOT对其他多种疾病是通过高分压氧对症治疗局部或全身、急性或慢性、炎症性或缺血性缺氧而发挥治疗作用的。而在气泡栓塞性疾病中, 压强升高压缩气泡的作用更为重要。常压氧疗技术, 如鼻导管给氧、面罩吸氧、高流量吸氧, 甚至机械通气和ECMO, 均以缺氧症或呼吸功能障碍为适应证, 并不是采用疾病病种罗列适应证。HBOT作为临床氧疗技术之一亦不例外, 缺氧症是其唯一适应证。
氧疗的目的是为机体全身组织提供充足的氧气。氧从环境大气中运输到机体组织细胞需要经过肺通气、肺泡气体交换、血红蛋白运载和血流运输、微循环和组织气体交换等环节。任何一个环节功能障碍均可引起氧输送异常。相比常压氧疗, HBOT大幅度提高了吸入气氧分压, 增加了氧的弥散距离、扩散速率和体内的物理溶解量, 在克服氧输送各个环节的功能障碍方面有明显优势, 因此HBOT可能是解决重型COVID-19患者进行性低氧血症的最佳氧疗方法[7-8]。本组5例患者均在常压给氧无法控制进行性低氧血症的情况下开始HBOT, 并且均在首次HBOT后症状改善, 低氧血症被逆转, 整体病情也逐日好转。
近期研究显示, COVID-19的主要病理变化是肺泡的炎症反应[9], 提示患者的肺泡换气功能障碍可能比肺通气功能障碍更突出。本组5例患者资料也证明了这一观点, HBOT前PaO2和SaO2均降低, 但PaCO2未升高, 平均值甚至稍低于正常参考值, 提示患者存在过度通气。这说明对于合并进行性低氧血症的重型COVID-19患者, 仅增加通气功能, 如机械通气, 不会改善缺氧症状, 甚至可能会加重呼吸性碱中毒。Girard和Bernard[10]通过文献综述发现机械通气对呼吸道损伤和继发感染有促进作用。而接受HBOT的患者在自然呼吸状态不存在明显的呼吸道损伤。HBOT时高分压氧的弥散距离和扩散速率增加, 克服了病毒感染导致肺泡炎症使气血屏障增厚而造成的肺泡换气功能障碍。本组5例患者HBOT后即刻平均SpO2为93.60%, 高于90%, 也证实了HBOT的这一优势, 尤其是患者3, 无创机械通气2 d并没有改善低氧血症, 而首次HBOT出舱后SpO2显著上升。氧合指数(oxygenation index, OI;OI=PaO2/FiO2)是机械通气给氧效率的评价指标。环境气体压强不同时, 采用“ FiO2×环境气体压强/760 ”进行校正, 其中环境气体压强与常压(760 mmHg)的比值即高气压医学采用ATA计量的绝对压强, 常压为1 ATA。升高PaO2是氧疗的目标, 上述公式可转换为PaO2=OI×FiO2×绝对压强。机械通气通过提高OI升高PaO2, 常压给氧是通过提高FiO2, 而HBOT是通过提高绝对压强(ATA)。根据HBOT暴露压强不同, 绝对压强介于1.6~2.8 ATA。表明在FiO2相同的条件下, HBOT的PaO2提升效果与机械通气下OI增加1.6~2.8倍相同。因此, 就给氧效率而言, 如果机械通气OI不能超过自然呼吸的1.5倍则适合进一步采用HBOT。这一理论或许解释了临床报道中机械通气对重型COVID-19患者疗效不佳[2-4], 而本组5例患者HBOT纠治缺氧效果显著的原因。
每天1次HBOT短时间纠治缺氧不能解释整体病情的持续改善。运动医学文献报道, 存在心肺疾患的个体, 运动更容易导致“氧债”累积[11]。本组病例HBOT加压前即刻SpO2低于之前病房监测结果, 这一现象表明从病房转移到高压氧舱的轻微活动加重了COVID-19患者心肺功能的失代偿程度, 而患者严重的心肺功能障碍导致的低氧供不能满足机体疾病状态下高代谢所需的氧耗, 导致机体处于以无氧代谢为主的持续“氧债”累积状态。减压后即刻SpO2监测结果显示, 多数患者1次HBOT后“氧债”并没有完全还清。但随着治疗次数增加, 加压前与减压后SpO2的差距越来越小, 提示患者“氧债”累积逐渐减小。这或许与运动医学中高强度间歇训练能有效提高机体无氧运动耐受能力类似。重型COVID-19患者遭受的持续性低氧血症, 导致机体处于氧供和氧需相对失衡的持续无氧代谢状态, HBOT提供了充分的有氧代谢间歇, 使机体获得了对持续无氧代谢状态更高的耐受能力。这或许能解释短时间的高压氧能够起持续改善作用的潜在机制。
临床研究表明, 淋巴细胞、CRP等异常是重型COVID-19患者的临床特征[4]。本组资料也提示, 开始HBOT前COVID-19患者同时存在hs-CRP水平升高与淋巴细胞变化, 而完成全部HBOT疗程后hs-CRP水平降低、淋巴细胞回升。并且完成全部HBOT疗程后CT检查显示, 肺部病变虽然有所改善, 但仍存在。这与症状在首次HBOT后缓解并随着HBOT疗程逐日消失及hs-CRP、凝血功能等检查结果不完全一致。提示重型COVID-19患者病情发展不能完全归因于病毒感染导致的肺组织炎症。机体的过度应激水平、末梢循环障碍、细胞免疫功能下降等变化更可能继发于低氧血症导致的系统性缺氧损伤, 系统性缺氧损伤或许是重型COVID-19患者病情恶化的主要原因。阻遏系统性缺氧的发展有利于降低机体应激水平和恢复免疫功能, 从而提高病毒清除能力。这或是HBOT虽然仅仅纠治了缺氧, 患者却获得了全面疗效的潜在原因。
本组病例淋巴细胞绝对值与最近临床研究报道重型COVID-19患者淋巴细胞绝对值为(0.62±0.37)×109/L[3]相近, 该文献报道淋巴细胞绝对值降低与重型患者死亡率(61.5%)相关。有研究认为, D-二聚体高于1.0 mg/L提示预后不良[12], 本组病例D-二聚体在HBOT前高达(1.84±1.29)mg/L。血液CRP增高也是重型COVID-19患者预后不良的灵敏指标[4]。本组病例没有检测其他细胞因子, 但hs-CRP的显著变化提示在常规治疗基础上增加HBOT或许对降低机体应激水平、阻止细胞因子风暴有益。在重型COVID-19死亡率居高不下的背景下, 上述与预后相关的指标均提示, 本组病例如果依然只按照常规治疗临床结局不可能如此一致、快速地好转。因此, 在常规治疗的基础上引入每天1次的HBOT或许可降低重型COVID-19患者的死亡率。
虽然HBOT用于COVID-19等传染性疾病时的预防与控制措施受到高度关注, 但并无技术性障碍。按照对室内空间疾病预防与控制的供暖和通风要求, 高压氧舱空气系统及其BIBS具备密闭的气体系统、单向气流控制系统、全新风通风系统、医患呼吸气体管路分离独立管理系统等特性, 优于传染病病房的通风系统。这些特性决定了氧舱内医护工作人员交叉感染的概率不会高于传染病病房。整体疾病预防与控制措施包括:高压氧舱内消毒和防护要求遵照传染病病房要求执行, 进舱医护人员副舱独立加压, 患者进舱后持续面罩呼吸;舱外遵照传染病科的疾病控制要求, 医用废气排气口采用消毒液过滤后排放, 并对周围10 m内区域进行管控[13-14]。本组5例重型COVID-19患者的HBOT共超过20舱次, 医护人员均全程陪舱且零感染。
综上所述, 持续性低氧血症诱发的全身性系统性缺氧或许是重型COVID-19患者病情恶化的主要原因。COVID-19的呼吸功能障碍以肺泡换气功能障碍为主, HBOT可能是纠治重型COVID-19患者常压给氧无法控制的进行性低氧血症的最佳手段, 疗效优于机械通气。HBOT为处于持续缺氧的机体组织提供了充足氧供的有氧代谢间歇, 有利于机体免疫功能、循环功能、应激水平的恢复, 从而促进病情好转。
志谢 衷心感谢参与本研究的5例患者;感谢长江航运总医院医护人员在HBOT过程中和数据采集方面给予的帮助;感谢解放军总医院第六医学中心孟激光副主任在呼吸系统疾病方面提供的专业指导和帮助;感谢海军军医大学(第二军医大学)海军特色医学中心陈双红教授、李卫鹏主任和上海市疾病控制中心田靓副主任医师在传染性疾病预防与控制方面提供的指导和帮助;感谢美国路易斯安那州立大学健康科学中心高压医学系Paul G. Harch博士提供的修改意见。
| [1] |
World Health Organization. Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected[EB/OL]. (2020-03-13)[2020-04-05]. https://www.who.int/docs/default-source/coronaviruse/clinical-management-of-novel-cov.pdf.
|
| [2] |
HUANG C, WANG Y, LI X, REN L, ZHAO J, HU Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395: 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [3] |
YANG X, YU Y, XU J, SHU H, XIA J, LIU H, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study[J/OL]. Lancet Respir Med, 2020. pii: S2213-2600(20)30079-5. doi: 10.1016/S2213-2600(20)30079-5.
|
| [4] |
CHEN N, ZHOU M, DONG X, QU J, GONG F, HAN Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study[J]. Lancet, 2020, 395: 507-513. DOI:10.1016/S0140-6736(20)30211-7 |
| [5] |
中国人民解放军总医院第六医学中心. 中华医学会高压氧分会关于"高压氧治疗适应证与禁忌证"的共识(2018版)[J]. 中华航海医学与高气压医学杂志, 2019, 26: 1-5. DOI:10.3760/cma.j.issn.1009-6906.2019.01.001 |
| [6] |
MATHIEU D, MARRONI A, KOT J. Tenth European Consensus Conference on Hyperbaric Medicine: recommendations for accepted and non-accepted clinical indications and practice of hyperbaric oxygen treatment[J]. Diving Hyperb Med, 2017, 47: 24-32. |
| [7] |
仲小玲, 陈锐勇, 牛香群, 陶晓岚, 梁奕, 唐艳超. 高压氧治疗老年危重型新型冠状病毒肺炎气管插管患者1例临床效果[J]. 第二军医大学学报, 2020, 41: 621-627. ZHONG X L, CHEN R Y, NIU X Q, TAO X L, LIANG Y, TANG Y C. Hyperbaric oxygen therapy in an elderly critical coronavirus disease 2019 patient with endotracheal intubation: clinical effect analysis[J]. Acad J Sec Mil Med Univ, 2020, 41: 621-627. |
| [8] |
仲小玲, 陶晓岚, 唐艳超, 陈锐勇.高压氧治疗对重症新型冠状病毒肺炎患者缺氧的纠治作用: 首例报道[J/OL].中华航海医学与高气压医学杂志, 2020.doi: 10.3760/cma.j.issn.1009-6906.2020.0001.
|
| [9] |
XU Z, SHI L, WANG Y, ZHANG J, HUANG L, ZHANG C, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020, 8: 420-422. DOI:10.1016/S2213-2600(20)30076-X |
| [10] |
GIRARD T D, BERNARD G R. Mechanical ventilation in ARDS: a state-of-the-art review[J]. Chest, 2007, 131: 921-929. DOI:10.1378/chest.06-1515 |
| [11] |
HOPKINS S R. Exercise induced arterial hypoxemia: the role of ventilation-perfusion inequality and pulmonary diffusion limitation[J]. Adv Exp Med Biol, 2006, 588: 17-30. |
| [12] |
ZHOU F, YU T, DU R, FAN G, LIU Y, LIU Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study[J]. Lancet, 2020, 395: 1054-1062. DOI:10.1016/S0140-6736(20)30566-3 |
| [13] |
中华人民共和国国家卫生和计划生育委员会.经空气传播疾病医院感染预防与控制规范: WS/T 511—2016[S/OL].(2016-12-27)[2020-04-05].http://www.360doc.com/content/17/0108/12/11159824_620859744.shtml.
|
| [14] |
中华人民共和国卫生部.医院隔离技术规范: WS/T 311—2009[S/OL].(2009-04-01)[2020-04-05].http://www.nhc.gov.cn/wjw/s9496/200904/40116/files/3f2c129ec8d74c1ab1d40e16c1ebd321.pdf.
|
 2020, Vol. 41
2020, Vol. 41


