2. 海军军医大学(第二军医大学)基础医学院学员十二队, 上海 200433;
3. 海军军医大学(第二军医大学)长海医院神经外科, 上海 200433
2. The Twelfth Student Team, College of Basic Medical Sciences, Naval Medical University (Second Military Medical University), Shanghai 200433, China;
3. Department of Neurosurgery, Changhai Hospital, Naval Medical University (Second Military Medical University), Shanghai 200433, China
胶质瘤是起源于神经上皮的肿瘤, 其中胶质母细胞瘤是一种被WHO列为恶性程度Ⅳ级的极恶性星形细胞瘤, 目前其首选治疗方法为最大限度的手术切除联合放射治疗和(或)辅助性化学治疗等, 但治疗效果不佳[1]。国内外学者一直致力于探索改善胶质瘤治疗效果的新方法, 如光动力学治疗、免疫治疗及病毒治疗等[2-6], 但收效甚微。长链非编码RNA(long non-coding RNA, lncRNA)虽然不能编码蛋白质, 但对生命活动有序进行起着重要的调节作用, 参与人体几乎所有的生理和病理活动[7-8]。越来越多的研究表明, lncRNA在肿瘤细胞的增殖、侵袭和凋亡调控中也起着关键作用[9-12]。本研究拟探索胶质母细胞瘤中差异表达的lncRNA及其对肿瘤生长和侵袭的影响。
1 材料和方法 1.1 高通量杂交筛选选取2016—2017年海军军医大学(第二军医大学)长海医院收治的8例胶质母细胞瘤患者的手术切除肿瘤组织与瘤周正常脑组织(距离肿瘤边缘至少1 cm)。纳入标准:(1)年龄18~70岁;(2)首次发病, 未接受过放射治疗、化学治疗及其他治疗;(3)肿瘤位于非功能区;(4)术后病理提示为胶质母细胞瘤WHO Ⅳ级。本研究通过海军军医大学(第二军医大学)长海医院伦理委员会审批, 所有患者均签署知情同意书。
提取胶质母细胞瘤瘤体组织及对应瘤周正常脑组织总RNA, 用lncRNA芯片(Agilent-045142 Human SBC lncRNA v4 4X180K, 美国Agilent公司)进行高通量杂交, 筛选出肿瘤组织中差异表达的lncRNA。利用生物信息学软件BLAST进行序列比对分析。高通量测序由上海舜田生物科技有限公司完成。选取出差异表达的lncRNA后, 利用qRT-PCR检测其在肿瘤及瘤周正常脑组织中的表达情况, 进一步确定差异表达的结果。
1.2 LncRNA过表达与干扰表达胶质母细胞瘤细胞模型的建立人神经胶质瘤细胞系U87由海军军医大学(第二军医大学)长海医院神经外科实验室冻存并提供。构建lncRNA MIR210HG过表达质粒和干扰质粒, 转染U87细胞, 构建lncRNA MIR210HG过表达和干扰表达胶质母细胞瘤细胞模型, 以未转染U87细胞作为对照组。pLKO shRNA质粒、Gag-pol质粒、VSVG质粒、pMD2.G质粒和psPAX2质粒等均购自美国Addgene公司。
过表达lncRNA MIR210HG质粒的构建:使用全基因合成方法, 在lncRNA MIR210HG序列(上海尚亚生物科技有限公司合成)的前后两端各加入23个载体碱基, 经BglⅡ(日本TaKaRa公司)单酶切后, 利用重组酶进行重组连接获得MigR1-MIR210HG-GFP质粒(重组克隆试剂盒购自南京诺唯赞生物科技有限公司, 货号C112-02)。前端序列为5'-CTCTAGGCGCCGGAATT/AGATCT/-3'(AGATCT为酶切位点, 剩余部分为载体一致序列), 后端序列为5'-/AGATCT/CTCGAGGTTAACGAATT-3'(AGATCT为酶切位点, 剩余部分为载体一致序列)。
干扰表达lncRNA MIR210HG质粒的构建:将lncRNA MIR210HG序列导入在线基因扰动平台(https://portals.broadinstitute.org/gpp/public/), 设计2条干扰序列shRNA-1-F 5'-/CCGG/GTCAACA-CA……GTGTTGACTTTTTG-3'(CCGG为AgeⅠ酶切位点残基)和shRNA-1-R 5'-/AATTC/AAA-AAGTC……TGAACTGTGTTGAC-3'(AATTC为EcoRⅠ酶切位点残基)。干扰序列合成后连接到pLKO shRNA质粒上获得pLKO-MIR210HG质粒。
过表达质粒转染:将过表达质粒转染293T细胞。吸取500 μL opti-MEM培养液加至2 mL离心管, 然后依次加入MigR1-MIR210HG-GFP质粒15 μg、Gag-pol质粒9 μg和VSVG质粒6 μg, 震荡混匀。再吸取500 μL opti-MEM培养液至另一新的2 mL离心管, 加入75 μL LipofectamineTM 2000转染试剂, 混匀, 将混合液加至质粒离心管中, 用枪头打匀后室温静置20 min。然后逐滴滴加至293T细胞中, 继续培养4 h后换液。换液后继续培养48 h。
干扰表达质粒转染:将干扰表达质粒转染293T细胞。吸取500 μL opti-MEM培养液加至2 mL离心管, 然后依次加入pLKO-MIR210HG质粒15 μg、pMD2.G质粒6 μg和psPAX2质粒9 μg, 震荡混匀。再吸取500 μL opti-MEM培养液至另一新的2 mL离心管, 加入75 μL LipofectamineTM 2000转染试剂, 混匀。将混匀的转染试剂加至质粒离心管中, 用枪打匀后室温静置20 min。然后逐滴滴加至293T细胞中, 继续培养4 h后换液。换液后继续培养48 h。
细胞感染:细胞培养48 h后收集上清并用0.22 μm的过滤器进行过滤, 保存。感染前1 d将U87细胞传代, 待细胞贴壁生长至融合度约80%时进行感染。感染体系为病毒上清5 mL、新鲜培养液5 mL和聚乙烯(8 mg/mL)10 μL(10 cm培养皿)。混匀后加至U87细胞中, 感染过夜后换新鲜培养液, 继续培养48 h后收集细胞, 利用qRT-PCR检测过表达及干扰表达lncRNA MIR210HG效果。
1.3 qRT-PCR应用TRIzol法提取组织或细胞总RNA, 反转录获得cDNA。采用ViiATM 7实时荧光定量PCR系统(美国Applied Biosystems公司)进行荧光定量PCR, 反应体系为10 μL, 包括2×SYBR Premix Ex TaqTM试剂5 μL、ROX校正染料Ⅱ 0.2 μL、上游和下游引物各0.4 μL、cDNA模板2 μL、双蒸水2 μL。引物序列见表 1。使用ΔΔCt法计算Ct值, 目的基因Ct值减去内参基因Ct值即为目的基因的相对表达量。
|
|
表 1 qRT-PCR引物序列 Tab 1 Primer sequences for qRT-PCR |
1.4 细胞增殖能力检测
利用CCK-8检测试剂盒(上海翊圣生物科技有限公司)检测细胞增殖能力。将U87细胞以10 000/孔的密度接种于96孔板, 每组铺4~5个孔, 48 h后换成100 μL新鲜培养液, 然后每孔加入10 μL CCK-8试剂, 继续培养2 h, 将上清吸入另一新的96孔板, 测定450 nm波长处的光密度(D)值并分析, 得到相对细胞活性。相对细胞活性(%)=[(实验孔D值-对照孔D值)/(空白孔D值-对照孔D值)]×100%, 其中实验孔含细胞、培养液、CCK-8试剂和药物溶液, 对照孔含细胞、培养液和CCK-8试剂, 空白孔含培养液和CCK-8试剂。
1.5 细胞凋亡检测利用流式细胞术检测细胞凋亡情况, 细胞凋亡检测试剂盒购自上海翊圣生物科技有限公司。用胰蛋白酶消化、收集U87细胞, 加入250 μL结合缓冲液重悬细胞, 取100 μL细胞悬液加入5 mL流式管中, 加入5 μL Annexin Ⅴ-AlexaFluor 647和10 μL PI, 轻轻混匀。避光、室温反应15 min。加入400 μL结合缓冲液混匀, 1 h内上流式细胞仪检测。
1.6 细胞侵袭与迁移能力检测利用Transwell实验检测细胞侵袭和迁移能力。用胰蛋白酶消化U87细胞并计数, 用含5% FBS的培养液重悬细胞, 取50 000个细胞加入Transwell上室(侵袭实验上室需预先于37 ℃水化2 h)。下室加入含20% FBS的培养液, 放入培养箱继续培养48 h后放入5%结晶紫溶液中染色, 晾干后在显微镜下观察并拍照。
1.7 统计学处理应用SPSS 20.0软件进行统计学分析。各实验均设置3个生物学重复, 并平行处理3次, 数据以x±s表示, 胶质母细胞瘤组织与对应瘤周正常脑组织资料的比较采用配对t检验, 两组间比较采用独立样本t检验。检验水准(α)为0.05。
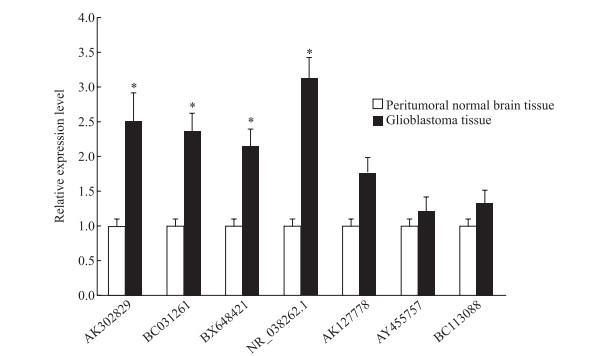
2 结果 2.1 高通量杂交筛选高通量筛选结果显示, 在胶质母细胞瘤组织及对应瘤周正常脑组织中差异表达的lncRNA有80个, 其中7个lncRNA(表 2)在胶质母细胞瘤组织中表达上调(差异表达倍数>2)。qRT-PCR验证结果(图 1)显示, lncRNA MIR210HG(NR_038262.1)的表达水平升高且差异表达最显著(差异表达倍数为3.12)。因此, 选择lncRNA MIR210HG进行后续研究。
|
|
表 2 7个在胶质母细胞瘤组织中表达上调的lncRNA Tab 2 Seven lncRNAs with upregulated expression in glioblastoma tissues |
|
图 1 胶质母细胞瘤中表达上调的lncRNA的qRT-PCR验证结果 Fig 1 LncRNAs with upregulated expression in glioblastoma tissues detected by qRT-PCR AK302829: cDNA FLJ51408 complete cds; BC031261: mRNA (cDNA clone MGC:39721 IMAGE:5273136); BX648421: cDNA DKFZp686A10250; NR_038262.1: lncRNA MIR210HG; AK127778: cDNA FLJ45879 fis; AY455757: DLEU2 RNA; BC113088: mRNA (cDNA clone IMAGE:40071744). lncRNA: Long non-coding RNA; qRT-PCR: Quantitative real-time polymerase chain reaction. *P < 0.05 vs peritumoral normal brain tissue group. n=8, x±s |
2.2 过表达和干扰表达lncRNA MIR210HG效果验证
qRT-PCR结果显示, 与对照组相比, U87细胞过表达lncRNA MIR210HG后lncRNA MIR210HG相对表达量升高(6.065±0.564 vs 0.943±0.113), 差异有统计学意义(t=15.41, P<0.01);干扰lncRNA MIR210HG表达后lncRNA MIR210HG相对表达量下降(0.199±0.035 vs 1.038±0.045), 差异有统计学意义(t=19.57, P<0.01), 证明lncRNA MIR210HG过表达和干扰表达效果显著, 可用于后续实验。
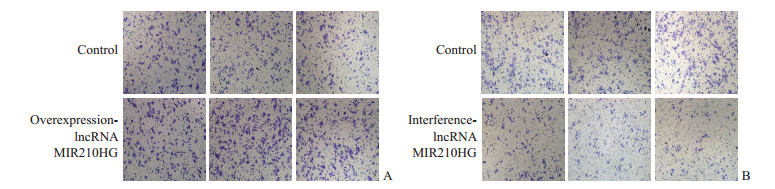
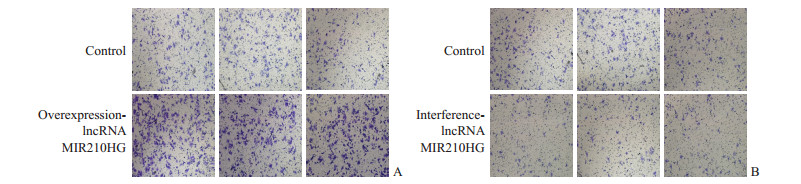
2.3 过表达和干扰表达lncRNA MIR210HG后细胞增殖、凋亡、侵袭和迁移情况CCK-8检测结果显示, 过表达lncRNA MIR210HG后U87细胞的增殖能力较对照组增强(1.325±0.035 vs 0.996±0.033), 差异有统计学意义(t=11.85, P<0.01);干扰lncRNA MIR210HG表达后U87细胞的增殖能力较对照组减弱(0.605±0.024 vs 0.998±0.025), 差异有统计学意义(t=19.57, P<0.01)。流式细胞术检测结果(图 2)显示, 过表达lncRNA MIR210HG后U87细胞凋亡水平与对照组相比下降, 凋亡细胞比例分别为(1.52±0.47)%和(4.73±0.46)%, 差异有统计学意义(t=8.413, P<0.05);干扰lncRNA MIR210HG表达后U87细胞凋亡水平与对照组相比上升, 凋亡细胞比例分别为(12.20±1.71)%和(5.24±0.45)%, 差异亦有统计学意义(t=6.820, P<0.05)。Transwell实验结果(图 3、图 4)显示, 过表达lncRNA MIR210HG后U87细胞侵袭、迁移能力均较对照组增强(1 175±118 vs 526±34、1 480±125 vs 556±56), 差异均有统计学意义(t=9.155、11.670, P均<0.05);而干扰lncRNA MIR210HG表达后U87细胞侵袭、迁移能力均较对照组下降(235±28 vs 486±23、372±57 vs 596±40), 差异均有统计学意义(t=11.880、6.319, P均<0.05)。

|
图 2 流式细胞术检测lncRNA MIR210HG对U87细胞凋亡情况的影响 Fig 2 Effect of lncRNA MIR210HG on apoptosis of U87 cells detected by flow cytometry A, B: The apoptosis of U87 cells transfected with control (A) and overexpression-lncRNA MIR210HG (B) plasmids; C, D: The apoptosis of U87 cells transfected with control (C) and interference-lncRNA MIR210HG (D) plasmids. lncRNA: Long non-coding RNA; PI: Propidium iodide |
|
图 3 Transwell实验检测lncRNA MIR210HG对U87细胞侵袭能力的影响 Fig 3 Effect of lncRNA MIR210HG on invasion of U87 cells detected by Transwell assay A: The invasion of U87 cells transfected with overexpression-lncRNA MIR210HG plasmids; B: The invasion of U87 cells transfected with interference-lncRNA MIR210HG plasmids. lncRNA: Long non-coding RNA. Original magnification: ×200 |
|
图 4 Transwell实验检测lncRNA MIR210HG对U87细胞迁移能力的影响 Fig 4 Effect of lncRNA MIR210HG on migration of U87 cells detected by Transwell assay A: The migration of U87 cells transfected with overexpression-lncRNA MIR210HG plasmids; B. The migration of U87 cells transfected with interference-lncRNA MIR210HG plasmids. lncRNA: Long non-coding RNA. Original magnification: ×200 |
3 讨论
胶质母细胞瘤细胞具有强大的增殖和侵袭能力, 即使在手术切除联合放射治疗和(或)化学治疗的规范治疗下, 患者生存期仍然不长[1], 因此胶质母细胞瘤细胞的凋亡、增殖和迁移一直是研究热点。近年来, lncRNA在人体生理和病理过程中的作用越来越受到重视, lncRNA可以对染色质进行修饰, 并在转录和转录后的生理过程中参与基因表达调控[13]。在胶质母细胞瘤中, 有关lncRNA的研究也取得了一定成果。有研究报道lncRNA SNHG12异常表达会导致胶质母细胞瘤出现耐药表型[14]。LncRNA CASC2在胶质瘤组织中的表达降低, 且与胶质瘤患者的生存时间缩短有关[15]。LncRNA MATN1-AS1可通过E2F转录因子6(E2F transcription factor 6, E2F6)抑制RELA和MAPK信号途径, 进一步抑制胶质母细胞瘤细胞的增殖和侵袭[16]。
我们在前期工作中, 利用生物信息学技术对胶质母细胞瘤瘤体和瘤周组织进行了高通量测序, 发现差异表达的lncRNA MIR210HG, 同时发现胶质母细胞瘤患者血清中lncRNA MIR210HG水平高于健康对照组, 因此认为其可能成为胶质母细胞瘤的生物学标志物[17]。有研究发现, lncRNA MIR210HG在宫颈癌和非小细胞肺癌中存在异常表达, 其可能通过影响上皮-间质转化(epithelial-mesenchymal transition, EMT)相关蛋白调控细胞的迁移能力, 从而促进肿瘤生长和侵袭[18-19]。本研究进一步探索了lncRNA MIR210HG对胶质母细胞瘤生长和侵袭的促进作用。通过构建lncRNA MIR210HG过表达和干扰表达质粒, 建立lncRNA MIR210HG过表达和干扰表达胶质母细胞瘤细胞模型, 利用CCK-8实验、流式细胞术和Transwell实验检测发现, 过表达lncRNA MIR210HG后胶质母细胞瘤细胞增殖能力提高、凋亡水平下降、侵袭和迁移能力增强, 而干扰lncRNA MIR210HG表达后胶质母细胞瘤细胞增殖能力下降、凋亡水平上升、侵袭和迁移能力下降。这证明lncRNA MIR210HG在胶质母细胞瘤的生长和侵袭中起着重要的调节作用。
综上所述, 我们认为lncRNA MIR210HG可以抑制胶质母细胞瘤细胞凋亡, 促进细胞增殖、侵袭和迁移, 但其具体调控机制有待深入研究。今后将lncRNA MIR210HG作为治疗胶质母细胞瘤的新靶点进一步研究, 可许可为胶质母细胞瘤的治疗提供新的方向。
| [1] |
ALEXANDER B M, CLOUGHESY T F. Adult glioblastoma[J]. ClinOncol, 2017, 35: 2402-2409. DOI:10.1200/JCO.2017.73.0119 |
| [2] |
LEROY H A, VERMANDEL M, VIGNION A S, LEROUX B, MAURAGE C A, DUHAMEL A, et al. Interstitial photodynamic therapy and glioblastoma: light fractionation in a preclinical model[J]. Lasers Surg Med, 2017, 49: 506-515. DOI:10.1002/lsm.22620 |
| [3] |
FAHEY J M, STANCILL J S, SMITH B C, GIROTTI A W. Nitric oxide antagonism to glioblastoma photodynamic therapy and mitigation thereof by BET bromodomain inhibitor JQ1[J]. J Biol Chem, 2018, 293: 5345-5359. DOI:10.1074/jbc.RA117.000443 |
| [4] |
LIM M, XIA Y X, BETTEGOWDA C, WELLE W. Current state of immunotherapy for glioblastoma[J]. Nat Rev Clin Oncol, 2018, 15: 422-442. DOI:10.1038/s41571-018-0003-5 |
| [5] |
SAHEBJAM S, SHARABI A, LIM M, KESARWANI P, CHINNAIYAN P. Immunotherapy and radiation in glioblastoma[J]. J Neurooncol, 2017, 134: 531-539. DOI:10.1007/s11060-017-2413-0 |
| [6] |
OTANI Y, YOO J Y, CHAO S, LIU J, JAIME-RAMIREZ A C, LEE T J, et al. Oncolytic HSV infected glioma cells activate NOTCH in adjacent tumor cells sensitizing tumors to gamma secretase inhibition[J]. Clin Cancer Res, 2020, 26: 2381-2392. DOI:10.1158/1078-0432.CCR-19-3420 |
| [7] |
SUN X D, THORNE R F, ZHANG X D, HE M, LI J M, FENG S S, et al. LncRNA GUARDIN suppresses cellular senescence through a LRP130-PGC1α-FOXO4-p21-dependent signaling axis[J/OL]. EMBO Rep, 2020, 21: e48796. doi: 10.15252/embr.201948796.
|
| [8] |
FERRE F, COLANTONI A, HELMER-CITTERICH M. Revealing protein-lncRNA interaction[J]. Brief Bioinform, 2016, 17: 106-116. DOI:10.1093/bib/bbv031 |
| [9] |
GHAFOURI-FARD S, SHOOREI H, BRANICKI W, TAHERI M. Non-coding RNA profile in lung cancer[J/OL]. Exp Mol Pathol, 2020, 114: 104411. doi: 10.1016/j.yexmp.2020.104411.
|
| [10] |
PAL S, GARG M, PANDEY A K. Deciphering the mounting complexity of the p53 regulatory network in correlation to long non-coding RNAs (lncRNAs) in ovarian cancer[J/OL]. Cells, 2020, 9: 527. doi: 10.3390/cells9030527.
|
| [11] |
CHEN S F, WANG G B, TAO K X, CAI K L, WU K, YE L, et al. Long noncoding RNA metastasis-associated lung adenocarcinoma transcript 1 cooperates with enhancer of zeste homolog 2 to promote hepatocellular carcinoma development by modulating the microRNA-22/Snail family transcriptional repressor 1 axis[J]. Cancer Sci, 2020, 111: 1582-1595. DOI:10.1111/cas.14372 |
| [12] |
KOLENDA T, GUGLAS K, KOPCZYŃSKA M, TERESIAK A, BLIŹNIAK R, MACKIEWICZ A, et al. Oncogenic role of ZFAS1 lncRNA in head and neck squamous cell carcinomas[J/OL]. Cells, 2019, 8: 366. doi: 10.3390/cells8040366.
|
| [13] |
GUPTA R A, SHAH N, WANG K C, KIM J, HORLINGS H M, WONG D J, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J]. Nature, 2010, 464: 1071-1076. DOI:10.1038/nature08975 |
| [14] |
LU C F, WEI Y T, WANG X F, ZHANG Z R, YIN J X, LI W T, et al. DNA-methylation-mediated activating of lncRNA SNHG12 promotes temozolomide resistance in glioblastoma[J/OL]. Mol Cancer, 2020, 19: 28. doi: 10.1186/s12943-020-1137-5.
|
| [15] |
LIAO Y, SHEN L, ZHAO H, LIU Q, FU J, GUO Y, et al. LncRNA CASC2 interacts with miR-181a to modulate glioma growth and resistance to TMZ through PTEN pathway[J]. J Cell Biochem, 2017, 118: 1889-1899. DOI:10.1002/jcb.25910 |
| [16] |
HAN N, YANG L, ZHANG X, ZHOU Y, CHEN R, YU Y, et al. LncRNA MATN1-AS1 prevents glioblastoma cell from proliferation and invasion via RELA regulation and MAPK signaling pathway[J/OL]. Ann Transl Med, 2019, 7: 784. doi: 10.21037/atm.2019.11.36.
|
| [17] |
MIN W, DAI D, WANG J, ZHANG D, ZHANG Y, HAN G, et al. Long noncoding RNA miR210HG as a potential biomarker for the diagnosis of glioma[J/OL]. PLoS One, 2016, 11: e0160451. doi: 10.1371/journal.pone.0160451.
|
| [18] |
WANG A H, JIN C H, CUI G Y, LI H Y, WANG Y, YU J J, et al. MIR210HG promotes cell proliferation and invasion by regulating miR-503-5p/TRAF4 axis in cervical cancer[J]. Aging, 2020, 12: 3205-3217. DOI:10.18632/aging.102799 |
| [19] |
KANG X, KONG F, HUANG K, LI L, LI Z, WANG X, et al. LncRNA MIR210HG promotes proliferation and invasion of non-small cell lung cancer by upregulating methylation of CACNA2D2 promoter via binding to DNMT1[J]. Onco Targets Ther, 2019, 12: 3779-3790. DOI:10.2147/OTT.S189468 |
 2020, Vol. 41
2020, Vol. 41


