2. 重庆医科大学附属儿童医院儿科研究所核酸蛋白实验室, 重庆 400014;
3. 重庆医科大学附属儿童医院儿科研究所儿童泌尿生殖发育与组织工程重点实验室, 重庆 400014
2. Nucleic Acid and Protein Laboratory, Institute of Pediatric Research, Children's Hospital of Chongqing Medical University, Chongqing 400014, China;
3. Chongqing Key Laboratory of Children Urogenital Development and Tissue Engineering, Institute of Pediatric Research, Children's Hospital of Chongqing Medical University, Chongqing 400014, China
目前麻醉药物对认知功能的影响已成为研究的重点。肥胖可加重麻醉导致的术后认知功能障碍[1]。丙泊酚作为临床麻醉最常用的药物, 对认知功能的影响尚无定论[2-3]。近年世界儿童肥胖的发病率日益增加, 麻醉药物对肥胖儿童认知功能的影响也成为麻醉医师关注的问题。中枢神经特异性蛋白S100钙结合蛋白β(S100 calcium-binding protein β, S100β)作为神经损伤的重要标志物, 与阿尔茨海默病、术后认知功能障碍等认知功能障碍性疾病密切相关[4-5]。有研究表明, 麻醉等因素可通过激活机体氧化应激促进氧化因子生成, 进一步引起认知功能损害[6]。核因子E2相关因子2/抗氧化反应元件(nuclear factor erythroid-derived 2-related factor 2/anti-oxidant response element, Nrf2/ARE)通路是机体抗氧化反应的中枢调节通路, 该通路中重要的抗氧化酶如血红素加氧酶1(heme oxygenase 1, HO-1)、超氧化物歧化酶1(superoxide dismutase 1, SOD1)通过抗氧化应激与清除氧自由基保护细胞免受氧化性损伤[7]。HO-1、SOD1等抗氧化因子功能异常会导致氧化-抗氧化失衡, 进而损伤认知功能[8-9]。丙泊酚是否会引起未成年肥胖大鼠认知功能损害?其机制是否与氧化-抗氧化失衡有关?本研究拟探讨丙泊酚对未成年肥胖大鼠认知功能的影响及其与Nrf2/ARE通路下游抗氧化因子HO-1、SOD1表达的关系。
1 材料和方法 1.1 动物选取3周龄雄性SD大鼠, 由重庆医科大学实验动物中心提供, 实验动物生产许可证号:SCXK(渝)2007-0001。
1.2 主要药品、试剂及实验器材丙泊酚注射液(意大利阿斯利康制药有限公司), 脂肪乳注射液(四川科伦药业股份有限公司), S100β ELISA检测试剂盒(武汉伊莱瑞特生物科技股份有限公司), HO-1抗体(英国Abcam公司), SOD1抗体(英国Abcam公司), 山羊抗兔二抗(北京中杉金桥生物技术有限公司), 显影液(美国Millipore公司), 高速低温离心机(美国Thermo公司), Morris水迷宫测试仪(北京硕林苑科技有限公司), 电泳仪(美国Bio-Rad公司)。
1.3 实验动物模型及分组取3周龄(刚断奶)健康雄性SD大鼠140只, 于SPF级动物房饲养。将大鼠随机分为基础饲料组(40只)和高脂饲料组(100只)。基础饲料组予基础饲料喂养, 高脂饲料组予高脂饲料(蛋白质、碳水化合物、脂肪分别占总热量的比例为20%、20%、60%)喂养。喂养4周后, 取高脂饲料组体质量≥基础饲料组平均体质量+1.4倍标准差的40只大鼠判定为肥胖建模成功。将基础饲料组大鼠随机分为正常脂肪乳组(NL组)、正常丙泊酚组(NP组), 将建模成功的40只肥胖大鼠随机分为肥胖脂肪乳组(OL组)、肥胖丙泊酚组(OP组), 每组均为20只。丙泊酚组腹腔注射丙泊酚100 mg/kg, 脂肪乳组(对照)腹腔注射脂肪乳100 mg/kg, 每天注射1次, 连续7 d。
1.4 Morris水迷宫实验检测大鼠空间学习记忆能力每组随机选取12只大鼠, 于最后1次给药后的第2天开始进行Morris水迷宫实验。测试前1 d让每只大鼠在无平台的水池游泳60 s适应环境。实验的第1~5天对各组大鼠进行定位航行实验, 将大鼠头朝池壁放入水池中, 记录60 s内找到平台的时间;若大鼠在60 s内未找到平台, 则将其引导至平台并停留学习10 s, 逃逸潜伏期记录为60 s;每只大鼠每天游泳4次, 从不同象限入水, 2次间隔15 min, 入水点第一、三、二、四象限和第四、二、三、一象限相互交替。实验第6天对各组大鼠进行空间探索实验, 撤除平台, 将大鼠从原平台对侧象限放入水中, 记录60 s内穿越平台次数及目标象限(第三象限)停留时间。
1.5 ELISA检测大鼠血浆S100β蛋白含量各组大鼠于最后1次麻醉后第2天, 眼眶取血4 mL, 置于肝素管内, 6 ℃ 2 400×g离心15 min取血浆, 采用ELISA检测试剂盒测定血浆中S100β的含量。
1.6 蛋白质印迹法检测大鼠海马组织中HO-1、SOD1蛋白表达随机选取1.5项取完眼眶血的大鼠5只, 断头法处死并取脑组织, 冰上迅速分离双侧海马组织用于HO-1、SOD1蛋白的蛋白质印迹分析。HO-1一抗(稀释比例1:1 000)、SOD1一抗(1:1 000)4 ℃摇动过夜标记;二抗(1:5 000)室温孵育60 min, 加入显影剂显影。以β-actin为内参照计算各目的蛋白的相对表达量。
1.7 H-E染色观察海马神经元情况随机选取1.5项取完眼眶血的大鼠3只, 断头法处死, 取脑组织, 石蜡包埋制作标本进行H-E染色。每只大鼠海马CA1区取5个不同视野, 在光学显微镜下观察视野内的神经元形态并计数(400倍)。
1.8 统计学处理应用SPSS 24.0软件进行统计学分析。呈正态分布的计量资料以x±s表示, 组间比较采用单因素方差分析, 两两比较采用LSD-t检验。检验水准(α)为0.05。
2 结果 2.1 各组大鼠Morris水迷宫实验结果 2.1.1 定位航行实验各组大鼠在第1~4天逃逸潜伏期均呈逐渐缩短趋势, 并于第4、5天趋于稳定。与NL组相比, NP组第1、2天逃逸潜伏期均延长, 差异均有统计学意义(t=-2.48、-2.48, P均<0.05);与OL组相比, OP组在第1~5天逃逸潜伏期均延长, 差异均有统计学意义(t=-2.19、-2.19、-2.16、-2.22、-4.78, P均<0.05)。见表 1。
|
|
表 1 各组水迷宫实验结果 |
2.1.2 空间探索实验
与OL组相比, OP组大鼠的60 s内第三象限停留时间及穿越平台次数均减少(t=5.24、4.31, P均<0.05);NP组与NL组大鼠的60 s内第三象限停留时间及穿越平台次数差异均无统计学意义(P均>0.05)。见表 1。
2.2 各组大鼠血浆中S100β蛋白含量ELISA检测结果显示, NL组、NP组、OL组、OP组大鼠血浆中S100β蛋白含量分别为(143.97±18.43)、(249.00±34.01)、(253.57±81.76)、(511.23±170.34)pg/mL。与OL组相比, OP组大鼠血浆S100β蛋白含量升高, 差异有统计学意义(t=-3.34, P<0.05);而NP组与NL组之间差异无统计学意义(P>0.05)。
2.3 各组大鼠海马组织中HO-1、SOD1蛋白表达水平比较NL组、NP组、OL组与OP组大鼠海马组织中HO-1蛋白相对表达量分别为1.28±0.45、1.12±0.13、1.01±0.06、0.67±0.03, SOD1蛋白相对表达量分别为0.91±0.14、0.84±0.13、0.75±0.11、0.45±0.06。与OL组比较, OP组大鼠海马组织中HO-1及SOD1蛋白相对表达量均降低, 差异均有统计学意义(t=9.36、4.21, P均<0.05);而NP组与NL组之间差异均无统计学意义(P均>0.05)。见图 1。
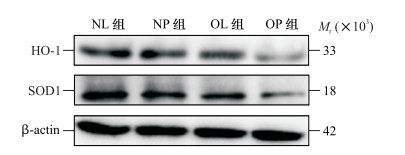
|
图 1 蛋白质印迹法检测大鼠海马组织中HO-1、SOD1蛋白表达 NL组:正常脂肪乳组;NP组:正常丙泊酚组;OL组:肥胖脂肪乳组;OP组:肥胖丙泊酚组.HO-1:血红素加氧酶1;SOD1:超氧化物歧化酶1 |
2.4 各组大鼠海马H-E染色结果
NL、NP、OL组大鼠海马CA1区神经元形态正常且排列有序, 数量较多;OP组大鼠海马CA1区神经元排列松散, 并见水样变性(图 2)。NL、NP、OL与OP组5个不同视野神经元计数平均值分别为117.00±12.12、111.38±9.07、109.00±8.19、54.67±10.21, OP组神经元计数少于OL组(t=9.28, P<0.01)。
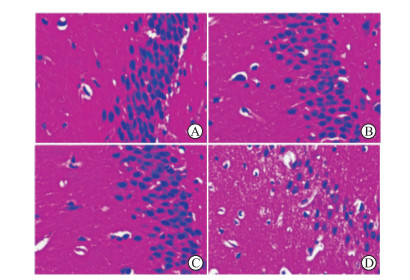
|
图 2 各组大鼠海马CA1区H-E染色结果 A:正常脂肪乳组;B:正常丙泊酚组;C:肥胖脂肪乳组;D:肥胖丙泊酚组.Original magnification:×400 |
3 讨论
儿童肥胖作为大多数国家一个主要公共卫生问题日益受到关注[10]。随着肥胖儿童实施全身麻醉数量的增加, 麻醉药物对其认知功能的影响也成为研究热点。本研究结果表明, 丙泊酚损害未成年肥胖大鼠的认知功能, 其机制可能与下调Nrf2/ARE通路下游抗氧化因子HO-1和SOD1的表达、引起大鼠S100β表达和氧化应激增加有关。
在丙泊酚对认知功能影响的研究中, 多次给药是比较常见的给药方法。Yu等[11]通过连续7 d腹腔注射丙泊酚, 观察其对新生大鼠长期认知功能及神经元凋亡的影响。乔霖等[12]通过连续7 d腹腔注射丙泊酚, 观察其对老年大鼠远期记忆的影响。关于实验剂量的选择, 静脉给药1~2 mg/kg效果相当于腹腔注射50 mg/kg, 儿童诱导丙泊酚用量2~3 mg/kg相当于腹腔注射100 mg/kg[13]。通过预实验及参考相关文献我们选择丙泊酚组模型大鼠腹腔注射丙泊酚100 mg/kg, 连续7 d, 每天注射1次。
丙泊酚作为临床中最常用的麻醉药物, 其对认知功能的影响一直是研究的热点。秦晓菁和张晓庆[14]研究提示反复丙泊酚麻醉可引起成年大鼠认知功能损害, 并且改变其海马组织的超微结构。但Lee等[15]的研究却表明单纯丙泊酚麻醉并不会引起大鼠认知功能损害。出现不同研究结果的原因可能与用药时间、用药剂量等因素有关。对于幼年期大鼠, 因其大脑处于发育爆发期, 丙泊酚麻醉可导致认知功能易损性增加[16]。本研究行为学Morris水迷宫实验结果显示, 与NL组相比, NP组第1、2天逃逸潜伏期均延长(P均<0.05), 而第3~5天2组间差异均无统计学意义, 提示单纯丙泊酚麻醉仅引起未成年正常体质量模型大鼠短期认知功能损害。
肥胖状态下, 脂肪组织使体内炎性因子纤溶酶原激活抑制物1水平升高, 引起氧化应激增加和炎症反应[17]。有研究表明, 肥胖小鼠与正常体质量小鼠比较其氧化应激及炎症反应增加, 并出现认知功能损害[18]。但本研究结果表明, 单纯肥胖并不会引起未成年大鼠长期认知功能的损害, HO-1相关检测因子及行为学检测也仅出现轻微改变, 差异无统计学意义, 其原因可能与建模时间长短及检测时间点不同有关。有研究发现肥胖可增加麻醉药物所致神经损伤的易感性[19]。本实验结果也显示, 在肥胖因素存在下, 丙泊酚会引起未成年大鼠认知功能损害, 原因可能是肥胖增加了丙泊酚引起大鼠认知功能损害的易感性。
在认知功能损害的相关机制研究中, 氧化-抗氧化失衡这一机制备受关注。Nrf2/ARE通路是机体抗氧化反应的中枢调节通路, 抗氧化因子HO-1、SOD1作为该通路重要的下游底物, 在抗氧化应激、清除氧自由基保护细胞免受氧化性损伤中发挥重要作用[7]。有研究表明患有帕金森病等认知功能障碍性疾病时HO-1、SOD1等抗氧化因子异常, 导致氧化-抗氧化失衡, 进而损伤认知功能[8-9]。S100β蛋白作为脑损伤重要的生物标志物, 当体内抗氧化因子HO-1、SOD1蛋白表达降低时, 抗氧化应激作用减弱, 引起大鼠S100β和氧化应激表达增加, 导致急性应激引起大鼠脑损伤[20]。本研究发现, 与OL组相比, OP组大鼠海马组织中HO-1、SOD1蛋白表达均降低, 血浆中S100β含量升高(P均<0.05), 并且出现认知功能减退, 提示丙泊酚可通过下调Nrf2/ARE通路下游抗氧化因子HO-1、SOD1的表达, 引起大鼠S100β表达和氧化应激增加, 从而导致肥胖未成年大鼠认知功能损害。
综上所述, 丙泊酚可引起未成年肥胖大鼠认知功能损害, 其机制可能与下调大脑海马组织中抗氧化因子HO-1、SOD1表达, 引起大鼠S100β表达和氧化应激增加有关。
| [1] |
FEINKOHL I, WINTERER G, PISCHON T. Obesity and post-operative cognitive dysfunction: a systematic review and meta-analysis[J]. Diabetes Metab Res Rev, 2016, 32: 643-651. DOI:10.1002/dmrr.2786 |
| [2] |
ZHANG S, LIANG Z, SUN W, PEI L. Repeated propofol anesthesia induced downregulation of hippocampal miR-132 and learning and memory impairment of rats[J]. Brain Res, 2017, 1670: 156-164. DOI:10.1016/j.brainres.2017.04.011 |
| [3] |
GENG Y J, WU Q H, ZHANG R Q. Effect of propofol, sevoflurane, and isoflurane on postoperative cognitive dysfunction following laparoscopic cholecystectomy in elderly patients: a randomized controlled trial[J]. J Clin Anesth, 2017, 38: 165-171. DOI:10.1016/j.jclinane.2017.02.007 |
| [4] |
ZHANG R, SIMON G, YU F. Advancing Alzheimer's research: a review of big data promises[J]. Int J Med Inform, 2017, 106: 48-56. DOI:10.1016/j.ijmedinf.2017.07.002 |
| [5] |
SILVA F P, SCHMIDT A P, VALENTIN L S, PINTO K O, ZEFERINO S P, OSES J P, et al. S100B protein and neuron-specific enolase as predictors of cognitive dysfunction after coronary artery bypass graft surgery: a prospective observational study[J]. Eur J Anaesthesiol, 2016, 33: 681-689. DOI:10.1097/EJA.0000000000000450 |
| [6] |
TIAN X S, TONG Y W, LI Z Q, LI L X, ZHANG T, REN T Y, et al. Surgical stress induces brain-derived neurotrophic factor reduction and postoperative cognitive dysfunction via glucocorticoid receptor phosphorylation in aged mice[J]. CNS Neurosci Ther, 2015, 21: 398-409. DOI:10.1111/cns.12368 |
| [7] |
ROCHETTE L, ZELLER M, COTTIN Y, VERGELY C. Redox functions of heme oxygenase-1 and biliverdin reductase in diabetes[J]. Trends Endocrinol Metab, 2018, 29: 74-85. DOI:10.1016/j.tem.2017.11.005 |
| [8] |
ARENAS E. Wnt signaling in midbrain dopaminergic neuron development and regenerative medicine for Parkinson's disease[J]. J Mol Cell Biol, 2014, 6: 42-53. DOI:10.1093/jmcb/mju001 |
| [9] |
王昆, 罗小娜, 李时光, 冯丽君, 刘新生. Nrf2/HO-1信号通路在6-羟基多巴胺帕金森病模型大鼠神经损伤中的作用[J]. 中国医药生物技术, 2019, 14: 237-244. DOI:10.3969/j.issn.1673-713X.2019.03.007 |
| [10] |
MISRA A, BHARDWAJ S. Obesity and the metabolic syndrome in developing countries: focus on South Asians[J]. Nestle Nutr Inst Workshop Ser, 2014, 78: 133-140. DOI:10.1159/000354952 |
| [11] |
YU D, JIANG Y, GAO J, LIU B, CHEN P. Repeated exposure to propofol potentiates neuroapoptosis and long-term behavioral deficits in neonatal rats[J]. Neurosci Lett, 2013, 534: 41-46. DOI:10.1016/j.neulet.2012.12.033 |
| [12] |
乔霖, 赵薇, 路园园, 王新生, 邢珍. 丙泊酚与氯胺酮对老年大鼠远期记忆和大脑两种受体表达的比较[J]. 医药导报, 2016, 35: 344-348. DOI:10.3870/j.issn.1004-0781.2016.04.005 |
| [13] |
HAN D, JIN J, FANG H, XU G. Long-term action of propofol on cognitive function and hippocampal neuroapoptosis in neonatal rats[J]. Int J Clin Exp Med, 2015, 8: 10696-10704. |
| [14] |
秦晓菁, 张晓庆. 反复丙泊酚麻醉对大鼠学习记忆功能的影响[J]. 同济大学学报(医学版), 2014, 35: 19-23. |
| [15] |
LEE I H, CULLEY D J, BAXTER M G, XIE Z, TANZI R E, CROSBY G. Spatial memory is intact in aged rats after propofol anesthesia[J]. Anesth Analg, 2008, 107: 1211-1215. DOI:10.1213/ane.0b013e31817ee879 |
| [16] |
WALTERS J L, PAULE M G. Review of preclinical studies on pediatric general anesthesia-induced developmental neurotoxicity[J]. Neurotoxicol Teratol, 2017, 60: 2-23. DOI:10.1016/j.ntt.2016.11.005 |
| [17] |
HSIEH C C, CHOU M J, WANG C H. Lunasin attenuates obesity-related inflammation in RAW264.7 cells and 3T3-L1 adipocytes by inhibiting inflammatory cytokine production[J/OL]. PLoS One, 2017, 12: e0171969. doi: 10.1371/journal.pone.0171969.
|
| [18] |
RAGY M, ALI F, RAMZY M M. Effect of hemin on brain alterations and neuroglobin expression in water immersion restraint stressed rats[J/OL]. Scientifica (Cairo), 2016, 2016: 7825396. doi: 10.1155/2016/7825396.
|
| [19] |
FARR S A, YAMADA K A, BUTTERFIELD D A, ABDUL H M, XU L, MILLER N E, et al. Obesity and hypertriglyceridemia produce cognitive impairment[J]. Endocrinology, 2008, 149: 2628-2636. DOI:10.1210/en.2007-1722 |
| [20] |
HUANG L, ZHANG L, LIU Z, ZHAO S, XU D, LI L, et al. Pentamidine protects mice from cecal ligation and puncture-induced brain damage via inhibiting S100B/RAGE/NF-κB[J]. Biochem Biophys Res Commun, 2019, 517: 221-226. DOI:10.1016/j.bbrc.2019.07.045 |
 2020, Vol. 41
2020, Vol. 41


