强直性脊柱炎(ankylosing spondylitis, AS)是一种以骶髂关节和脊柱小关节附着点炎为核心病变的慢性、自身免疫性疾病, 脊柱小关节最常受累, 也可见外周关节受累, 最终进展为不可逆的纤维性强直或骨性强直, 其中髋关节强直的结局往往较脊柱强直更严重, 直接导致患者运动功能及劳动能力丧失[1]。髋关节强直并不少见, 在病程>30年的AS患者中, 髋关节强直占比高达12%~25%[2]。目前人工全髋关节置换术可以恢复强直的髋关节功能, 但手术患者将面临假体松动和翻修手术风险[2], 也增加了患者的经济负担, 因此药物治疗保护髋关节免于进一步被侵蚀和强直仍然是患者最理想的选择。
对于髋关节受累的AS患者, 肿瘤坏死因子抑制剂(tumor necrosis factor inhibitor, TNFi)长期使用被认为是最好的药物治疗方案。Callhoff等[3]通过包含20项随机对照试验研究3 096例患者的meta分析发现, 对于巴氏强直性脊柱炎疾病活动度指数(Bath ankylosing spondylitis disease activity index, BASDAI)、巴氏强直性脊柱炎功能指数(Bath ankylosing spondylitis function index, BASFI)及国际强直性脊柱炎评价(assessments in ankylosing spondylitis, ASAS)工作组40%缓解标准(ASAS40)缓解率等关键指标, 各类TNFi疗效显著。但是, TNFi由于其价格相对较高、注射使用的不便利性使众多AS患者依从性差。
传统合成改善病情抗风湿药物(conventional synthesis disease-modifying anti-rheumatic drug, csDMARD)价格低廉, 能够为低收入人群所接受。有研究发现, csDMARD对于静止期的外周关节受累AS患者维持静止期及改善外周关节功能有效[4-7]。但这一结论仍存在争议。Dougados等[8]、Braun等[9]、Haibel等[10]都认为csDMARD对降低活动期AS的疾病活动度作用有限。但这些文献在报道csDMARD疗效时并没有区分疾病活动度。csDMARD的疗效相对TNFi微弱, 仅对低活动度AS患者疗效显著, 这可能是对部分高活动度AS患者疗效不佳的原因。
本研究提出一种针对低收入AS人群的治疗方案, 将AS病程分为活动期和相对静止期, 在活动期使用TNFi, 相对静止期使用csDMARD, 通过定期随访髋关节功能及髋关节影像学变化, 评估TNFi、csDMARD序贯治疗方案对AS患者髋关节的保护作用。
1 对象和方法 1.1 受试者本研究所有受试者均来自2017年至2019年南方医科大学南方医院1项为期12个月的前瞻性、开放性、自身前后对照临床试验(NCT03411798, Clinicaltrials.gov), 已通过南方医科大学南方医院伦理委员会审批。本研究选择54例存在髋关节疼痛、活动受限的活动期AS患者, AS的诊断符合纽约AS诊断标准(1984年修订)[11], 活动期定义为BASDAI>4分且基于C-反应蛋白的强直性脊柱炎疾病活动度评分(ankylosing spondylitis disease activity score based on C-reactive protein, ASDASCRP)≥1.3分。排除活动性结核、肝炎和其他感染、其他风湿免疫疾病、恶性肿瘤、合并其他骨关节疾病的患者, 以及妊娠期及哺乳期妇女。治疗期间, 1例受试者自行选择进行手术治疗, 1例症状缓解后考虑妊娠退出治疗, 1例失访, 均予以剔除, 最终共纳入51例受试者。
1.2 试验设计试验设计流程见图 1。受试者在接受治疗前均检测CRP、红细胞沉降率(erythrocyte sedimentation rate, ESR), 并使用ASDASCRP评估其疾病活动度, 若疾病处于高度活动期(ASDASCRP≥2.1分), 予TNFi依那西普(etanercept)25 mg每周2次治疗4周;若疾病处于中度活动期(1.3分≤ASDASCRP<2.1分), 予依那西普25 mg每周2次治疗2周。第一阶段依那西普治疗结束后再次评估受试者疾病活动度, 若达到疾病低活动度标准(ASDASCRP<1.3分)则停用依那西普, 予csDMARD方案(甲氨蝶呤10 mg每周1次、柳氮磺吡啶0.5 g每天3次、羟氯喹400 mg/d 8周后减量为200 mg/d)治疗, 维持疾病缓解状态4周;若处于中度活动期, 继续应用依那西普25 mg每周2次治疗2周;若处于高度活动期, 继续应用依那西普25 mg每周2次治疗4周。每一阶段治疗结束后复查CRP、ESR并进行ASDASCRP评估, 然后根据上述标准调整治疗方案。此外, 在csDMARD方案维持治疗期间, 每个月评估疾病活动度, 若受试者出现疾病低活动度标准(ASDASCRP<1.3分)外的任何症状, 及时复查CRP、ESR并重新进行ASDASCRP评估, 以调整治疗方案。
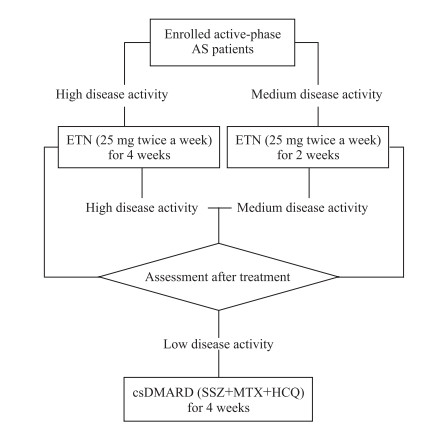
|
图 1 试验设计流程图 Fig 1 Research flow chart AS: Ankylosing spondylitis; ETN: Etanercept; csDMARD: Conventional synthesis disease-modifying anti-rheumatic drug; SSZ: Sulfasalazine; MTX: Methotrexate; HCQ: Hydroxychloroquine |
1.3 疗效评估
所有参与本试验的受试者均在南方医科大学南方医院关节与骨病外科进行门诊随访, 入组时记录受试者年龄、性别、发病年龄、病程、初始发病部位、家族史等信息。除基线节点外, 治疗后3、6、12个月为随访点, 随访时进行CRP、ESR、骨盆正位X线片检查, 使用基于视觉模拟量表(visual analogue scale, VAS)的患者整体评价(patient global assessment)评估受试者主观症状, 使用ASDASCRP、BASDAI评估病情, 使用BASFI评估躯体功能, 使用巴氏强直性脊柱炎髋关节影像学指数(Bath ankylosing spondylitis radiology index-hip, BASRI-hip)及最小关节间隙宽度(minimum joint space width, mJSW)对髋关节病变进行影像学评估。BASRI-hip依据关节间隙改变将髋关节病变的严重程度分为0~4分:0分为无明显变化;1分为疑似局部关节间隙狭窄;2分为存在明显的关节间隙狭窄但关节间隙宽度>2 mm;3分为存在关节间隙狭窄且关节间隙宽度≤2 mm, 或出现宽度<2 cm的骨重叠;4分为骨缺损或出现宽度≥2 cm的骨重叠, 或已进行全髋关节置换术[12]。AS髋关节受累定义为BASRI-hip评分≥2分。通过测量mJSW定量髋关节间隙的狭窄情况。病情及功能评分均由同一名观察者按统一标准进行评估;影像学结果由2名具有影像学评估经验的临床医师独立评估, 若结果存在差异再由1名资深临床医师综合评估。
1.4 统计学处理应用SPSS 25.0软件进行统计学分析。呈正态分布的计量资料以x±s表示, 呈偏态分布的计量资料以中位数(范围)表示。各随访点重复测量数据的比较采用单因素重复测量方差分析, 若重复测量数据不满足“球对称”假设则使用Greenhouse-Geisser的校正系数对F值的自由度进行校正。各随访点数据与基线的比较采用Wilcoxon秩和检验。检验水准(α)为0.05。
2 结果 2.1 基线数据分析共51例受试者完成了为期12个月的试验, 男38例(74.5%), 女13例(25.5%), 年龄为10~56岁, 平均(27.80±9.79)岁;发病年龄为9~40岁, 平均(21.22±6.67)岁;AS病程为0~33年。20例(39.2%)有AS家族史。19例(37.3%)为中轴型腰背痛起病, 32例(62.7%)为外周型(包括髋关节不适)起病。48例(94.1%)既往或入组前人类白细胞抗原B27(human leukocyte antigen B27, HLA-B27)呈阳性。51例受试者CRP水平为8.21(0.24~108.10)mg/L、ESR为16(2~113)mm/1 h, 患者整体评价得分为7(2~10)分, ASDASCRP为3.2(2.1~5.3)分, BASDAI评分为4.9(4.1~8.4)分, BASFI评分为4.5(1.0~9.5)分。基于影像学, 51例受试者基线BASRI-hip评分为2(1~4)分, 其中33例(64.71%)为轻度病变(BASRI-hip评分≤2分), 11例(21.57%)为中度病变(BASRI-hip评分为3分), 7例(13.73%)为重度病变(BASRI-hip评分为4分);mJSW为2.94(0.00~4.72)mm。
2.2 疾病活动度指标分析治疗后3、6、12个月, 51例AS患者ASAS20缓解率分别为70.59%(36/51)、84.31%(43/51)和96.08%(49/51), ASAS40缓解率分别为58.82%(30/51)、78.43%(40/51)和86.27%(44/51)。在主观症状改善方面, 治疗后3、6、12个月患者整体评价得分总体呈下降趋势(F=100.112, P<0.05), 且与基线相比均下降(Z=-5.982、-5.830、-6.110, P均<0.05)。在疾病活动度控制方面, 治疗后3、6、12个月, ASDASCRP和BASDAI评分总体均呈下降趋势(F=103.123、111.252, P均<0.05), 与基线相比亦均下降(ASDASCRP:Z=-6.055、-6.008、-6.205, P均<0.05;BASDAI评分:Z=-5.986、-6.122、-6.108, P均<0.05)。在炎症反应方面, 治疗后3、6、12个月, CRP水平、ESR总体均呈下降趋势(F=10.720、16.738, P均<0.05), 与基线相比亦均下降(CRP水平:Z=-4.073、-4.703、-4.213, P均<0.05;ESR:Z=-4.665、-4.725、-5.069, P均<0.05)。见表 1。
|
|
表 1 AS患者各随访点主要临床指标和髋关节受累相关指标变化 Tab 1 Changes of primary clinical indexes and hip involvement related indexes of AS patients at each follow-up point |
2.3 髋关节受累相关指标分析
治疗后3、6、12个月, 髋关节功能评价指标BASFI评分总体呈下降趋势, 差异有统计学意义(F=83.659, P<0.05), 与基线相比均有所改善(Z=-5.981、-6.070、-6.216, P均<0.05)。在影像学评估方面, 治疗后3、6、12个月BASRI-hip评分和mJSW总体趋势均无明显变化(F=0.282、1.282, P=0.807、0.283), 与基线相比差异也均无统计学意义(BASRI评分:Z=-0.276、-0.420、-0.302, P均>0.05;mJSW:Z=-0.519、-0.249、-0.937, P均>0.05)。见表 1。
3 讨论本研究共51例AS患者完成为期12个月的随访, ASAS20、ASAS40缓解率在治疗后3个月即分别达到70.59%(36/51)、58.82%(30/51), 随访终点(治疗后12个月)时分别达到96.08%(49/51)、86.27%(44/51), 呈现“先快速、后稳定”的特征。受试者疾病活动度则呈持续下降趋势, 各随访点的ASDASCRP、BASDAI评分与基线相比均下降, 而治疗后6、12个月均与前一节点相比差异无统计学意义, 提示序贯治疗方案可在治疗初期迅速降低疾病活动度, 后期持续维持较低的活动度实现病情持续平稳, 这一变化特点也体现在患者主观症状即患者整体评价方面。急性炎症反应指标CRP、ESR在整个随访周期同样呈现前期迅速改善、后期稳定维持的特点。从疾病活动度及炎症相关指标的改善特点可以看出, 初期使用TNFi依那西普迅速降低炎症水平后应用csDMARD可继续维持较低的活动度, 印证了TNFi、csDMARD序贯治疗方案的有效性及可持续性。
在髋关节功能与结构评估方面, 治疗后BASFI评分迅速降低, 提示受试者髋关节功能持续改善;BASRI-hip评分自基线开始无明显变化, 提示髋关节受累在治疗后未进一步恶化, 关节结构破坏进程被有效控制。在研究过程中, 除1例受试者因个人及家庭原因自行选择髋关节手术治疗而退出研究外, 其余受试者均未因关节结构破坏加重、关节功能持续受限而不得不进行手术治疗。与此同时, mJSW在各随访点之间差异均无统计学意义, 表明髋关节间隙这一重要的髋关节受累指标也在治疗后得到了稳定维持。上述结果表明, TNFi、csDMARD序贯治疗方案在为期12个月的随访中不仅控制了AS病情进展, 也持续改善了髋关节功能, 有效防止了髋关节结构被进一步破坏, 维持了髋关节间隙的稳定。
本研究存在以下不足之处。首先, 共纳入51例受试者, 样本量小, 可能造成结果偏移, 同时缺乏单一用药治疗方案的对照, 仍需要开展更大样本、多中心、随机对照试验进一步验证TNFi、csDMARD序贯治疗方案的安全性与有效性。其次, 为期12个月的随访周期对TNFi、csDMARD序贯治疗方案的远期疗效和安全性评估有限, 特别是能否长期维持影像学稳定的关节结构, 以及疾病长期维持缓解状态使用csDMARD药物的安全性。最后, 未体现腰背部症状的变化, 对于中轴型AS患者而言仍需进一步研究TNFi、csDMARD序贯治疗方案的有效性。
总之, 对于AS患者, TNFi作为“救火队员”能迅速“熄灭”炎症, 控制炎症对骨关节结构的破坏;csDMARD则在疾病活动度降低至较低水平时, “接棒”进一步维持疾病低活动状态, 同时持续改善患者的髋关节功能。本研究结果表明, 序贯应用TNFi、csDMARD能在疾病进程的各个阶段有针对性地有效抑制炎症、阻止髋关节破坏进展、改善髋关节功能、保持髋关节间隙稳定, 从而长期、稳定控制疾病活动, 避免了过早进行髋关节置换术, 有效改善了患者生活质量。TNFi、csDMARD序贯治疗方案有望成为髋关节受累AS患者经济、有效、安全的选择。
| [1] |
CHEN H A, CHEN C H, LIAO H T, LIN Y J, CHEN P C, CHEN W S, et al. Factors associated with radiographic spinal involvement and hip involvement in ankylosing spondylitis[J]. Semin Arthritis Rheum, 2011, 40: 552-528. DOI:10.1016/j.semarthrit.2010.07.008 |
| [2] |
KATZ J N, WRIGHT E A, WRIGHT J, MALCHAU H, MAHOMED N N, STEDMAN M, et al. Twelve-year risk of revision after primary total hip replacement in the U.S. Medicare population[J]. J Bone Joint Surg Am, 2012, 94: 1825-1832. DOI:10.2106/JBJS.K.00569 |
| [3] |
CALLHOFF J, SIEPER J, WEIβ A, ZINK A, LISTING J. Efficacy of TNFα blockers in patients with ankylosing spondylitis and non-radiographic axial spondyloarthritis: a meta-analysis[J]. Ann Rheum Dis, 2015, 74: 1241-1248. |
| [4] |
VAZ A, LISSE J, RIZZO W, ALBANI S. Discussion: DMARDs and biologic therapies in the management of inflammatory joint diseases[J]. Expert Rev Clin Immunol, 2009, 5: 291-299. DOI:10.1586/eci.09.14 |
| [5] |
GRANIER S, WAXMAN J. A case of ankylosing spondylitis treated with hydroxychloroquine[J/OL]. J Clin Rheumatol, 1995, 1: 136. doi: 10.1097/00124743-199504000-00017.
|
| [6] |
CLEGG D O, REDA D J, WEISMAN M H, BLACKBURN W D, CUSH J J, CANNON G W, et al. Comparison of sulfasalazine and placebo in the treatment of ankylosing spondylitis. A Department of Veterans Affairs Cooperative Study[J]. Arthritis Rheum, 1996, 39: 2004-2012. DOI:10.1002/art.1780391209 |
| [7] |
MARSHALL R W, KIRWAN J R. Methotrexate in the treatment of ankylosing spondylitis[J]. Scand J Rheumatol, 2001, 30: 313-314. DOI:10.1080/030097401317148480 |
| [8] |
DOUGADOS M, VAM DER LINDEN S, LEIRISALO-REPO M, HUITFELDT B, JUHLIN R, VEYS E, et al. Sulfasalazine in the treatment of spondylarthropathy. A randomized, multicenter, double-blind, placebo-controlled study[J]. Arthritis Rheum, 1995, 38: 618-627. DOI:10.1002/art.1780380507 |
| [9] |
BRAUN J, ZOCHLING J, BARALIAKOS X, ALTEN R, BURMESTER G, GRASEDYCK K, et al. Efficacy of sulfasalazine in patients with inflammatory back pain due to undifferentiated spondyloarthritis and early ankylosing spondylitis: a multicentre randomised controlled trial[J]. Ann Rheum Dis, 2006, 65: 1147-1153. DOI:10.1136/ard.2006.052878 |
| [10] |
HAIBEL H, BRANDT H C, SONG I H, BRANDT A, LISTING J, RUDWALEIT M, et al. No efficacy of subcutaneous methotrexate in active ankylosing spondylitis: a 16-week open-label trial[J]. Ann Rheum Dis, 2007, 66: 419-421. DOI:10.1136/ard.2006.054098 |
| [11] |
VAN DER LINDEN S, VALKENBURG HA, CATS A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria[J]. Arthritis Rheum, 1984, 27: 361-268. DOI:10.1002/art.1780270401 |
| [12] |
MACKAY K, BROPHY S, MACK C, DORAN M, CALIN A. The development and validation of a radiographic grading system for the hip in ankylosing spondylitis: the bath ankylosing spondylitis radiology hip index[J]. J Rheumatol, 2000, 27: 2866-2872. |
 2020, Vol. 41
2020, Vol. 41


