2. 海军军医大学(第二军医大学)东方肝胆外科医院胆道二科二病区, 上海 200438;
3. 海军军医大学(第二军医大学)东方肝胆外科医院肝外五科, 上海 200438
2. The Second Ward, Department of Hepatobiliary Surgery (Ⅱ), Eastern Hepatobiliary Surgery Hospital, Naval Medical University (Second Military Medical University), Shanghai 200438, China;
3. Department of Hepatic Surgery (Ⅴ), Eastern Hepatobiliary Surgery Hospital, Naval Medical University (Second Military Medical University), Shanghai 200438, China
原发性肝淋巴瘤(primary hepatic lymphoma, PHL)是一种病变局限于肝脏的结外恶性淋巴瘤, 其发病率低, 约占肝恶性肿瘤的0.1%, 占非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)的0.016%, 占结外淋巴瘤的0.4%[1]。PHL缺乏典型诊断特征, 易被误诊。现报告海军军医大学(第二军医大学)东方肝胆外科医院收治的1例被误诊为肝血管瘤的PHL病例, 并回溯1975―2019年国内文献报道的PHL病例, 总结该病的临床、诊断、预后特点。
1 资料和方法 1.1 病例资料患者女, 31岁, 因“健康体检发现肝占位3年”于2018年7月4日收入海军军医大学(第二军医大学)东方肝胆外科医院。入院3年前, 患者首次于健康体检时经超声检查发现中肝叶一直径约10 mm占位, 当时未明确诊断, 因无明显症状未予重视, 后3年间患者多次进行超声检查, 见该占位逐渐增大, 当地医院诊断为肝血管瘤。患者患病以来无腹胀、腹痛, 无寒战、发热, 无巩膜、皮肤黄染或其他特殊临床表现。2018年5月21日外院超声检查示肝占位, 大小约73 mm×65 mm, 仍考虑血管瘤。由于该占位短期增大明显, 患者为明确诊断遂来我院进一步求诊。入院体格检查无特殊, 既往身体健康, 无特殊病史, 进一步完善相关检查。血常规示白细胞计数4.37×109/L, 红细胞计数4.24×1012/L, 血红蛋白117 g/L, 血小板计数226×109/L;肝功能示总胆红素7.4 μmol/L, 白蛋白42.7 g/L, 球蛋白40.7 g/L, 白球比1.0, 丙氨酸转氨酶35 U/L, 天冬氨酸转氨酶26 U/L, 碱性磷酸酶58 U/L, 乳酸脱氢酶163 U/L;HBV-DNA定量<50 U/mL, 丙型肝炎病毒RNA定量<1.0×103 U/mL, 乙型肝炎五项标志物均为阴性;甲胎蛋白、癌胚抗原、CA19-9均为阴性。超声检查示肝脂肪浸润, 中肝叶近膈顶见一类圆形稍低回声区, 大小约67 mm×62 mm, 提示血管瘤可能;MRI检查示肝右叶上段占位, 肝右叶下段小结节, 可见血管漂浮征, 提示恶性可能, 右侧心膈脚、肝门部及下腔静脉旁淋巴结肿大(图 1)。结合患者MRI检查结果及占位短期明显增大的现象, 考虑该占位恶性可能, 与患者沟通后结合其本人及家属的主动意愿, 决定予手术切除。
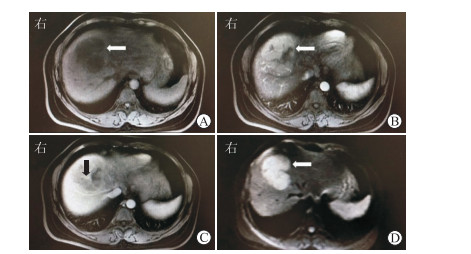
|
图 1 本例PHL患者MRI表现 A:MRI平扫示病灶呈低信号(箭头所示);B:增强MRI动脉期病灶有轻度强化(箭头所示), 但中心坏死无强化;C:增强MRI门静脉期病灶轮廓清晰, 可见血管漂浮征(箭头所示);D:DWI示病灶呈高信号(箭头所示).PHL:原发性肝淋巴瘤;MRI:磁共振成像;DWI:扩散加权成像 |
1.2 文献回顾与分析
利用中国知网和万方数据文献检索平台, 以“肝淋巴瘤”为关键词进行检索, 纳入病例具有临床症状描述、影像学诊断(超声、CT、MRI)或病理诊断依据, 其中具有治疗及预后信息的病例纳入生存分析, 提供临床诊断但临床信息及上述诊断依据不充分者排除, 伴发其他肿瘤或治疗预后信息不完整者不纳入生存分析。最终纳入1975―2019年45年间国内相关文献91篇, 共计肝淋巴瘤病例524例, 其中376例为PHL, 余148例为继发病例。
1.3 统计学处理采用SPSS 23.0软件进行统计学分析。计量资料以x±s表示, 计数资料以例数和百分数表示。采用Kaplan-Meier生存分析法分析患者生存情况并绘制生存曲线。检验水准(α)为0.05。
2 结果 2.1 病例治疗、病理和随访结果患者完善术前检查, 无禁忌证, 2018年7月11日于静吸复合麻醉下行手术治疗。术中探查见中肝叶近膈顶一大小约8 cm×7 cm肿块, 另左外叶触及一大小约2 cm×1 cm质地稍硬的肿块;肝十二指肠韧带多发肿大淋巴结, 质稍硬, 活动度差;余探查未见异常。遂行肝多发肿瘤切除+肝十二指肠淋巴结清扫+胆囊切除术。术后病理结果:肿瘤由大片淋巴样细胞构成, 细胞质少, 核具异型性;肿瘤无明显包膜, 边界呈浸润性, 周边肝组织被淋巴细胞浸润;胆囊颈部及门静脉旁淋巴结见片状坏死, 余淋巴结未见肿瘤细胞。免疫组织化学染色示:滤泡区细胞大部CD20(+), 生发中心细胞CD10(+)、Bcl-6(+)、Bcl-2(-)、Ki-67(80%), 滤泡间区大部CD3(+)、CD5(+)、Bcl-2(+)、Ki-67(约10%), 浆细胞多发性骨髓瘤癌基因1(multiple myeloma oncogene 1, MUM-1)(+)、免疫球蛋白轻链κ/λ(部分+)、细胞周期蛋白D1(-), 滤泡树突状细胞CD21(+)、CD23(+), 细胞角蛋白AE1/AE3(-)。结合病史、临床表现、病理结果, 最终诊断为原发性肝B细胞非霍奇金淋巴瘤(B-cell non-Hodgkin lymphoma, B-NHL)。患者术后恢复良好, 暂未行化学治疗, 随访至截稿(2019年12月31日)病情稳定无复发。
2.2 文献回溯结果与分析 2.2.1 一般资料376例PHL患者中, 男236例、女140例, 男女比例为1.69 : 1;年龄为2~77岁, 平均(48.8±9.6)岁;主要临床表现为腹痛(164例, 43.6%)、间歇发热(153例, 40.7%)、腹胀(111例, 29.5%)、消瘦(70例, 18.6%)、乏力(42例, 11.2%)、厌食(31例, 8.2%)、黄疸(16例, 4.3%)、盗汗(6例, 1.6%)和腹水(4例, 1.1%), 报道最高发热体温达41 ℃;病史或伴随表现中, 乙型肝炎131例(34.8%), 丙型肝炎8例(2.1%), 肝硬化15例(4.0%), 肝吸虫病4例(1.1%), 因恶性肿瘤(腹膜后恶性神经鞘瘤)经接受化学治疗2例(0.5%), 伴发肝癌4例(1.1%), EB病毒感染2例(0.5%), 鼻出血、肺结核、溶血性贫血、肾移植术后、黄疸型肝炎、艾滋病各1例(0.3%);119例患者通过肝穿刺活组织检查确诊, 170例通过手术标本病理证实, 2例经尸体解剖病理证实, 85例依据临床表现、影像学检查及诊断性治疗后确诊。
2.2.2 肿瘤基本特征376例PHL患者中单发216例、多发105例、弥漫浸润20例、斑片状生长35例。216例单发患者中, 位于右肝127例(58.8%)、左肝者82例(38.0%)、尾状叶2例(0.9%)、中肝叶4例(1.9%)、肝门部1例(0.5%), 直径多为3~10 cm(207例, 95.8%)。影像学特征:376例患者中219例报道了超声检查结果, 可见PHL主要表现为低或等回声结节(186例, 84.9%)。183例次报道了CT平扫结果, 可见PHL CT平扫主要呈低密度灶(179例次, 97.8%);203例次报道了CT增强扫描结果, 主要呈现动脉期轻度强化或不均匀强化(125例次, 61.6%)、门静脉期强化(56例次, 27.6%)或无强化(22例次, 10.8%)。102例次报道了MRI平扫结果, 可见PHL MRI平扫主要呈平扫T1低信号、T2高或稍高信号(99例次, 97.1%);55例次报道了MRI增强扫描结果, 主要呈现动脉期强化表现(44例次, 80.0%);36例次报道了扩散加权成像(diffusion-weighted imaging, DWI)结果, 主要为高信号(32例次, 88.9%);24例患者于MRI检查中见“血管漂浮征”。实验室检查:146例(38.8%)患者出现乳酸脱氢酶升高。
2.2.3 肿瘤误诊情况376例PHL患者中, 132例(35.1%)发生误诊, 其中误诊为原发性肝细胞癌最多见(67例, 17.8%), 其次为肝转移瘤(19例, 5.1%)、血管瘤(10例, 2.7%)、肝脓肿(10例, 2.7%)、炎症(6例, 1.6%)、肝内胆管癌(5例, 1.3%)、肝局灶性结节增生(3例, 0.8%)、脂肪肝(3例, 0.8%)、肝囊肿(2例, 0.5%)、肝腺瘤(2例, 0.5%)、结核病(1例, 0.3%)、其他良性结节(4例, 1.1%)。
2.2.4 治疗及预后376例PHL患者中, 291例具有病理学诊断结果, 包括283例(97.3%)NHL和8例(2.7%)霍奇金淋巴瘤(Hodgkin lymphoma, HL)。其中232例(79.7%)为临床多见的B-NHL与T细胞非霍奇金淋巴瘤(T-cell non-Hodgkin lymphoma, T-NHL), 分别为187例(64.3%)和45例(15.4%), 具有预后信息者分别为90例和25例。B-NHL病例中接受手术+术后化学治疗82例、单纯化学治疗58例、单纯手术治疗47例, 具有预后信息者分别为52例、21例和17例。B-NHL中108例进一步明确了亚型诊断, 其中弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)与黏膜相关淋巴组织(mucosa-associated lymphoid tissue, MALT)淋巴瘤患者分别为81例和27例, 具有预后信息者分别为53例和15例。生存分析结果显示, B-NHL患者预后较T-NHL患者好(中位总生存时间:36.4个月vs 20.7个月, P=0.009;图 2A);B-NHL中, MALT淋巴瘤患者预后较DLBCL患者好(中位总生存时间:52.0个月vs 30.0个月, P=0.049;图 2B), 接受手术+术后化学治疗的患者预后较单纯化学治疗或单纯手术治疗好(中位总生存时间:45.6个月vs 23.9和7.7个月, P=0.016;图 2C)。
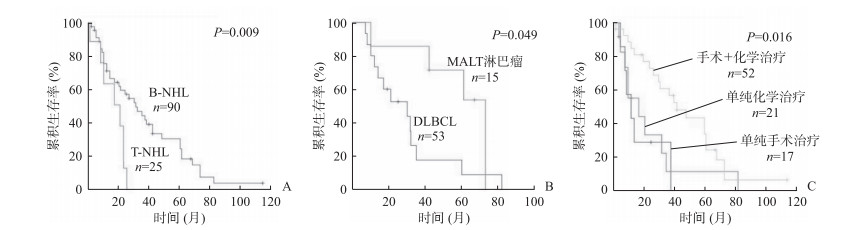
|
图 2 PHL患者生存分析曲线 A:B-NHL和T-NHL患者总生存时间比较;B:MALT淋巴瘤和DLBCL患者总生存时间比较;C:接受不同治疗方式的B-NHL患者总生存时间比较.PHL:原发性肝淋巴瘤;B-NHL:B细胞非霍奇金淋巴瘤;T-NHL:T细胞非霍奇金淋巴瘤;MALT:黏膜相关淋巴组织;DLBCL:弥漫大B细胞淋巴瘤 |
3 讨论 3.1 PHL临床表现及影像学特征
PHL的主要病因包括HBV、丙型肝炎病毒或EB病毒感染, 尤其常见于免疫功能缺陷患者, 如艾滋病、恶性肿瘤、器官移植术后等, 常见症状体征有腹痛、恶心、纳差和恶性淋巴瘤“B”症状(发热、盗汗、体质量减轻等), 超过50%的患者有肝脏肿大, 约4%的患者有黄疸[2];大体类型可分为单发肿块型、多发结节型及浸润型, 以前两种类型多见[3-4], 弥漫性肝脏浸润罕见并且预后较差[5]。本研究通过回溯国内报道的376例PHL患者资料, 发现其临床特征与此基本一致。PHL超声造影表现为恶性肿瘤的典型表现, 即动脉期快速、同步或延迟增强, 门静脉期及延迟期廓清(低回声)[6-7]。PHL病灶CT平扫主要表现为均匀或非均匀低密度灶, 有时为囊状或可见分隔、气体;增强扫描主要表现为动脉期无强化或轻度强化, 强化可均匀或不均匀, 门静脉期、延迟期强化明显;陈翼等[5]发现PHL的增强四期CT值均小于正常肝组织。本研究回溯病例中部分病灶还表现出动脉期边缘强化的特点, Maher等[3]将这种强化归因于病灶邻近肝实质受侵导致的脉管炎。在MRI表现上, PHL由于含水分间质成分少, 弥散受限明显, DWI的表观弥散系数较一般恶性肿瘤更低(PHL:<1.0×10-3 mm2/s;一般恶性肿瘤:<1.4×10-3 mm2/s)[8]。此外, 由于PHL起源于肝脏间质, 瘤内常残存正常血管穿行, 影像学上表现为“血管漂浮征”。本研究回溯病例中28例还进行了PET-CT检查, 表现为摄取增高。PHL的氟脱氧葡萄糖(fluorodeoxyglucose, FDG)摄取程度取决于淋巴瘤的病理类型, 惰性者FDG摄取较低, 而DLBCL、Burkitt淋巴瘤、T细胞淋巴瘤则摄取相对较高[9]。在数字减影血管造影图像上, PHL可见肝内轻度肿瘤染色, 无明显增粗的肿瘤血管, 无“抱球征”, 局部肝动脉可受压移位, 这与其乏血供和不侵犯血管的生长特点相吻合[10]。
3.2 PHL实验室检查特征本研究回溯病例中146例出现了乳酸脱氢酶升高。研究发现, PHL患者血清乳酸脱氢酶升高水平与肿瘤恶性程度呈正相关, 可作为判断预后的辅助指标[11]。本例患者球蛋白升高导致出现白球比倒置, 文献报道63.1%(12/19)的PHL患者出现以球蛋白升高为主的白球比倒置现象, 且在B细胞淋巴瘤患者多见[12]。
3.3 PHL的鉴别诊断PHL需注意与下述疾病鉴别。(1)肝细胞癌:单发或多发的肝细胞癌动态增强扫描常可见“快进快出”典型表现, 且易侵犯门静脉系统, 出现门静脉瘤栓或动静脉瘘, 病灶较大时常见中心坏死。而肿块型PHL无上述特点, 但可出现“血管漂浮征”。部分乏血供肝细胞癌在影像学上较难与PHL区分, 需结合肝病病史和甲胎蛋白水平予以区分。相比弥漫型PHL, 弥漫型肝细胞癌动脉期强化明显, 亦可见动静脉瘘形成和门静脉癌栓, 患者甲胎蛋白水平明显升高[13]。(2)肝内胆管癌:肝左叶好发, MRI增强扫描呈缓慢渐进性强化、部分呈环形强化, 有时与PHL动脉期边缘增强易混淆。但肝内胆管癌常伴邻近肝组织萎缩、病灶周围胆管扩张、区域淋巴结转移等, 另外患者常具结石病史和黄疸表现, CA19-9水平常升高[14]。(3)肝血管瘤:PHL在疾病早期易误诊为肝血管瘤, 此时病灶较小, 患者缺乏典型病史, 影像学上部分PHL肿块强化时也可出现向心性填充的假象[15], 故无诊治PHL经验者易误诊为血管瘤。本例患者在外院即被误诊为肝血管瘤。(4)肝转移瘤:典型者影像学可见“牛眼征”“环靶征”, 临床上一般有原发病史。(5)肝局灶性结节增生:中央瘢痕是其代表性影像特征, CT或MRI增强扫描病灶强化明显, 瘢痕呈门静脉期或延迟期部分强化, 具有一定特征性。PHL无中央瘢痕, 部分出现坏死时平扫可有类似瘢痕表现, 但不强化[13]。(6)肝脓肿:患者发热持续时间长, 白细胞计数升高明显。MRI呈T1不均匀低信号, 急性期可见病灶周围炎性水肿带;T2高信号, 多房时可见低信号分隔;早期脓肿壁尚未完全形成时与PHL鉴别困难, 抗感染治疗有效或穿刺见脓液可予鉴别[16]。
3.4 PHL病理及免疫组织化学特征PHL中HL少见, 此次回溯病例中NHL占97.3%(283/291), HL仅占2.7%(8/291), 其中病理确定的B-NHL占NHL的64.3%(187例), T-NHL占15.4%(45例)。原发性肝B-NHL的病理亚型中以DLBCL最为常见, MALT淋巴瘤较为少见(回溯病例中DLBCL 81例, MALT淋巴瘤27例)。(1)B-NHL:DLBCL特征性病理表现为肝小叶结构广泛破坏, 瘤细胞主要沿肝窦间隙浸润, 破坏肝细胞索;中等到较大的异型淋巴细胞弥漫浸润肝实质、门管区、胆管[17]。MALT淋巴瘤特征性病理表现为肿瘤性边缘带淋巴细胞增殖浸润至上皮组织, 破坏腺体, 形成“淋巴上皮”病变, 且肿瘤性淋巴滤泡和反应性淋巴滤泡常同时存在;瘤细胞于汇管区内大量浸润。在免疫组织化学表现上, B-NHL常弥漫表达CD20、CD79a等B细胞抗原, 生发中心样亚型还表达CD10和(或)Bcl-6, 非生发中心样亚型CD10和Bcl-6阴性, MUM-1(+/-)[17];原发性DLBCL常表达CD5;MALT淋巴瘤CD5、CD10、CD3和细胞周期蛋白D1表达阴性。(2)T-NHL:淋巴样细胞大小较一致, 核不规则、染色质均, 核仁不明显, 间质血管较丰富, 可见灶状坏死[18]。免疫组织化学染色示CD3、CD45RO/RA是主要阳性标志物。
3.5 PHL的治疗及预后既往文献报道PHL患者生存时间为3~123.6个月[19], 影响患者预后的因素包括肝内广泛浸润、高增殖指数、高龄、肝硬化、血清乳酸脱氢酶明显升高、β2微球蛋白升高及治疗方式等[20]。回溯病例报道的总生存时间为1.5~114个月, 其中生存期最长者为1例单发B-NHL患者, 经历手术+化学治疗[21]。本研究对B-NHL患者按主要治疗方式分组进行生存分析, 发现术后辅助化学治疗对PHL的效果较单纯手术或单纯化学治疗更好。早期PHL标准化学治疗方案为CHOP方案(环磷酰胺+多柔比星+长春新碱+泼尼松), 后随着利妥昔单抗的出现发展出R-CHOP方案, 由于利妥昔单抗直接作用于B细胞CD20抗原, 对于B-NHL来说R-CHOP方案无论在术后辅助或单纯化学治疗中使用, 其对客观缓解率及生存率的提升均好于CHOP方案[22]。对于DLBCL患者, R-CHOP方案是最佳选择, Page等[19]研究发现R-CHOP治疗DLBCL的5年生存率可达43%。对于初诊病灶较大、多发而难行手术的患者, 新辅助化学治疗为有效措施[23]。综上所述, 对于初诊有手术条件的PHL患者应以手术为主辅以术后化学治疗;不达手术条件者可予新辅助化学治疗后再行评估, 且手术后应进一步辅以全身化学治疗;完全无手术机会的患者应结合病灶情况、病理结果等采取以化学治疗为主的综合方案进行治疗。
PHL作为一种少见的恶性肿瘤, 其诊断具有一定难度, 需结合患者病史、临床表现、实验室检查、影像学检查等进行综合判断, 最终确诊需依赖病理学和免疫组织化学结果。PHL总体预后较肝癌好, 因此一经诊断应积极治疗, 在治疗方面应以手术为基础辅以综合化学治疗。
| [1] |
MEHTA N, JAYAPAL L, GONEPPANAVAR M, NELAMANGALA RAMAKRISHNAIAH V P. Primary hepatic lymphoma: a rare case report[J]. JGH Open, 2019, 3: 261-263. |
| [2] |
ANNUNZIATA S, CALCAGNI M L, INDOVINA L, RUFINI V. Measurement uncertainty and clinical impact of target-to-background ratios derived by interim FDG-PET/CT in Hodgkin lymphoma: reply to Laffon and Martan[J]. Eur J Nucl Med Mol Imaging, 2017, 44: 2140-2141. |
| [3] |
MAHER M M, MCDERMOTT S R, FENLON H M, CONROY D, O'KEANE J C, CARNEY D N, et al. Imaging of primary non-Hodgkin's lymphoma of the liver[J]. Clin Radiol, 2001, 56: 295-301. |
| [4] |
ALVES A M A, TORRES U S, VELLONI F G, RIBEIRO B J, TIFERES D A, D'IPPOLITO G. The many faces of primary and secondary hepatic lymphoma: imaging manifestations and diagnostic approach[J]. Radiol Bras, 2019, 52: 325-330. |
| [5] |
陈翼, 李治贵, 李江城, 黄淏, 漆雪婷, 张智猗, 等. 原发性肝淋巴瘤的多种影像表现[J]. 西北国防医学杂志, 2019, 40: 290-294. |
| [6] |
LOW G, LEEN E. Diagnosis of periportal hepatic lymphoma with contrast-enhanced ultrasonography[J]. J Ultrasound Med, 2006, 25: 1059-1062. |
| [7] |
TRENKER C, KUNSCH S, MICHL P, WISSNIOWSKI T T, GOERG K, GOERG C. Contrast-enhanced ultrasound (CEUS) in hepatic lymphoma: retrospective evaluation in 38 cases[J]. Ultraschall Med, 2014, 35: 142-148. |
| [8] |
王小艺, 赵燕风, 吴宁, 朱正, 梁晶. 10例肝脏淋巴瘤的影像学表现分析[J]. 癌症进展, 2015, 13: 512-518. |
| [9] |
汤泊, 李天女, 丁重阳. 原发性肝脏淋巴瘤的18F-FDG PET-CT表现及临床分析[J]. 中国实验血液学杂志, 2018, 26: 1062-1066. |
| [10] |
刘方颖, 陈丹, 商健彪, 伍筱梅, 张雪林. 原发性肝淋巴瘤的临床及影像学诊断[J]. 第一军医大学学报, 2005, 25: 1290-1291. |
| [11] |
MODI G, MADABHAVI I, PATEL A, REVANNASIDDAIAH S, ANAND A, PANCHAL H, et al. Primary hepatic Burkitt lymphoma: a bizarre site and triumph tale[J]. J Clin Exp Hepatol, 2015, 5: 159-162. |
| [12] |
庞书杰, 叶庆旺, 施洋, 杨宁, 杨广顺. 原发性肝脏淋巴瘤19例临床病理学特点及预后分析[J]. 肝胆胰外科杂志, 2015, 27: 502-505. |
| [13] |
谢辉, 安维民, 孙艳玲, 马威, 董景辉, 叶平, 等. 肝原发性淋巴瘤MRI表现及鉴别诊断[J]. 中国医学影像学杂志, 2011, 7: 518-519. |
| [14] |
王军生, 邓明明, 邓方. 肝淋巴瘤的CT诊断价值[J]. 现代医用影像学, 2015, 24: 803-804. |
| [15] |
陈妍琼, 刘艳艳, 王海英. 肝脏原发淋巴瘤的影像学表现及误诊分析[J]. 医药论坛杂志, 2018, 39: 18-24. |
| [16] |
资玲华, 苟军, 何瑜. CT检查在肝淋巴瘤诊断中的价值[J]. 中国中西医结合影像学杂志, 2012, 10: 320-322. |
| [17] |
王木森, 王新国, 郑金锋, 景洪标. 原发性肝脏弥漫大B细胞淋巴瘤5例报道并文献复习[J]. 重庆医科大学学报, 2016, 41: 605-608. |
| [18] |
王珊珊, 梅金红, 余克涵. 原发性肝脏非霍奇金淋巴瘤3例分析[J]. 广东医学, 2013, 34: 2434. |
| [19] |
PAGE R D, ROMAGUERA J E, OSBORNE B, MEDEIROS L J, RODRIGUEZ J, NORTH L, et al. Primary hepatic lymphoma: favorable outcome after combination chemotherapy[J]. Cancer, 2001, 92: 2023-2029. |
| [20] |
陈刚, 柯善栋, 席青松, 胡少明, 于世英. 原发性肝脏结外边缘区B细胞淋巴瘤1例并文献复习[J]. 华中科技大学学报(医学版), 2011, 40: 242-244. |
| [21] |
张耀军, 陈敏山, 梁惠宏, 徐立, 张亚奇. 4例肝脏原发淋巴瘤的临床病理特点和治疗分析[J]. 癌症, 2005, 24: 365-367. |
| [22] |
MA Y J, CHEN E Q, CHEN X B, WANG J, TANG H. Primary hepatic diffuse large B cell lymphoma: a case report: primary hepatic diffuse large B cell lymphoma[J]. Hepat Mon, 2011, 11: 203-205. |
| [23] |
冯继锋, 吴剑秋, 宋永平, 苏丽萍, 张明智, 李薇, 等. 利妥昔单抗联合化疗一线治疗初治弥漫大B细胞淋巴瘤的临床现状[J]. 中华血液学杂志, 2014, 35: 309-313. |
 2020, Vol. 41
2020, Vol. 41


