2. 上海交通大学附属第一人民医院病理科, 上海 200080
2. Department of Pathology, Shanghai General Hospital, Shanghai Jiao Tong University, Shanghai 200080, China
膀胱癌为临床最常见的泌尿系统肿瘤之一, 统计数据显示2018年全球膀胱癌新增病例接近55万, 死亡人数达20万, 发病率和死亡率均呈上升趋势[1]。根据肿瘤浸润深度, 膀胱癌可分为非肌层浸润性膀胱癌和肌层浸润性膀胱癌。其中非肌层浸润性膀胱癌约占75%, 患者通常预后较好但容易复发;肌层浸润性膀胱癌约占25%, 尽管手术联合放射治疗、化学治疗技术不断发展, 但复发、转移率仍较高, 导致生存率较低[2]。膀胱癌的侵袭、转移是影响膀胱癌患者预后和治疗效果的重要因素, 因此, 正确认识膀胱癌侵袭、转移的分子机制至关重要。
上皮-间质转化(epithelial-mesenchymal transition, EMT)是肿瘤发生侵袭进展的重要阶段, 其特征是细胞的极性和黏附性降低、运动性增强, 上皮标志物E-钙黏蛋白(E-cadherin)表达降低、间质标志物N-钙黏蛋白(N-cadherin)表达升高[3]。EMT的激活涉及多种信号转导途径, 如TGF-β、NF-κB、Notch、Wnt/β-连环蛋白(β-catenin)等。锌指转录因子Snail、Twist1/2和E盒结合锌指蛋白(zinc-finger E-box-binding protein, ZEB)是调节肿瘤EMT的关键转录因子, 这些因子水平升高与患者预后不良有关[4]。
肿瘤微环境是影响肿瘤进展一个重要因素, 其成分包括肿瘤相关成纤维细胞(cancer associated fibroblast, CAF)[5]、细胞外基质(extracellular matrix, ECM)[6]、淋巴细胞等, 其中CAF能够通过旁分泌形式分泌生长因子TGF-β和炎性因子IL-6促进肿瘤EMT[7]。然而, 其他蛋白质如何影响该过程仍然不确定。微纤维相关蛋白5(microfibril-associated protein 5, MFAP5)又称微纤维相关糖蛋白2, 是ECM的一个组成部分, 其在心血管发育、成骨过程中发挥重要作用[8]。近年有研究表明, MFAP5在胰腺癌、肺癌、头颈癌中呈高表达[9], 但MFAP5在这些肿瘤中的作用有待阐明。Mok等[10]研究发现, 在晚期卵巢浆液性乳头状腺癌中, MFAP5高表达预示预后不良。其他研究还表明, MFAP5通过黏附斑激酶(focal adhesion kinase, FAK)/cAMP反应元件结合蛋白(cAMP-response element binding protein, CREB)/肌钙蛋白C基因1(troponin C type 1, TNNC1)信号转导通路介导卵巢癌细胞的运动和侵袭潜能, 表明它可能是卵巢癌治疗的一个新靶点[11]。另外, MFAP5还可促进肿瘤细胞化学治疗耐药及肿瘤血管新生[12]。然而, 目前MFAP5在膀胱癌中的表达情况及其在膀胱癌发生、发展中扮演的角色尚未见报道。本研究检测MFAP5在膀胱癌组织中的表达水平, 并通过体外细胞实验探讨其在膀胱癌进展中的作用。
1 材料和方法 1.1 组织样本50例膀胱癌石蜡切片为2007年8月至2015年8月上海交通大学附属第一人民医院确诊的膀胱癌患者手术切除组织标本, 并收集每例患者基本信息及临床病理信息。本研究通过上海交通大学附属第一人民医院生物医学伦理委员会审批。
1.2 细胞培养与处理从膀胱肿瘤组织分离纯化CAF, 从正常膀胱组织分离纯化正常成纤维细胞(normal fibroblast, NF)。采用酶解法制备单细胞悬液, 均匀地接种于培养皿上, 原代细胞培养5~7 d后, 细胞汇合成单层, 用胰蛋白酶消化, 采用差时贴壁法经过2~3次贴壁选择后, 获得纯化的成纤维细胞, 取生长状态良好的第3代细胞, 采用蛋白质印迹法进行鉴定, NF为α平滑肌肌动蛋白阴性, CAF为α平滑肌肌动蛋白阳性。用含10% FBS的DMEM/F12培养液于37 ℃、5% CO2培养箱中培养。人膀胱癌细胞系T24、5637、UMUC3、J82购自中国科学院上海细胞库, 用含10% FBS的RPMI 1640培养液培养于37 ℃、5% CO2培养箱中培养。细胞用无血清培养液饥饿处理8 h后, 更换新鲜无血清RPMI 1640培养液, 加入终浓度为200 ng/mL、400 ng/mL重组人MFAP5蛋白, 以加入等体积生理盐水为对照, 12 h后进行细胞功能实验, 48 h后提取细胞蛋白检测相关指标。
1.3 主要实验试剂重组人MFAP5蛋白(货号4914-MG)购自美国R & D公司;RNA抽提试剂TRIzol(货号9108)、反转录试剂盒(货号RR047A)购自日本TaKaRa公司;qRT-PCR试剂盒(货号Q341-AA)购自南京诺唯赞生物科技有限公司;RIPA蛋白裂解液(货号P0013B)购自上海碧云天生物技术有限公司;免疫组织化学试剂盒(货号9706)、DAB显色试剂盒(货号DAB-0031)购自福州迈新生物技术开发有限公司;N-钙黏蛋白抗体(货号22018)、E-钙黏蛋白抗体(货号20874)、ZEB1抗体(货号21544)、基质金属蛋白酶(matrix metalloproteinase, MMP)9抗体(货号10375)购自美国Proteintech公司, Twist1/2抗体(货号GTX217310)购自美国GeneTex公司, GAPDH抗体(货号sc-32233)购自美国Santa Cruz公司。
1.4 免疫组织化学染色石蜡切片经二甲苯脱蜡, 梯度乙醇水化, 将其置于柠檬酸钠缓冲液中蒸煮25 min进行抗原修复。冷却至室温后, 按照DAB显色试剂盒说明书将组织除去内源性过氧化物酶活性、抗原封闭、一抗4 ℃孵育过夜、二抗室温孵育10 min后, 以DAB进行化学染色并实时显微镜下观察, 根据颜色变化情况决定染色时间。封片后按染色强度进行评分:0分为无表达, 1分为低表达, 2分为中等表达, 3分为高表达。
1.5 qRT-PCR使用TRIzol法提取细胞总RNA, 经反转录获得cDNA。以cDNA为模板进行PCR, 以β-actin作为内参照。引物序列:MFAP5上游引物5'-ACA CGA AGC TAT GAA AGA TGA GC-3', 下游引物5'-AGT CGG AAG TAA TTG GAG CGA-3';β-actin上游引物5'-CAT GTA CGT TGC TAT CCA GGC-3', 下游引物5'-CTC CTT AAT GTC ACG CAC GAT-3'。通过2-ΔΔCt法计算目的基因相对表达量。
1.6 蛋白质印迹法用含蛋白酶抑制剂的RIPA蛋白裂解液提取细胞总蛋白, BCA法进行蛋白定量, 100 ℃煮沸15 min, 然后于-20 ℃保存。按每孔20 μg蛋白量上样, 通过SAS-PAGE分离蛋白。湿转法转膜90 min后, 用含5%脱脂奶粉的吐温-磷酸盐缓冲液(phosphate buffer saline-Tween, PBST)封闭1 h, 随后更换为按合适稀释比配制好的相应抗体稀释液, 4 ℃过夜孵育。将膜用PBST漂洗3次后加入二抗稀释液室温孵育1 h, 再用PBST洗膜3次, 随后使用ECL化学发光液进行显影、拍照。
1.7 Transwell侵袭实验取经过处理后的T24、5637细胞, 胰蛋白酶消化后用无血清细胞培养液重悬, 取100 μL含有1×105个细胞的无血清RPMI 1640培养液接种于带基质胶的Transwell上室, 下室中加入600 μL含10% FBS的RPMI 1640培养液, 于37 ℃、5% CO2培养箱内培养, T24细胞培养12 h, 5637细胞培养18 h。取出小室后用PBS漂洗3次, 加入4%多聚甲醛溶液固定细胞15 min, 再用PBS漂洗3次, 用0.1%结晶紫染色15 min。洗去结晶紫后在显微镜下观察并计数细胞。
1.8 划痕实验将细胞接种于6孔板, 待细胞生长至完全融合后, 使用移液枪头沿每孔底部划痕, 后用PBS洗去脱落的细胞, 换上含1% FBS的RPMI 1640培养液, 于显微镜下观察、拍照并记录划痕宽度, 48 h后观察划痕修复情况。
1.9 生物信息学分析下载美国癌症基因组图谱(the Cancer Genome Atlas, TCGA)数据库(https://cancergenome.nih.gov)及基因表达汇编(Gene Expression Omnibus, GEO)数据库(https://www.ncbi.nlm.nih.gov/geo)GSE13507数据集中的膀胱癌表达谱数据和对应临床资料, 将患者肿瘤样本MFAP5表达水平由低到高排列, 进行对比分析。
1.10 统计学处理采用GraphPad Prism 6软件进行统计学分析。符合正态分布的计量资料以x±s表示, 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析;呈偏态分布的计量资料以中位数(下四分位数, 上四分位数)表示, 两组间比较采用Mann-Whitney U检验;计数资料以例数表示, 组间比较采用χ2检验。采用Pearson相关分析确定不同基因表达的相关性, Kaplan-Meier生存曲线与log-rank检验分析总体生存情况。检验水准(α)为0.05。
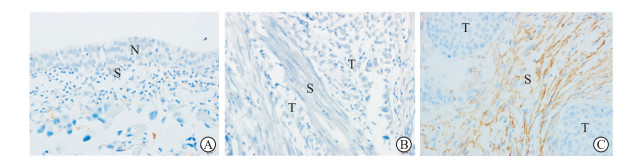
2 结果 2.1 膀胱癌组织和细胞中MFAP5的表达石蜡切片免疫组织化学结果(图 1)显示, 在正常膀胱上皮组织和非肌层浸润性膀胱癌组织中, MFAP5在间质组织中呈低表达状态;而在肌层浸润性膀胱癌组织中, MFAP5高表达于肿瘤间质。肌层浸润性膀胱癌组织中MFAP5的染色评分[(2.04±0.15)分, n=20]高于非肌层浸润膀胱癌组织[(1.20±0.15)分, n=30)], 差异有统计学意义(P<0.01)。如表 1所示, MFAP5的表达水平与膀胱癌T分期和肿瘤分级有关(P<0.01、P<0.05)。qRT-PCR检测结果显示, CAF中MFAP5 mRNA相对表达量(25.07±1.34, n=3)高于NF及人膀胱癌细胞系T24、5637、UMUC3、J82(5.38±0.04、1.14±0.09、2.56±0.10、0.60±0.19、0.98±0.12, n=3), 差异均有统计学意义(P均<0.01)。
|
图 1 免疫组织化学染色检测各级别膀胱癌样本中MFAP5定位情况 Fig 1 Localization of MFAP5 in bladder cancer samples at each grade detected by immunohistochemistry staining A: Normal bladder; B: Non-muscle invasive bladder cancer; C: Muscle invasive bladder cancer. MFAP5: Microfibril-associated protein 5; N: Normal urothelium; S: Stroma; T: Tumor. Original magnification: ×400 |
|
|
表 1 MFAP5表达与膀胱癌患者临床病理特征的关系 Tab 1 Correlation between MFAP5 expression and clinicopathological features of bladder cancer patients |
2.2 膀胱癌组织中MFAP5表达与临床病理特征的关系
TCGA数据库膀胱癌组织全转录组测序结果显示, 相较于低级别(n=21)、低分期(Ⅰ+Ⅱ, n=132)、浅肌层浸润(T2, n=119)、无淋巴结转移(N0, n=237)的膀胱癌组织样本, 高级别(n=384)、高分期(Ⅲ+Ⅳ, n=274)、深肌层浸润(T3~4, n=252)、伴淋巴结转移(≥N1, n=129)的膀胱癌组织样本中MFAP5表达水平均升高[分别为0.909(0.122, 3.757)vs 0.035(0.008, 0.119)、1.454(0.203, 5.014)vs 0.129(0.019, 1.105)、1.557(0.241, 5.170)vs 0.212(0.020, 1.239)、1.516(0.120, 5.775)vs 0.669(0.083, 3.006)], 差异均有统计学意义(P均<0.01)。GSE13507微阵列芯片分析结果也表明, MFAP5在高级别(7.63±0.15, n=60)、高侵袭性(7.84±0.17, n=62)、伴淋巴结转移(7.85±0.33, n=16)、肌层浸润(7.86±0.18, n=61)的膀胱癌组织中表达较高, 与低级别(7.20±0.07, n=105)、低侵袭性(7.06±0.03, n=103)、无淋巴结转移(7.29±0.07, n=149)、非肌层浸润(7.06±0.03, n=104)的膀胱癌组织相比差异均有统计学意义(P均<0.05)。
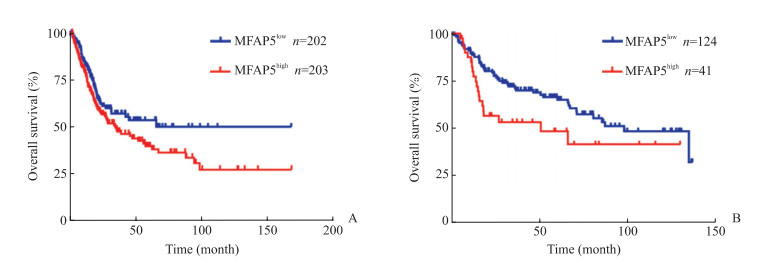
2.3 膀胱癌组织中MFAP5表达与预后的关系根据TCGA全转录组测序数据库中提取的膀胱癌样本中MFAP5表达水平, 按中位值(54.735 5)将患者分为MFAP5高表达组(n=203)和低表达组(n=202), Kaplan-Meier分析结果示, MFAP5高表达组患者总生存期短于MFAP5低表达组患者, 差异有统计学意义(P=0.036 6, 图 2A)。根据GSE13507微阵列芯片数据库膀胱癌样本中MFAP5表达水平, 按高表达:低表达=1:3取界值为7.21, MFAP5高表达组(n=41)患者总生存期也短于MFAP5低表达组(n=124)患者, 差异有统计学意义(P=0.037 0, 图 2B)。
|
图 2 MFAP5表达对膀胱癌患者总生存期的影响 Fig 2 Effect of MFAP5 expression on overall survival of bladder cancer patients A: The bladder cancer patients with high-expression level of MFAP5 had a shorter overall survival (MFAP5 expression data were derived from whole transcriptome sequencing database of TCGA); B: The bladder cancer patients with high-expression level of MFAP5 had a shorter overall survival (MFAP5 expression data were derived from microarray database of GSE13507). MFAP5: Microfibril-associated protein 5; TCGA: The Cancer Genome Atlas |
2.4 MFAP5表达与EMT相关分子密切相关
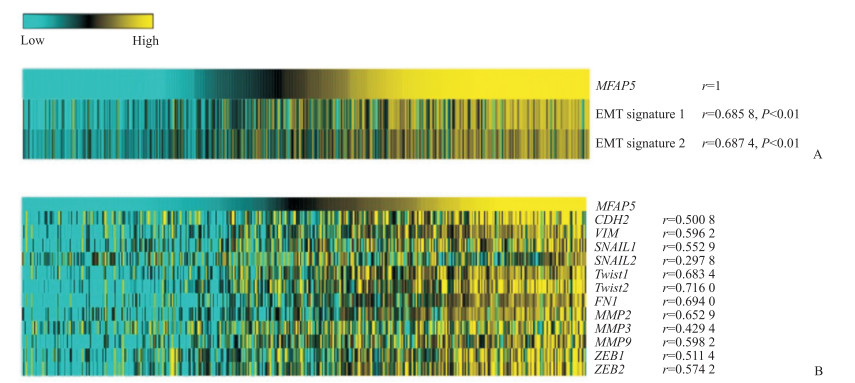
运用基因集差异分析(gene set variation analysis, GSVA)方法分析MFAP5表达水平与膀胱癌转移密切相关的EMT基因集的相关性, 结果(图 3A)显示在TCGA膀胱癌测序数据库中, 2个已有文献报道[13-14]的EMT基因集均显著富集于MFAP5高表达组(r=0.685 8、0.687 4, P均<0.01);另外, EMT相关基因钙黏蛋白2、波形蛋白、Snail家族转录抑制因子1/2(Snail family transcriptional repressor 1/2, SNAIL1/2)、Twist1/2、纤连蛋白1、MMP2/3/9、ZEB1/2在MFAP5高表达组患者样本中也呈高表达(图 3B)。Pearson相关分析结果显示, 在单基因水平MFAP5表达水平与EMT相关基因钙黏蛋白2、Twist1、MMP9、ZEB1存在强相关性(r=0.500 8、0.683 4、0.598 2、0.511 4, P均<0.01, n=414)。
|
图 3 MFAP5表达水平与EMT相关分子密切相关 Fig 3 Expression level of MFAP5 is closely related to EMT-related molecules A: Correlation of MFAP5 expression with two EMT signatures analyzed by GSVA was presented with heat map; B: Correlation of MFAP5 expression with EMT-associated markers was presented with heat map. MFAP5: Microfibril-associated protein 5; EMT: Epithelial-mesenchymal transition; CDH2: Cadherin 2; VIM: Vimentin; SNAIL: Snail family transcriptional repressor; FN1: Fibronectin 1; MMP: Matrix metalloproteinase; ZEB: Zinc-finger E-box-binding protein; GSVA: Gene set variation analysis |
2.5 MFAP5对人膀胱癌细胞EMT相关蛋白表达的影响
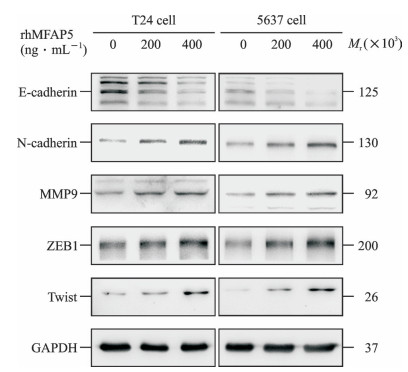
蛋白质印迹法检测结果(图 4、表 2)显示, 在T24、5637细胞中, 200和400 ng/mL重组人MFAP5蛋白均可有效促进N-钙黏蛋白、MMP9、ZEB1、Twist的表达, 同时抑制E-钙黏蛋白表达, 与对照组相比差异均有统计学意义(P<0.05或P<0.01)。
|
图 4 蛋白质印迹法检测rhMFAP5对膀胱癌细胞中EMT相关蛋白表达的影响 Fig 4 Effects of rhMFAP5 on expression of EMT-related proteins in bladder cancer cells detected by Western blotting rhMFAP5: Recombinant human microfibril-associated protein 5; EMT: Epithelial-mesenchymal transition; MMP9: Matrix metalloproteinase 9; ZEB1: Zinc-finger E-box-binding protein 1; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
|
|
表 2 蛋白质印迹法检测rhMFAP5处理后膀胱癌细胞EMT相关蛋白表达定量结果 Tab 2 Quantitative results of EMT-related protein expression in bladder cancer cells treated with rhMFAP5 detected by Western blotting |
2.6 MFAP5表达对人膀胱癌细胞迁移与侵袭的影响
划痕实验结果(图 5A、5B)显示, 在经过200和400 ng/mL重组人MFAP5蛋白刺激后, 膀胱癌细胞T24、5637的迁移能力均增强(T24:55.00±1.53、65.57±1.80, 5637:53.47±1.58、65.17±0.73), 与对照组(0 ng/mL, 37.87±2.08、35.5±1.53)相比差异均有统计学意义(P均<0.01)。Transwell侵袭实验结果(图 5C、5D)显示, 200和400 ng/mL重组人MFAP5蛋白可以促进膀胱癌细胞T24、5637的侵袭能力(T24:147.70±6.17、195.30±6.49, 5637:63.67±3.18、66.33±2.40), 与对照组(0 ng/mL, 79.00±2.65、31.67±1.45)相比差异均有统计学意义(P均<0.01)。
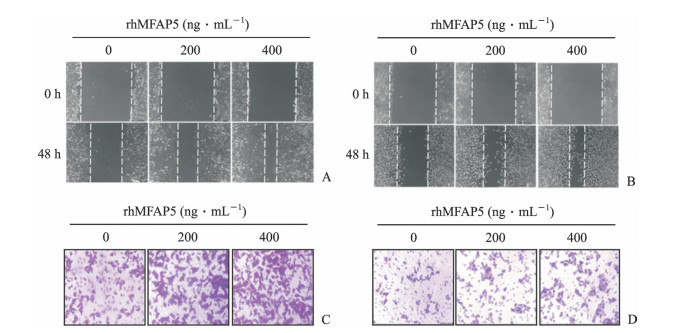
|
图 5 rhMFAP5对膀胱癌细胞迁移、侵袭能力的影响 Fig 5 Effects of rhMFAP5 on migration and invasion of bladder cancer cells A, B: The results of wound healing assay showed that the migration abilities of T24 (A) and 5637 (B) cells were increased after treatment with rhMFAP5; C, D: The results of Transwell assay showed that the invasion abilities of T24 (C) and 5637 (D) cells were increased after treatment with rhMFAP5. rhMFAP5: Recombinant human microfibril-associated protein 5. Original magnification: ×100 (A, B), ×200 (C, D) |
3 讨论
迄今为止, 人们对膀胱癌的遗传特征和生物学基础知之甚少, 尚没有针对膀胱癌的靶向治疗措施, 因此, 现有研究越来越多地关注膀胱癌的病因、发病机制, 尤其是侵袭和转移过程。随着对肿瘤细胞生长、增殖和凋亡分子机制的进一步研究, 寻找膀胱癌靶向治疗的生物标志物已迫在眉睫。EMT的激活被认为可以启动侵袭、转移级联反应这一早期步骤, 是肿瘤细胞迁移、侵袭过程中的重要一步[15]。研究表明, 膀胱癌的发展和进程涉及多种信号转导途径, 如TGF-β、丝裂原活化细胞外信号调节激酶/PI3K、整联蛋白(integrin)、Notch途径等[16]。
MFAP5是一种由微纤维构成的基质糖蛋白, 可调节内皮细胞的行为, 还可通过激活或抑制Notch1的活性促进血管生成并与Notch1相互作用, 具体取决于所涉及的细胞类型[17]。MFAP5主要定位于弹性组织, 如韧带、动脉和肺[18]。然而, 已有研究表明MFAP5也在某些肿瘤中高表达, 并与肿瘤转移、耐药密切相关[9-12]。Leung等[11]研究发现, 在卵巢癌中, 肿瘤间质中成纤维细胞可以分泌MFAP5促进肿瘤细胞的侵袭和迁移。本研究通过免疫组织化学染色证明, 在膀胱癌中MFAP5主要表达于间质组织, 且主要表达于CAF中, 其在肌层浸润性膀胱癌组织中的表达水平高于非肌层浸润性膀胱癌组织。利用公开数据库TCGA与GEO数据进行生物信息学分析发现, 相较于低级别、低分期(Ⅰ+Ⅱ)、浅肌层浸润(T2)、无淋巴结转移(N0)的膀胱癌组织样本, 高级别、高分期(Ⅲ+Ⅳ)、深肌层浸润(T3~4)、伴淋巴结转移(≥N1)的膀胱癌组织样本中MFAP5的表达水平较高, 并且MFAP5高表达组患者总生存期短于MFAP5低表达组患者。因此, 我们推测MFAP5在膀胱肿瘤的浸润、转移进程中可能扮演着重要角色。
Li等[9]研究证实, MFAP5可以促进宫颈癌的侵袭、转移能力。为了深入探讨MFAP5在膀胱癌浸润、转移过程中的功能, 本研究利用生物信息学分析发现, 膀胱癌中MFAP5的上调与TNM分期和淋巴结转移有关, 另外EMT基因集在MFAP5高表达的膀胱肿瘤组织中显著富集, 并且MFAP5表达水平与包括钙黏蛋白2、ZEB1、MMP9等在内的EMT相关基因存在较强的正相关性。蛋白质印迹实验表明, 经过重组人MFAP5蛋白刺激后的膀胱癌细胞促EMT指标N-钙黏蛋白、ZEB1、Twist、MMP9表达增加, 同时抑制EMT过程的E-钙黏蛋白表达水平下降。划痕实验和Transwell侵袭实验结果显示, 经重组人MFAP5蛋白刺激后膀胱癌细胞的迁移和侵袭呈剂量依赖性增高。
综上所述, 本研究证实MFAP5在膀胱癌的侵袭、转移过程中发挥着重要作用, 其可刺激肿瘤细胞EMT相关蛋白表达进而促进细胞迁移、侵袭。这一发现有助于进一步理解肿瘤微环境促进肿瘤细胞侵袭、迁移的机制, 并且MFAP5作为一个潜在的膀胱癌预后指标, 为寻找膀胱癌新的治疗靶点提供了新的思路, 但是仍需通过动物实验和临床研究进一步明确MFAP5在膀胱癌中的作用机制。
志谢 感谢上海交通大学附属第一人民医院病理科提供的检测方案支持;感谢南京大学模式动物研究所严俊课题组、中国科学院上海药物研究所黄锐敏课题组提供的技术支持。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. |
| [2] |
DY G W, GORE J L, FOROUZANFAR M H, NAGHAVI M, FITZMAURICE C. Global burden of urologic cancers, 1990-2013[J]. Eur Urol, 2017, 71: 437-446. |
| [3] |
LAMOUILLE S, XU J, DERYNCK R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol, 2014, 15: 178-196. |
| [4] |
SÁNCHEZ-TILLÓ E, LIU Y, DE BARRIOS O, SILES L, FANLO L, CUATRECASAS M, et al. EMT-activating transcription factors in cancer: beyond EMT and tumor invasiveness[J]. Cell Mol Life Sci, 2012, 69: 3429-3456. |
| [5] |
AO Z, SHAH S H, MACHLIN L M, PARAJULI R, MILLER P C, RAWAL S, et al. Identification of cancer-associated fibroblasts in circulating blood from patients with metastatic breast cancer[J]. Cancer Res, 2015, 75: 4681-4687. |
| [6] |
SOOD D, TANG-SCHOMER M, POULI D, MIZZONI C, RAIA N, TAI A, et al. 3D extracellular matrix microenvironment in bioengineered tissue models of primary pediatric and adult brain tumors[J/OL]. Nat Commun, 2019, 10: 4529. doi: 10.1038/s41467-019-12420-1.
|
| [7] |
GUO S, DENG C X. Effect of stromal cells in tumor microenvironment on metastasis initiation[J]. Int J Biol Sci, 2018, 14: 2083-2093. |
| [8] |
LEMAIRE R, BAYLE J, MECHAM R P, LAFYATIS R. Microfbril-associated MAGP-2 stimulates elastic fber assembly[J]. J Biol Chem, 2007, 282: 800-808. |
| [9] |
LI Q, ZHANG Y, JIANG Q. MFAP5 suppression inhibits migration/invasion, regulates cell cycle and induces apoptosis via promoting ROS production in cervical cancer[J]. Biochem Biophys Res Commun, 2018, 507. |
| [10] |
MOK S C, BONOME T, VATHIPADIEKAL V, BELL A, JOHNSON M E, WONG K K, et al. Gene signature predictive for outcome in advanced ovarian cancer identifies a survival factor: microfibril-associated glycoprotein 2[J]. Cancer Cell, 2009, 16: 521-532. |
| [11] |
LEUNG C S, YEUNG T L, YIP K P, PRADEEP S, BALASUBRAMANIAN L, LIU J, et al. Calcium-dependent FAK/CREB/TNNC1 signaling mediates the effect of stromal MFAP5 on ovarian cancer metastatic potential[J/OL]. Nat Commun, 2014, 5: 5092. doi: 10.1038/ncomms6092.
|
| [12] |
LEUNG C S, YEUNG T L, YIP K P, WONG K K, HO S Y, MANGALA L S, et al. Cancer-associated fibroblasts regulate endothelial adhesion protein LPP to promote ovarian cancer chemoresistance[J]. J Clin Invest, 2018, 128: 589-606. |
| [13] |
ROBERTSON A G, KIM J, AL-AHMADIE H, BELLMUNT J, GUO G, CHERNIACK A D, et al. Comprehensive molecular characterization of muscle-invasive bladder cancer[J/OL]. Cell, 2017, 171: 540-556.e25. doi: 10.1016/j.cell.2017.09.007.
|
| [14] |
CHEN F, ZHANG Y, BOSSÉ D, LALANI A A, HAKIMI A A, HSIEH J J, et al. Pan-urologic cancer genomic subtypes that transcend tissue of origin[J/OL]. Nat Commun, 2017, 8: 199. doi: 10.1038/s41467-017-00289-x.
|
| [15] |
LI J, ZHOU B P. Activation of β-catenin and Akt pathways by Twist are critical for the maintenance of EMT associated cancer stem cell-like characters[J/OL]. BMC Cancer, 2011, 11: 49. doi: 10.1186/1471-2407-11-49.
|
| [16] |
JING Y, HAN Z, ZHANG S, LIU Y, WEI L. Epithelial-mesenchymal transition in tumor microenvironment[J/OL]. Cell Biosci, 2011, 1: 29. doi: 10.1186/2045-3701-1-29.
|
| [17] |
ALBIG A R, BECENTI D J, ROY T G, SCHIEMANN W P. Microfbril-associate glycoprotein-2 (MAGP-2) promotes angiogenic cell sprouting by blocking notch signaling in endothelial cells[J]. Microvasc Res, 2008, 76: 7-14. |
| [18] |
GIBSON M A, LEAVESLEY D I, ASHMAN L K. Microfbril-associated glycoprotein-2 specifically interacts with a range of bovine and human cell types via αVβ3 integrin[J]. J Biol Chem, 1999, 274: 13060-13065. |
 2020, Vol. 41
2020, Vol. 41


