2. 海军军医大学(第二军医大学)基础医学院学员八队, 上海 200433;
3. 海军军医大学(第二军医大学)长海医院呼吸与危重症医学科, 上海 200433
2. The Eighth Student Team, College of Basic Medical Sciences, Naval Medical University(Second Military Medical University), Shanghai 200433, China;
3. Department of Respiratory and Critical Care Medicine, Changhai Hospital, Naval Medical University(Second Military Medical University), Shanghai 200433, China
由严重急性呼吸综合征冠状病毒2(severe acute respiratory sydrome coronavirus 2,SARS-CoV-2)感染引起的新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)疫情迅速在世界范围内大规模暴发[1-3],给人类健康造成了巨大威胁。SARS-CoV-2与严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)同属于SARS相关冠状病毒家族。目前,针对SARS-CoV-2疫苗的研发进展迅速,全球在研的候选疫苗有减毒疫苗、灭活疫苗、病毒载体疫苗、重组疫苗、病毒样颗粒疫苗、mRNA疫苗、DNA疫苗等多种类型,已有多种不同类型的疫苗进入临床试验阶段。除了灭活疫苗,这些疫苗中绝大多数以SARS-CoV-2的表面刺突蛋白(spike protein,S蛋白)为靶抗原。S蛋白由介导病毒颗粒与靶细胞受体结合的S1亚基和介导病毒包膜与靶细胞内体膜之间发生融合的S2亚基组成,其中S1是诱导中和抗体的关键多肽[4-5]。S1亚基的羧基端存在一个受体结合区(receptor-binding domain,RBD),RBD是介导S蛋白与病毒的细胞受体血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)结合的关键区域,是中和抗体表位集中的区域[6]。
冠状病毒疫苗研发的一个瓶颈问题是诱导产生可能引起抗体依赖的病毒感染增强效应(antibody-dependent enhancement of virus infection,ADE)的非中和抗体[7-10]。ADE也见于其他病毒,如登革病毒、埃博拉病毒、呼吸道合胞病毒等[11]。与病毒颗粒结合的非中和抗体通过其Fc段与单核-巨噬细胞表面的IgG Fc段结合,促进病毒颗粒被这些细胞吞噬,从而促进病毒对这些非天然靶细胞的感染[12]。防止疫苗诱导产生ADE的一个有效策略是选择合适的靶抗原,尽量减少非中和抗体的产生。相比SARS-CoV-2全长S蛋白,用含有优势中和表位的S1亚基或RBD为疫苗靶抗原,可能有助于降低疫苗诱导产生ADE风险,提高其安全性。本研究分别用基于SARS-CoV-2 S蛋白RBD的DNA疫苗和基于S1的重组亚单位疫苗接种小鼠,检测这2种疫苗诱导中和抗体的效力,初步探讨以RBD或S1亚基作为疫苗靶抗原的可行性。
1 材料和方法 1.1 质粒、重组抗原、佐剂、COVID-19患者恢复期血清SARS-CoV-2 S基因表达质粒phCMV-Sopti由本实验室构建,根据哺乳动物细胞偏爱的密码子及mRNA二级结构的稳定性等原则进行序列优化;哺乳动物细胞表达质粒载体pVRC由中国疾病预防控制中心谭文杰研究员提供,本实验室对该质粒进行了改建,引入多个单一酶切位点,并加入人IgG1分泌性信号肽序列,在信号序列的3’端引入NotⅠ酶切位点,用于连接外源基因;含有小鼠IgG1 Fc段(mFc)的质粒pMD-18T-ZIKV NS1-mFc由本实验室构建;CHO细胞重组表达的SARS-CoV-2 S1与人IgG1 Fc段(S1-hFc)融合蛋白由北京派迪畅科技发展有限公司提供;二价锰离子佐剂由北京大学蒋争凡教授提供;COVID-19患者恢复期血清样本来源于江苏大学附属镇江第三人民医院收治的确诊患者,在患者治愈出院3周后采集。
1.2 DNA疫苗质粒构建、表达产物鉴定与大量抽提以含序列优化的S基因质粒phCMV-Sopti为模板,通过PCR扩增SARS-CoV-2 S基因RBD,上游引物序列为5’-GCG GCC GCA TTC ACA GTG GAG AAG GGC ATC-3’(含NotⅠ酶切位点),下游引物序列为5’-GGA TCC GCC GTG CCC CGC GAC TGC GG-3’(含BamHⅠ酶切位点)。所得PCR产物与pMD-18T质粒载体连接,经DNA测序鉴定后,以NotⅠ/BamHⅠ切出RBD序列。以含有mFc的质粒pMD-18T-ZIKV NS1-mFc为模板,通过PCR扩增mFc基因片段,上游引物序列为5’-GGA TCC GCC GTG CCC CGC GAC TGC-3’(含BamHⅠ酶切位点),下游引物序列为5’-GAA TTC AAC TCA CTT GCC GGG GCT GTG GCT CAG-3’(含EcoRⅠ酶切位点)。所得PCR产物与pMD-18T质粒载体连接,经DNA测序鉴定以后,以BamHⅠ/EcoRⅠ切出mFc序列。将切出的RBD和mFc DNA片段与同样以NotⅠ/EcoRⅠ线性化的pVRC质粒连接,以酶切和DNA测序进行鉴定,得到的质粒命名为pVRC-RBD-mFc。将该质粒用脂质体2000(美国ThermoFisher公司)转染人胚肾细胞293T,取培养上清进行SDS-PAGE,随后用蛋白质印迹法检测RBD-mFc融合蛋白,检测抗体为HRP标记的山羊抗小鼠IgG(美国ThermoFisher公司),用化学发光法显示蛋白条带。用去内毒素质粒大量抽提试剂盒[天根生化科技(北京)有限公司]抽提质粒pVRC-RBD-mFc及对照空载体pVRC,溶解于PBS(pH 7.4),用于小鼠免疫。
1.3 小鼠免疫6周龄雌性BALB/c小鼠购于上海灵畅生物科技有限公司[动物生产许可证号:SCXK(沪)2018-0003]。S1-hFc融合蛋白免疫:将S1-hFc融合蛋白、二价锰离子佐剂及PBS(pH 7.4)混合,随后注射小鼠股四头肌。每只小鼠注射剂量:融合蛋白2 μg,二价锰离子佐剂50 μg,总体积100 μL,每侧股四头肌注射50 μL。以注射等量二价锰离子佐剂作为对照。DNA免疫:分别将质粒pVRC-RBD-mFc及对照空载体pVRC用PBS(pH 7.4)调整至质量浓度为500 μg/mL,注射小鼠股四头肌,每只小鼠注射剂量:质粒100 μg,总体积200 μL,每侧股四头肌注射100 μL。另设置PBS阴性对照组,每侧股四头肌注射100 μL PBS。每组5只小鼠,首次免疫2周后(即第15天)加强免疫1次,剂量与首次相同。
1.4 抗体检测用毛细管从小鼠眼眶穿刺取血,高速离心分离出血清,冻存于-80 ℃冰箱备用。用ELISA试剂盒(北京派迪畅科技发展有限公司)检测小鼠血清中的SARS-CoV-2 S1 IgG。小鼠血清从1:25开始连续倍比稀释,加入酶标板微孔,置于脱色摇床上室温慢摇30 min,随后弃血清稀释液,用洗液洗孔3次;加入1:1 500倍稀释的HRP标记的山羊抗小鼠IgG,置于脱色摇床上室温慢摇30 min;随后弃二抗反应液,用洗液洗孔3次,每孔加入TMB底物显色液A、B各50 μL,置于脱色摇床上慢摇5 min;加入终止液50 μL,轻轻混匀,用酶标仪检测光密度(D)值,主波长450 nm,参考波长630 nm。特定稀释度血清D450-D630大于PBS阴性对照组小鼠混合血清相同稀释度D450-D630平均值的2.1倍为阳性,抗体阳性的血清最大稀释度即为抗体滴度。
1.5 病毒中和实验病毒中和实验在海军军医大学(第二军医大学)P3实验室进行。以微量中和实验检测小鼠免疫血清、pVRC-RBD-mFc质粒表达产物、S1-hFc融合蛋白的病毒中和活性。
1.5.1 血清病毒中和活性检测将Vero E6细胞(复旦大学上海医学院张荣研究员馈赠)接种于96孔板,每孔8 000~10 000个细胞,置于5% CO2、37 ℃、饱和湿度的孵箱中培养。第2天用96孔板将免疫小鼠血清从1:25开始连续倍比稀释,稀释液用含2% FBS的DMEM培养液与约300 FFU(病灶形成单位,focus forming unit)的SARS-CoV-2混合,总体积100 μL,置于37 ℃孵箱中孵育30 min。然后取出过夜培养的Vero E6细胞,吸除培养液,加入小鼠血清-病毒混合液,再培养24 h后,用免疫荧光法检测细胞中SARS-CoV-2蛋白的表达。一抗用COVID-19患者恢复期血清,荧光二抗用Alexa Fluor® 488标记的抗人IgG(美国ThermoFisher公司)。荧光抗体反应结束后,用DAPI染细胞核。用全自动细胞成像及分析系统(Cytation 5 Imaging Reader,美国BioTek公司)计数每孔中发射绿色荧光的细胞数量,计算血清对病毒的中和率:中和率(%)=(1-免疫小鼠血清处理孔病毒感染的细胞数量/阴性对照小鼠血清处理孔病毒感染的细胞数量)×100%。根据各个稀释度血清的中和率计算中和50%病毒感染的血清最高稀释度,即IC50。
1.5.2 pVRC-RBD-mFc质粒表达产物、S1-hFc融合蛋白的病毒中和活性检测将pVRC-RBD-mFc质粒转染的293T细胞培养上清用截留分子质量为30 000的超滤离心管高速离心,浓缩10倍,然后分别取1、10和20 μL,预先加入接种有Vero E6细胞的96孔板,浓缩液与培养液共80 μL。细胞培养30 min后,加入20 μL病毒液,再培养24 h后用免疫荧光法检测SARS-CoV-2感染的细胞。S1-hFc融合蛋白对病毒感染的中和作用设置每孔0.05 μg和0.5 μg 2个剂量,分别以每孔0.05 μg和0.5 μg小鼠IgG1及PBS作为阴性对照。根据各组处理孔中病毒感染的细胞数量计算抑制率:抑制率(%)=(1-实验孔病毒感染的细胞数量/PBS处理孔病毒感染的细胞数量)×100%。
1.6 统计学处理应用Excel 2010软件进行统计学分析。将血清抗体滴度和病毒中和IC50进行对数变换,抗体阴性血清滴度以0计。计量资料以x±s表示,两组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 SARS-CoV-2 RBD表达质粒的鉴定SARS-CoV-2 S蛋白的功能分区如图 1A所示,SARS-CoV-2 RBD表达质粒pVRC-RBD-mFc的结构如图 1B所示。RBD基因的5’端连接在人IgG1信号肽基因的3’端,可使表达产物分泌出细胞;RBD基因3’端与小鼠IgG1 Fc基因的5’端相连,可使融合蛋白形成二聚体。质粒中融合基因的序列经DNA测序鉴定与预期一致。将质粒pVRC-RBD-mFc转染293T细胞,6 h后换用低血清opti-MEM培养液,48 h以后用蛋白质印迹法检测细胞培养上清中的RBD-mFc,可检测到与预测的RBD-mFc融合蛋白相对分子质量53 000一致的蛋白条带;还可见到一相对分子质量较小的蛋白条带,与小鼠Fc段26 000相符,因此其可能是从RBD-mFc融合蛋白中断裂出的Fc段多肽(图 1C)。

|
图 1 SARS-CoV-2 RBD表达质粒的结构与表达产物鉴定 Fig 1 Structure diagram of SARS-CoV-2 RBD expression plasmid and identification of its expression product A: Schematic structure of SARS-CoV-2 spike protein; B: Structure diagram of SARS-CoV-2 RBD expression plasmid pVRC-RBD-mFc; C: Western blotting analysis of RBD-mFc fusion protein in supernatants of pVRC-RBD-mFc-transfected 293T cells (M: Marker; 1: Supernatant of 293T cells transfected with mock vector pVRC; 2: Supernatant of 293T cells transfected with pVRC-RBD-mFc). SARS-CoV-2: Severe acute respiratory syndrome coronavirus 2; RBD: Receptor-binding domain; S1: Spike protein S1 subunit; S2: Spike protein S2 subunit; hCMV-p: Human cytomegalovirus promotor; hIgG1: Human immunoglobulin G1; mFc: Mouse immunoglobulin G1 Fc fragment |
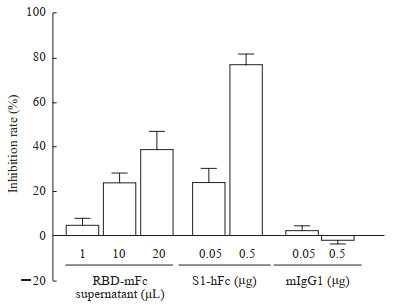
2.2 RBD-mFc和S1-hFc融合蛋白对SARS-CoV-2感染的抑制作用
采用微量中和实验检测pVRC-RBD-mFc转染293T细胞培养上清的10倍浓缩液及S1-hFc融合蛋白对SARS-CoV-2感染的抑制作用,结果如图 2所示,浓缩的pVRC-RBD-mFc转染上清及S1-hFc融合蛋白均可浓度依赖性抑制SARS-CoV-2感染,小鼠IgG1未显示出抑制作用。
|
图 2 RBD-mFc和S1-hFc融合蛋白对SARS-CoV-2感染的抑制作用 Fig 2 Inhibition effect of RBD-mFc and S1-hFc fusion proteins on SARS-CoV-2 infection RBD: Receptor-binding domain; mFc: Mouse immunoglobulin G1 Fc fragment; SARS-CoV-2: Severe acute respiratory syndrome coronavirus 2; S1: Spike protein S1 subunit; hFc: Human immunoglobulin G1 Fc fragment; mIgG1: Mouse immunoglobulin G1. n=3, x±s |
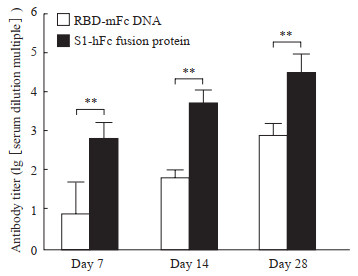
2.3 RBD-mFc DNA和S1-hFc融合蛋白免疫小鼠的抗体应答
在第0天和第15天免疫小鼠,用ELISA检测第7、14、28天小鼠血清中的抗-S1 IgG。先仅检测各组小鼠1:25和1:50稀释度的抗体水平,结果显示单纯二价锰离子佐剂注射组和空载体pVRC注射组小鼠血清中的抗-S1 IgG均为阴性(数据未显示)。随后对pVRC-RBD-mFc质粒(RBD-mFc DNA免疫组)与S1-hFc融合蛋白(S1-hFc融合蛋白免疫组)免疫的每只小鼠血清及PBS免疫小鼠的混合血清进行连续倍比稀释,检测抗-S1 IgG。RBD-mFc DNA免疫组与S1-hFc融合蛋白免疫组小鼠在3个时间点的抗体滴度如图 3所示,两组小鼠的血清抗体水平均随时间的推移而升高,且各时间点S1-hFc融合蛋白免疫组小鼠血清抗体水平均高于RBD-mFc DNA免疫组小鼠(P均<0.01)。RBD-mFc DNA免疫组在第7天有2只小鼠血清在1:25稀释时抗-S1 IgG阴性,第14和28天时抗体均为阳性;而S1-hFc融合蛋白免疫组所有小鼠在3个时间点的抗体均为阳性。
|
图 3 RBD-mFc DNA与S1-hFc融合蛋白免疫小鼠血清在3个时间点的抗-S1 IgG滴度 Fig 3 Anti-S1 IgG titers of mouse sera at three time points immunized with RBD-mFc DNA and S1-hFc fusion protein RBD: Receptor-binding domain; mFc: Mouse immunoglobulin G1 Fc fragment; S1: Spike protein S1 subunit; hFc: Human immunoglobulin G1 Fc fragment; IgG: Immunoglobulin G. **P < 0.01. n=5, x±s |
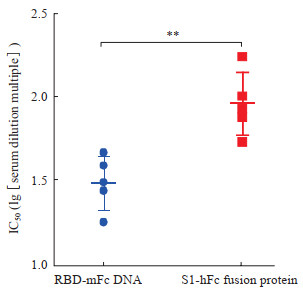
2.4 免疫小鼠血清的病毒中和活性
用微量中和实验检测第28天时RBD-mFc DNA免疫组与S1-hFc融合蛋白免疫组小鼠血清的病毒中和活性,所得IC50如图 4所示。RBD-mFc DNA免疫组有1只小鼠血清的IC50血清稀释度低于25,而S1-hFc融合蛋白免疫组均≥50,S1-hFc融合蛋白免疫组小鼠血清的IC50高于RBD-mFc DNA免疫组小鼠(P<0.01)。
|
图 4 RBD-mFc DNA与S1-hFc融合蛋白免疫小鼠血清的病毒中和活性 Fig 4 Virus neutralizing activity of sera of mice immunized with RBD-mFc DNA and S1-hFc fusion protein RBD: Receptor-binding domain; mFc: Mouse immunoglobulin G1 Fc fragment; S1: Spike protein S1 subunit; hFc: Human immunoglobulin G1 Fc fragment; IC50: Half inhibition concentration. **P < 0.01. n=5, x±s |
3 讨论
能否诱导足够浓度且持久的病毒中和抗体及避免诱导产生ADE抗体是决定SARS-CoV疫苗制备成功的2个决定因素。单核-巨噬细胞表面不表达SARS-CoV和SARS-CoV-2的受体ACE2,因此不能被病毒直接感染。但是这类细胞表面有IgG Fc段受体,可通过与病毒-非中和抗体复合物的Fc段结合,进而以内吞方式使病毒侵入细胞,造成ADE[12-13]。病毒在单核-巨噬细胞内的复制可能激活炎性因子大量表达和分泌,从而引起炎症反应。对于SARS-CoV,诱导非中和抗体效率最强的免疫原是完整病毒颗粒,随后依次是S蛋白、S1亚基和RBD[5, 14]。截至2020年5月上旬,国内已有3支SARS-CoV-2灭活疫苗获得临床批件,即将进入临床试验阶段。中国医学科学院实验动物研究所联合多个团队开展的灭活疫苗动物实验结果显示,该疫苗对恒河猴模型安全有效,未观察到ADE[15]。但有研究显示年龄越大、血浆S蛋白抗体水平越高的COVID-19患者病情越严重,提示患者血液中可能存在ADE抗体[16-19]。SARS-CoV灭活疫苗及S蛋白疫苗诱导ADE已有大量研究报道[7-10, 20]。SARS-CoV-2与SARS-CoV S2亚基的氨基酸同源性高达99%,S2被普遍认为是诱导ADE抗体的重要蛋白,因此SARS-CoV-2灭活疫苗及以S蛋白为靶抗原的其他类型疫苗极有可能诱导ADE抗体,这有待更多的研究来确认。RBD是介导SARS-CoV-2与受体ACE2结合的功能肽段,也是中和抗体的主要靶点,因此RBD及RBD所在的S1亚基可能是诱导中和抗体的最佳抗原[6]。
为了探讨基于SARS-CoV-2 RBD和S1亚基的疫苗诱导免疫保护效果,本研究分别以RBD-mFc表达质粒和S1-hFc融合蛋白免疫小鼠,观察2种免疫方式诱导中和抗体的效力。靶抗原与IgG1 Fc段融合后,Fc段通过半胱氨酸残基可形成分子间二硫键,从而使融合蛋白形成同源二聚体,提高蛋白在体内的稳定性及免疫原性。
本研究发现RBD-mFc DNA及S1-hFc融合蛋白均可抑制SARS-CoV-2对Vero E6细胞的感染,提示这2种分子均具有相应的生物活性,理论上是通过与ACE2结合而抑制病毒对细胞的感染。对小鼠免疫血清的抗体检测显示,RBD-mFc DNA与S1-hFc融合蛋白免疫小鼠均可诱导出针对S1蛋白的特异性IgG,且可中和SARS-CoV-2的感染。此外,RBD-mFc DNA免疫小鼠血清的抗体水平及中和效力均低于S1-hFc融合蛋白免疫小鼠血清,这可能涉及多种因素,如RBD本身的免疫原性、RBD-mFc的表达水平等。我们前期分别构建了SARS-CoV-2 S1和S2亚基的哺乳动物细胞表达质粒,在2个亚基的羧基末端均连接6×His作为检测标签,转染293T细胞后检测2种蛋白的表达。结果显示,无论是天然的S1基因还是序列优化的S1基因,S1的表达水平均低于S2(结果未显示)。这提示对于S1亚基或S1中的RBD,无论是DNA疫苗还是mRNA疫苗,由于内在的低表达特性,诱导保护性免疫的效力可能都不容乐观。S1-hFc融合蛋白诱导的抗体水平高于RBD-mFc DNA免疫还可能与所用的检测抗原是S1有关,在S1的氨基端和RBD的羧基端(即RBD以外区域)可能存在B细胞表位。RBD以外区域表位诱导的抗体是否具有中和活性,有待进一步研究。
本研究发现,S1-hFc融合蛋白可诱导较高水平的中和抗体,提示以S1蛋白为疫苗靶抗原的免疫策略对于降低疫苗诱导ADE抗体的风险可能具有参考意义。然而,可溶性蛋白的免疫原性大多较低,联合安全有效的免疫佐剂对于诱导足够水平的免疫保护具有重要作用。我们使用二价锰离子为免疫佐剂,二价锰离子能通过激活环鸟苷酸-尿苷酸合成酶(cyclic GMP-AMP synthase,cGAS)-干扰素刺激器(stimulator of interferon,STING)通路激活细胞天然免疫,显著增强抗原诱导的免疫反应[21-22]。锰佐剂具有制作工艺简单、成本低廉、安全性好等优势,具有开发为人用佐剂的可能。
本研究用DNA和重组亚单位2种完全不同的疫苗形式对小鼠进行免疫,虽然无法直接比较RBD和S1作为疫苗靶抗原诱导免疫保护的效力优劣,但结果提示DNA疫苗用于SARS-CoV-2的免疫预防存在较大困难。本研究结果还提示,如果确认SARS-CoV-2或S蛋白可诱导ADE抗体,基于重组S1蛋白(或RBD)的亚单位疫苗可能是一种安全有效的疫苗。
| [1] |
ZHOU P, YANG X L, WANG X G, HU B, ZHANG L, ZHANG W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020, 579: 270-273. DOI:10.1038/s41586-020-2012-7 |
| [2] |
ZHU N, ZHANG D, WANG W, LI X, YANG B, SONG J, et al. A novel coronavirus from patients with pneumonia in China, 2019[J]. N Engl J Med, 2020, 382: 727-733. DOI:10.1056/NEJMoa2001017 |
| [3] |
WU F, ZHAO S, YU B, CHEN Y M, WANG W, SONG Z G, et al. A new coronavirus associated with human respiratory disease in China[J]. Nature, 2020, 579: 265-269. DOI:10.1038/s41586-020-2008-3 |
| [4] |
LI F. Structure, function, and evolution of coronavirus spike proteins[J]. Annu Rev Virol, 2016, 3: 237-261. DOI:10.1146/annurev-virology-110615-042301 |
| [5] |
WANG N, SHANG J, JIANG S, DU L. Subunit vaccines against emerging pathogenic human coronaviruses[J/OL]. Front Microbiol, 2020, 11: 298. doi: 10.3389/fmicb.2020.00298.
|
| [6] |
HE Y. Immunogenicity of SARS-CoV:the receptor-binding domain of S protein is a major target of neutralizing antibodies[J]. Adv Exp Med Biol, 2006, 581: 539-542. |
| [7] |
WANG S F, TSENG S P, YEN C H, YANG J Y, TSAO C H, SHEN C W, et al. Antibody-dependent SARS coronavirus infection is mediated by antibodies against spike proteins[J]. Biochem Biophys Res Commun, 2014, 451: 208-214. DOI:10.1016/j.bbrc.2014.07.090 |
| [8] |
YIP M S, LEUNG N H, CHEUNG C Y, LI P H, LEE H H, DAËRON M, et al. Antibody-dependent infection of human macrophages by severe acute respiratory syndrome coronavirus[J/OL]. Virol J, 2014, 11: 82. doi: 10.1186/1743-422X-11-82.
|
| [9] |
JAUME M, YIP M S, CHEUNG C Y, LEUNG H L, LI P H, KIEN F, et al. Anti-severe acute respiratory syndrome coronavirus spike antibodies trigger infection of human immune cells via a pH- and cysteine protease-independent FcγR pathway[J]. J Virol, 2011, 85: 10582-10597. DOI:10.1128/JVI.00671-11 |
| [10] |
CZUB M, WEINGARTL H, CZUB S, HE R, CAO J. Evaluation of modified vaccinia virus Ankara based recombinant SARS vaccine in ferrets[J]. Vaccine, 2005, 23(17/18): 2273-2279. |
| [11] |
SMATTI M K, AL THANI A A, YASSINE H M. Viral-induced enhanced disease illness[J/OL]. Front Microbiol, 2018, 9: 2991. doi: 10.3389/fmicb.2018.02991.
|
| [12] |
TAYLOR A, FOO S S, BRUZZONE R, DINH L V, KING N J, MAHALINGAM S. Fc receptors in antibody-dependent enhancement of viral infections[J]. Immunol Rev, 2015, 268: 340-364. DOI:10.1111/imr.12367 |
| [13] |
FU Y, CHENG Y, WU Y. Understanding SARS-CoV-2-mediated inflammatory responses: from mechanisms to potential therapeutic tools[J/OL]. Virol Sin, 2020. doi: 10.1007/s12250-020-00207-4.
|
| [14] |
JIANG S, BOTTAZZI M E, DU L, LUSTIGMAN S, TSENG C T, CURTI E, et al. Roadmap to developing a recombinant coronavirus S protein receptor-binding domain vaccine for severe acute respiratory syndrome[J]. Expert Rev Vaccines, 2012, 11: 1405-1413. DOI:10.1586/erv.12.126 |
| [15] |
GAO Q, BAO L, MAO H, WANG L, XU K, YANG M, et al. Rapid development of an inactivated vaccine for SARS-CoV-2[J/OL]. Science, 2020. doi: 10.1126/science.abc1932.
|
| [16] |
ZHAO J, YUAN Q, WANG H, LIU W, LIAO X, SU Y, et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019[J/OL]. Clin Infect Dis, 2020. doi: 10.1093/cid/ciaa344.
|
| [17] |
ZHOU F, YU T, DU R, FAN G, LIU Y, LIU Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China:a retrospective cohort study[J]. Lancet, 2020, 395: 1054-1062. DOI:10.1016/S0140-6736(20)30566-3 |
| [18] |
LI K, CHEN D, CHEN S, FENG Y, CHANG C, WANG Z, et al. Radiographic findings and other predictors in adults with COVID-19[J/OL]. medRxiv, 2020. doi: 10.1101/2020.03.23.20041673.
|
| [19] |
OKBA N M A, MÜLLER M A, LI W, WANG C, GEURTSVANKESSEL C H, CORMAN V M, et al. Severe acute respiratory syndrome coronavirus 2-specific antibody responses in coronavirus disease 2019 patients[J/OL]. Emerg Infect Dis, 2020. doi: 10.3201/eid2607.200841.
|
| [20] |
LIU L, WEI Q, LIN Q, FANG J, WANG H, KWOK H, et al. Anti-spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection[J/OL]. JCI Insight, 2019, 4: e123158. doi: 10.1172/jci.insight.123158.
|
| [21] |
WANG C, ZHANG R, WEI X, LV M, JIANG Z. Metalloimmunology:the metal ion-controlled immunity[J]. Adv Immunol, 2020, 145: 187-241. DOI:10.1016/bs.ai.2019.11.007 |
| [22] |
WANG C, GUAN Y, LV M, ZHANG R, GUO Z, WEI X, et al. Manganese increases the sensitivity of the cGAS-STING pathway for double-stranded DNA and is required for the host defense against DNA viruses[J/OL]. Immunity, 2018, 48: 675-687.e7. doi: 10.1016/j.immuni.2018.03.017.
|
 2020, Vol. 41
2020, Vol. 41


