MiRNA是一类长18~22 nt的单链小分子RNA。在细胞中,miRNA可参与RNA诱导的沉默复合体(RNA-induced silencing complex,RISC)形成,并通过RISC靶向mRNA的3’端非编码区,引起该mRNA的降解或翻译过程抑制,从而在转录后水平调控蛋白质表达[1]。
MiRNA海绵技术是目前进行miRNA功能缺失性研究的主要生物学方法[2]。该技术通过在细胞内持续表达miRNA海绵,特异结合特定miRNA,进而竞争性抑制miRNA对靶基因的作用[3],实现较长时程的miRNA功能抑制。然而,由于质粒转染效率较低,以质粒介导的miRNA海绵技术不适合心肌细胞、内皮细胞、间充质细胞等原代细胞。腺病毒具有较高的转染效率和相对较低的毒性,因此腺病毒介导的miRNA海绵技术具有较广阔的应用前景,然而目前相关研究较少,并且存在诸多技术局限性,如既往构建miRNA海绵腺病毒时,主要是将miRNA海绵插入GFP 3’端非编码区,但GFP较难定量,因而较难检测miRNA海绵的抑制效率;同时,在目的miRNA表达较高的细胞中,由于miRNA对GFP表达的抑制,难以通过GFP确定细胞转染效率[3]。
本研究将miRNA海绵片段插入到荧光素酶的3’端非编码区,并将其克隆至拥有双启动子的Ad-Track质粒(其中一个启动子驱动GFP表达,另一个启动子驱动荧光素酶-miRNA海绵表达),通过Ad-Track质粒和Ad-Easy质粒的同源重组进一步构建荧光素酶-miRNA海绵腺病毒,实现了对miRNA海绵的抑制效率和细胞转染效率的双重监控,从而为miRNA或靶基因的生物学功能和治疗学研究提供重要思路。
1 材料和方法 1.1 试剂人胚肾细胞系293、293T和人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)购自中国科学院上海生命科学院细胞资源中心;Taq酶,pMD-18T质粒,psiCheck2质粒,NheⅠ、XhoⅠ、NotⅠ等限制性内切酶,DNA连接酶,感受态细菌制备试剂盒等购自日本TaKaRa公司;双荧光素酶检测试剂盒购自美国Promega公司;胰酶、高糖DMEM培养液、青-链霉素双抗溶液购自美国Gibco公司;脂质体2000及Top10菌株购自美国Invitrogen公司;miRNA-126过表达质粒及对照质粒购自上海吉玛制药技术有限公司;腺病毒包装系统(Ad-Easy质粒、Ad-Track质粒)均由本实验室保存。
1.2 载体构建通过常规分子生物学克隆技术进行质粒载体构建[4]。
1.3 293细胞培养及转染293细胞培养于含10% FBS和100 U/mL青-链霉素的高糖DMEM培养液中。按照1×105/mL细胞密度,取5 mL接种于直径为6 cm的细胞培养皿中,待细胞融合度接近80%时用脂质体2000转染Ad-Easy质粒,24 h后将细胞培养液换成含5% FBS和100 U/mL青-链霉素的高糖DMEM培养液。
1.4 双荧光素酶法验证miRNA过表达对荧光素酶-miRNA海绵的作用常规培养293T细胞,按照1×105/mL细胞密度将细胞接种于24孔细胞培养板,每孔接种0.5 mL。待细胞融合度接近80%时将miRNA-126过表达质粒或对照质粒与荧光素酶-miRNA海绵报告基因载体共同转染293T细胞。转染方法如下:将miRNA-126过表达质粒或对照质粒按照每孔500 ng、miRNA海绵报告基因载体按照每孔50 ng加到50 μL高糖DMEM培养液中,同时在另一50 μL高糖DMEM培养液体系中加入2 μL脂质体2000,静置5 min;二者充分混匀,室温放置20 min。将miRNA-126过表达质粒及对照质粒的混合液分别加入24孔细胞培养板各实验孔中,轻微震荡混匀后在37 ℃细胞培养箱中培养24 h。使用双荧光素酶检测试剂盒中的被动裂解缓冲液裂解细胞后,取10 μL细胞裂解液至离心管,加入40 μL荧光素酶检测试剂产生萤火虫荧光信号,再向同一样品中加入40 μL海肾荧光素酶检测试剂,并充分混匀,从而将上述反应猝灭并启动海肾荧光素酶反应,进而测量海肾荧光素强度。最后以海肾荧光强度/萤火虫荧光强度比值进行标准化校正,确定miRNA-126对荧光素酶-miRNA海绵报告基因的作用。
1.5 BJ5183感受态细菌的制备采用感受态细菌制备试剂盒进行制备,具体方法如下:将高效重组大肠杆菌菌株BJ5183单菌落接种到20 mL LB培养液中,37 ℃振荡培养6 h,按照每管1 mL分装到1.5 mL离心管中,1 500×g 4 ℃离心5 min,弃上清。向每个离心管中加入100 µL预冷的试剂A,轻弹使菌体重悬,再次1 500×g 4 ℃离心5 min,弃上清。向每个离心管中加入100 µL预冷的试剂B,重悬菌体,保存于-80 ℃备用。
1.6 细胞划痕实验观察miRNA-126对细胞迁移能力的影响将HUVEC铺于6孔板,待细胞融合度达60%~70%时分别用本课题构建的Ad-GFP腺病毒及Ad-miRNA126-sponge腺病毒感染,感染24 h后使用200 mL移液枪头于正中划线,PBS清洗后于10%高糖DMEM培养液中培养,分别于0、12 h时用倒置显微镜观察拍照。
1.7 统计学处理采用SigmaPlot软件进行统计学分析。实验结果用x±s表示,组内比较采用t检验。检验水准(α)为0.05。
2 结果 2.1 合成miRNA-126海绵位点并进行PCR扩增首先通过文献寻找已被证实的miRNA-126靶基因,其中解整合素金属蛋白酶9(a disintegrin and metalloprotease 9,ADAM9)、1型芽生性相关酪氨酸激酶结构域(sprouty-related EVH1 domain-containing protein 1,SPRED1)和蛋白酪氨酸性磷酸酶非受体9型(protein tyrosine phosphatase non-receptor type 9,PTPN9)在细胞中能够被miRNA-126抑制,通过改变这3种靶基因中部分不与miRNA-126配对的碱基,使其能够与miRNA-126配对,以增加这些序列与miRNA-126的结合效率。以此为基础设计并合成2段部分cDNA序列(图 1A),PCR扩增产物能够将本实验设计的3个miRNA-126海绵序列进行串联,图 1B所示产物中的3段序列均与miRNA-126有较好的碱基互补配对关系,并有可能高效地结合miRNA-126。PCR扩增产物经琼脂糖凝胶电泳分析可见长度为92 bp的单一条带(图 1C)。

|
图 1 设计并合成miRNA-126海绵序列 Fig 1 Design and synthesis of miRNA-126 sponge fragment A: Two partial cDNA sequences; B: PCR products containing three repeated miRNA-126 sponge sequences; C: Agarose gel electrophoresis showed that the PCR product was a single band. miRNA: MicroRNA; M: Marker; Con: Control; 1-4: PCR products of miRNA-126 sponge; PCR: Polymerase chain reaction |
2.2 荧光素酶-miRNA海绵报告基因质粒的构建与验证 2.2.1 质粒的构建
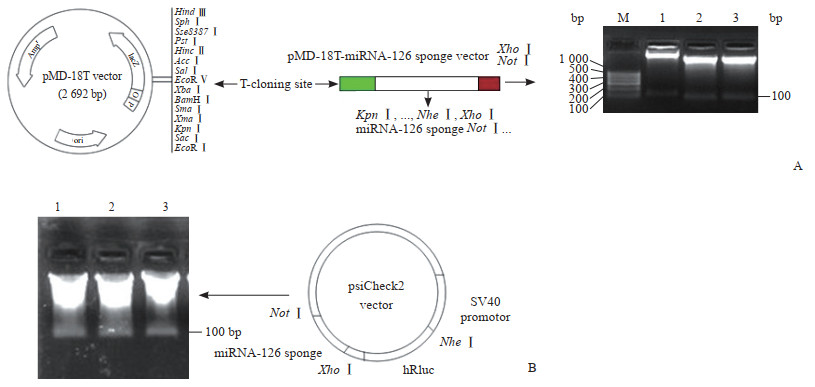
将上述设计并行PCR扩增的miRNA-126海绵序列通过TA克隆方法克隆到pMD-18T质粒中。通过对重组的pMD-18T质粒进行XhoⅠ和NotⅠ双酶切鉴定,可见长度约100 bp的DNA片段,表明pMD-18T-miRNA-126 sponge质粒构建成功(图 2A)。然后将pMD-18T-miRNA-126 sponge质粒经XhoⅠ和NotⅠ双酶切得到的miRNA-126海绵DNA片段,连接到psiCheck2质粒hRluc的3’端非编码区。重组后的psiCheck2-miRNA-126 sponge质粒经XhoⅠ和NotⅠ双酶切,仍然可看到长度约100 bp的DNA片段(图 2B)。
|
图 2 荧光素酶-miRNA-126海绵报告基因质粒的构建与验证 Fig 2 Construction and verification of luciferase-miRNA-126 sponge reporter plasmid A: Construction and verification of pMD-18T-miRNA-126 sponge plasmid; B: Construction and verification of psiCheck2-miRNA-126 sponge plasmid. 1 in Fig 2A: psiCheck2; 2, 3 in Fig 2A: pMD-18T; 1-3 in Fig 2B: psiCheck2-miRNA-126 sponge with XhoⅠand NotⅠ digestion. miRNA: MicroRNA; M: Marker |
2.2.2 荧光素酶报告基因法确定miRNA-126过表达对psiCheck2-miRNA-126 sponge重组蛋白的翻译抑制效率
对海肾荧光素酶与萤火虫荧光素酶对产物催化产生的荧光信号的比值进行分析,结果显示对照组的荧光素酶表达量(1.007±0.021)高于psiCheck2-miRNA-126 sponge组的表达量(0.285± 0.006,P<0.01)。表明过表达miRNA-126能够抑制miRNA-126海绵重组荧光素酶的表达,hRluc-miRNA-126海绵序列能与miRNA-126互补配对、相互结合。
2.3 荧光素酶-miRNA海绵报告基因腺病毒的构建采用Ad-Easy腺病毒载体构建系统。目的DNA片段首先被克隆到穿梭质粒载体Ad-Track,重组的Ad-Track质粒经PmeⅠ线性化后转化BJ5183感受态细菌,与Ad-Easy病毒骨架质粒同源重组,最后Ad-Track与Ad-Easy重组成功的质粒经PacⅠ酶切后转染293细胞,进行腺病毒的包装与扩增。
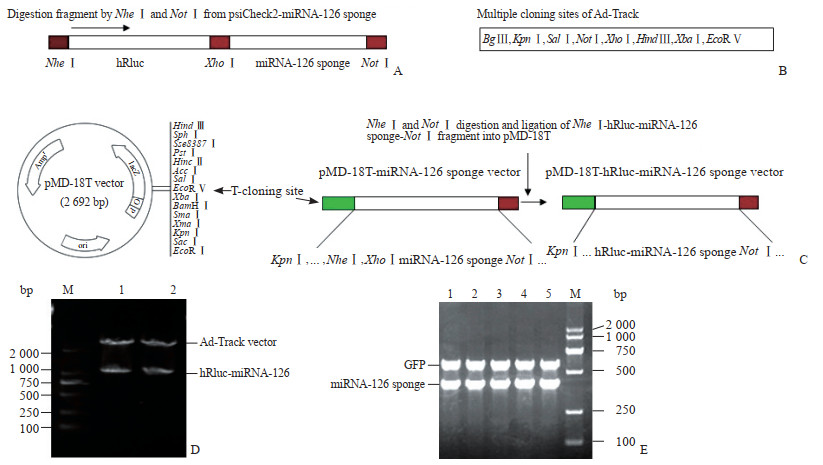
2.3.1 构建与验证腺病毒穿梭载体质粒psiCheck2-miRNA-126 sponge经NheⅠ和NotⅠ双酶切后,可获得hRluc-miRNA-126海绵片段(图 3A)。由于腺病毒穿梭质粒Ad-Track的多克隆位点上不存在NheⅠ酶切位点(图 3B),hRluc-miRNA-126海绵片段不能直接连入Ad-Track载体。为了解决这一问题,首先将hRluc-miRNA-126海绵片段连入pMD-18T质粒,然后再通过KpnⅠ和NotⅠ双酶切,将hRluc-miRNA-126海绵片段克隆至Ad-Track质粒(图 3C)。Ad-Track重组质粒经KpnⅠ和NotⅠ双酶切鉴定和PCR鉴定,结果均表明Ad-Track-hRluc-miRNA-126海绵重组质粒构建成功(图 3D、3E)。为了确定Ad-Track-hRluc-miRNA-126 sponge质粒能够表达与miRNA-126结合的重组蛋白,通过荧光素酶报告基因法对二者的结合效率进行验证,结果显示对照组的荧光素酶强度(1.015±0.026)高于转染Ad-Track-hRluc-miRNA-126 sponge组(0.254± 0.009,P<0.01),说明过表达miRNA-126能够抑制Ad-Track-hRluc-miRNA-126 sponge质粒表达海肾荧光素酶的蛋白量。
|
图 3 荧光素酶-miRNA-126海绵报告基因腺病毒穿梭载体的构建与验证 Fig 3 Construction and verification of adenovirus shuttle vector with luciferase-miRNA-126 sponge reporter gene A: hRluc-miRNA-126 sponge fragments were obtained after double digestion of NheⅠ and NotⅠ; B: The multiple cloning sites of Ad-Track; C-E: Construction and verification of Ad-Track-hRluc-miRNA-126 sponge plasmid. 1-2 in Fig 3D: Ad-Track-hRluc-miRNA-126 sponge with Xho Ⅰand Not Ⅰ digestion; 1-5 in Fig 3E: PCR products of Ad-Track-hRluc-miRNA-126 sponge. miRNA: MicroRNA; Ad: Adenovirus; GFP: Green fluorescence protein; PCR: Polymerase chain reaction; M: Marker |
2.3.2 穿梭载体与骨架载体同源重组
由于在Ad-Track质粒和Ad-Easy质粒中存在反向末端重复区域,能够在重组酶存在的情况下发生同源重组,从而将目的片段接入腺病毒骨架载体。首先通过PmeⅠ酶切使Ad-Track-hRluc-miRNA-126 sponge质粒线性化,取部分酶切产物行1%琼脂糖凝胶电泳,结果(图 4A)显示PmeⅠ酶切后的质粒电泳速度较慢,表明线性化成功。Ad-Track-hRluc-miRNA-126 sponge质粒的PmeⅠ酶切产物经纯化后,取500 ng转化BJ5183感受态细菌。将Ad-Track-hRluc-miRNA-126 sponge质粒转化的BJ5183菌株培养在卡那霉素抗性的LB琼脂平板后,可见菌落呈大、中、小3种状态。挑选6个最小单克隆菌落,摇菌16 h,行质粒抽提,取1/2用于0.7%琼脂糖凝胶电泳,结果(图 4B)显示Ad-Track-hRluc-miRNA-126 sponge质粒与Ad-Easy质粒重组成功,大小正确。进一步将Ad-Easy-hRluc-miRNA-126 sponge质粒转化到Top10菌株中进行质粒扩增,扩增质粒经PacⅠ酶切鉴定,可见4.5 kb的DNA片段(图 4C),表明Ad-Easy-hRluc-miRNA-126 sponge质粒建立成功。

|
图 4 荧光素酶-miRNA-126海绵报告基因穿梭载体与腺病毒骨架载体的同源重组 Fig 4 Homologous recombination of luciferase-miRNA-126 sponge reporter gene shuttle vector with adenovirus skeleton vector A: Verification of Ad-Track-hRluc-miRNA-126 sponge plasmid; B: Verification of homologous recombination; C: Verification of Ad-Easy-hRluc-miRNA-126 sponge plasmid. 1-4 in Fig 4A: Ad-Track-hRluc-miRNA-126 sponge; 5, 6 in Fig 4A: Ad-Track-hRluc-miRNA-126 sponge with Pme Ⅰ digestion; 1-6 in Fig 4B: Ad-Easy-hRluc-miRNA-126 sponge; 1-6 in Fig 4C: Ad-Easy-hRluc-miRNA-126 sponge with PacⅠdigestion. miRNA: MicroRNA; Ad: Adenovirus; M: Marker |
2.3.3 腺病毒载体在293细胞内包装与扩增腺病毒
将Ad-Easy-hRluc-miRNA-126 sponge重组质粒转染293细胞7 d后,可见部分细胞开始出现形状变圆且离壁;将细胞刮下,移至离心管中反复冻融3次,12 000×g离心10 min,弃去细胞碎片得到第1代腺病毒上清,将其保存于-80 ℃。继续培养293细胞,待其长满直径为10 cm培养皿底的90%,加入0.2~0.5 mL病毒裂解液,2~3 d后可见所有293细胞形状变圆且离壁,收集所有细胞并冻融和离心,得到第2代腺病毒上清。继续重复转染,得到第3代腺病毒上清。
2.3.4 腺病毒载体的验证及miRNA-126在HUVEC细胞中的功能结果显示转染对照质粒的荧光素酶强度(1.025±0.057)高于转染腺病毒组的强度(0.281±0.030,P<0.01),说明miRNA-126过表达能够抑制hRluc-miRNA-126海绵重组蛋白的表达,表明成功构建了荧光素酶-miRNA海绵腺病毒体系。
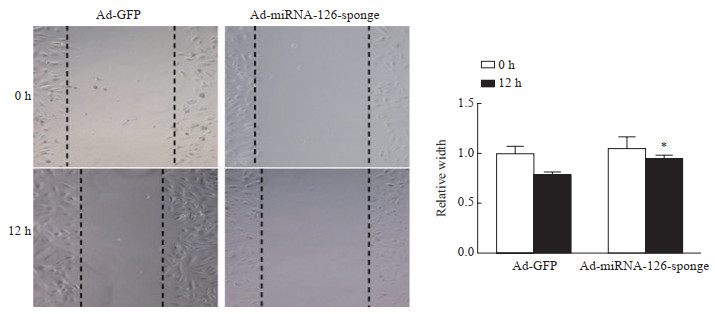
通过细胞划痕实验观察miRNA-126对HUVEC迁移能力的影响,结果如图 5所示,通过感染Ad-miRNA-126-sponge腺病毒可以抑制HUVEC的迁移能力(P<0.05)。
|
图 5 细胞划痕实验观察荧光素酶-miRNA-126海绵报告基因腺病毒载体对HUVEC迁移能力的影响 Fig 5 Effect of adenovirus vector with luciferase-miRNA-126 sponge reporter gene on migration ability of HUVECs detected by cell scratch assay miRNA: MicroRNA; HUVEC: Human umbilical vein endothelial cell; Ad: Adenovirus; GFP: Green fluorescence protein. *P < 0.05 vs Ad-GFP group at same time point. n=3, x±s |
3 讨论
与传统的miRNA功能干预手段如人工合成的寡核苷酸相比,本研究所构建的荧光素酶-miRNA海绵腺病毒系统具有很大的优势。传统的寡核苷酸技术需要2-O-甲基、锁核苷酸等修饰及脂质体的转染才能在细胞中稳定表达miRNA结合物[2],同时许多细胞(如原代内皮细胞)无法耐受脂质体转染[5],而本研究采用的腺病毒技术不需要经过脂质体转染就能直接在细胞中表达miRNA结合物,对细胞损伤较少且在原代内皮细胞、心肌细胞等多种细胞上的干预具有优势。腺病毒已经在大动物的应用方面有了较深入的研究[6],本研究的荧光素酶-miRNA海绵腺病毒技术可以实现大动物器官靶向miRNA表达干预。
本研究采用的荧光素酶-miRNA海绵技术与传统的GFP-miRNA海绵技术相比也具有独特优势。本研究所构建的腺病毒载体除了能够表达荧光素酶-miRNA海绵外,还能够同时独立表达GFP。传统的GFP-miRNA海绵技术虽然也能表达GFP[7],然而该GFP的3’端非编码区存在miRNA结合序列,在细胞内GFP的表达受到目的miRNA的直接调控,因此在监控腺病毒转染效率方面存在缺陷。本研究构建的腺病毒载体GFP的表达不受细胞内miRNA的直接调控,可以通过直接观察GFP监控腺病毒的转染效率。本研究中,为了确定miRNA-126海绵载体能够表达与miRNA-126结合的重组蛋白,通过双荧光素酶报告基因法对二者的结合效率进行了验证。MiRNA-126过表达质粒与构建的miRNA-126海绵载体共同转染293T细胞后,如果miRNA-126与hRluc-miRNA-126海绵结合,那么海肾荧光素酶的表达将受到抑制。通过这种方式成功对本次研究中的miRNA-126海绵载体进行了验证,并证实这些载体的成功构建。
在组装腺病毒时,由于Ad-Easy缺失腺病毒基因E1和E3,Ad-Easy-hRluc-miRNA-126 sponge重组质粒在大部分细胞中不能组装形成腺病毒。E1基因能够表达腺病毒粒子蛋白,是腺病毒包装所必需的基因。在293细胞中E1基因的缺失能够被代偿,因而Ad-Easy-hRluc-miRNA-126 sponge重组质粒能够在293细胞包装并扩增腺病毒。
本课题旨在探讨荧光素酶-miRNA海绵腺病毒技术的建立方法,在已报道的1 000余种miRNA中选择miRNA-126作为实验对象,主要由于其在生命活动中具有重要的功能,可调控血管新生[8]、血管内皮细胞黏附[9],并与动脉粥样硬化发生[10]密切相关。MiRNA-126也是内皮细胞特异表达的miRNA,在内皮细胞中有较高的表达水平[11],由于内皮细胞是较难转染的细胞类型,故更能体现荧光素酶-miRNA海绵腺病毒技术的优点。本研究用构建成功的荧光素酶-miRNA-126海绵腺病毒感染HUVEC,细胞划痕实验结果显示实验组细胞的迁移能力低于对照组,说明miRNA-126海绵对HUVEC的迁移能力有抑制作用,也印证了海绵技术在细胞中成功表达。
| [1] |
GRUETER C E, VAN ROOIJ E, JOHNSON B A, DELEON S M, SUTHERLAND L B, QI X, et al. A cardiac microRNA governs systemic energy homeostasis by regulation of MED13[J]. Cell, 2012, 149: 671-683. DOI:10.1016/j.cell.2012.03.029 |
| [2] |
EBERT M S, NEILSON J R, SHARP P A. MicroRNA sponges:competitive inhibitors of small RNAs in mammalian cells[J]. Nat Methods, 2007, 4: 721-726. DOI:10.1038/nmeth1079 |
| [3] |
LI Q, SONG X W, ZOU J, WANG G K, KREMNEVA E, LI X Q, et al. Attenuation of microRNA-1 derepresses the cytoskeleton regulatory protein twinfilin-1 to provoke cardiac hypertrophy[J]. J Cell Sci, 2010, 123(Pt 14): 2444-2452. |
| [4] |
TAN R, LI C, JIANG S, MA L. A novel and simple method for construction of recombinant adenoviruses[J/OL]. Nucleic Acids Res, 2006, 34: e89. doi: 10.1093/nar/gkl449. 10.1093/nar/gkl449
|
| [5] |
KRÜTZFELDT J, RAJEWSKY N, BRAICH R, RAJEEV K G, TUSCHL T, MANOHARAN M, et al. Silencing of microRNAs in vivo with 'antagomirs'[J]. Nature, 2005, 438: 685-689. DOI:10.1038/nature04303 |
| [6] |
FANG B, ROTH J A. The role of gene therapy in combined modality treatment strategies for cancer[J]. Curr Opin Mol Ther, 2003, 5: 475-482. |
| [7] |
WANG X W, HE X J, LEE K C, HUANG C, HU J B, ZHOU R, et al. MicroRNA-221 sponge therapy attenuates neointimal hyperplasia and improves blood flows in vein grafts[J]. Int J Cardiol, 2016, 208: 79-86. DOI:10.1016/j.ijcard.2016.01.006 |
| [8] |
JIANG B, TANG Y, WANG H, CHEN C, YU W, SUN H, et al. Down-regulation of long non-coding RNA HOTAIR promotes angiogenesis via regulating miR-126/SCEL pathways in burn wound healing[J/OL]. Cell Death Dis, 2020, 11: 61. doi: 10.1038/s41419-020-2247-0. 10.1038/s41419-020-2247-0
|
| [9] |
SCHOBER A, NAZARI-JAHANTIGH M, WEI Y, BIDZHEKOV K, GREMSE F, GROMMES J, et al. MicroRNA-126-5p promotes endothelial proliferation and limits atherosclerosis by suppressing Dlk1[J]. Nat Med, 2014, 20: 368-376. DOI:10.1038/nm.3487 |
| [10] |
LI Y, TIAN L, SUN D, YIN D. Curcumin ameliorates atherosclerosis through upregulation of miR-126[J]. J Cell Physiol, 2019, 234: 21049-21059. DOI:10.1002/jcp.28708 |
| [11] |
PEI C Z, LIU B, LI Y T, FANG L, ZHANG Y, LI Y G, et al. MicroRNA-126 protects against vascular injury by promoting homing and maintaining stemness of late outgrowth endothelial progenitor cells[J/OL]. Stem Cell Res Ther, 2020, 11: 28. doi: 10.1186/s13287-020-1554-9. 10.1186/s13287-020-1554-9
|
 2020, Vol. 41
2020, Vol. 41


