2. 上海中医药大学附属龙华医院肿瘤科, 上海 200032
2. Department of Oncology, Longhua Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China
国际癌症研究机构编制的研究报告显示,2018年全球有1 800万新增癌症病例及960万癌症死亡病例,在这些病例中,我国新增病例数为380.4万例,死亡病例数为229.6万例[1]。伴随着快速工业化、城市化、人口老龄化发展及居民不健康生活方式(大量吸烟、不良饮食等)的影响,中国某些癌症的发病率和死亡率一直以惊人的速度增长[2]。
近年在肿瘤学领域提出了一个新概念:癌症拦截(cancer interception),即在早期阶段防止癌症发生的积极干预方式。其手段就是利用已知化学预防/血管预防性药物在细胞恶性转化、侵袭和播散之前“拦截”肿瘤的发生[3]。目前最常用的预防药物包括二甲双胍、阿司匹林和中成药等,在动物模型和人体试验中均已取得显著效果[4-6]。阿伐麦布(avasimibe)是一种选择性酰基辅酶A:胆固醇酰基转移酶(acyl-coenzyme A:cholesterol acyltransferase,ACAT)抑制剂(对ACAT1和ACAT2同时有抑制作用),早期研究显示其可降低血浆脂质、直接对抗动脉粥样硬化,用于高脂血症和动脉粥样硬化的治疗[7]。近期研究表明阿伐麦布还可诱导细胞凋亡、抑制肿瘤生长及延长荷瘤鼠生存时间[8],其潜在靶点为醛固酮类还原酶家族1成员C1(aldo-keto reductase family 1 member C1,AKR1C1)[9]。但阿伐麦布在胆管癌发生中的作用研究少见。本研究利用化学致癌物预处理SD大鼠,诱导其发生胆管上皮畸变,再利用阿伐麦布干预该模型,探讨其是否能够抑制大鼠肝内胆管癌发生。
1 材料和方法 1.1 动物与试剂10只SD雄性大鼠(6月龄)购于上海斯莱克实验动物有限责任公司[动物生产许可证号:SCXK(沪)2012-0002,使用许可证号:SYXK(沪)2012-0002],饲养于同济大学附属东方医院实验动物中心。硫代乙酰胺(thioacetamide,TAA;CAS号:27366-72-9)购于常州航宇医药技术开发有限公司,阿伐麦布购于美国Selleck生物科技有限公司(CAS号:S2197)和上海超岚化工科技中心(CAS号:166518-60-1),鼠抗人AKR1C1单克隆抗体购于以色列ProSpec-Tany TechnoGene Ltd.公司,兔抗人Ki-67单克隆抗体(货号:RMA-0542)和SP法免疫组织化学染色试剂盒(货号:KIT-9720)购于福州迈新生物技术开发有限公司。胆管癌细胞QBC939为本实验室保存。
1.2 阿伐麦布干预大鼠肝内胆管癌实验先用含TAA(300 mg/L)的饮用水饲养SD大鼠3个月(12周),之后停用TAA。随后将大鼠随机分为两组(每组5只):对照组和阿伐麦布干预组。对照组以常规饮用水饲养,阿伐麦布干预组用含阿伐麦布(30 mg/kg)的饮用水灌胃饲养。饲养3个月后处死所有SD大鼠。显微镜(BX53型,日本Olympus公司)下观察大鼠心、肺、脾脏和肠道组织。肉眼观察大鼠肝脏表面情况;将肝脏每隔5 mm切开,观察切面状况;间隔选取肝脏组织,用甲醛溶液固定,脱水后用石蜡包埋,连续切片,行H-E染色。光学显微镜下观察肝脏病变情况。另取肝脏切片用于免疫组织化学染色。
1.3 大鼠肝功能检测实验结束时予以戊巴比妥钠(40 mg/kg)麻醉大鼠,然后通过大鼠腹主动脉利用负压采血管收集血液并置于EDTA抗凝管中,室温条件下222×g离心5 min收集血清。血清送至检验科,用全自动生化分析仪检测大鼠血清天冬氨酸转氨酶(aspartate aminotransferase,AST)和丙氨酸转氨酶(alanine aminotransferase,ALT)水平。
1.4 免疫组织化学染色取两组大鼠肝脏切片,根据SP法免疫组织化学染色试剂盒说明书检测大鼠肝脏病变组织中AKR1C1(1︰200)和Ki-67(即用型)的表达情况,PBS替代一抗作为阴性对照。AKR1C1的阳性表达呈黄色或棕黄色,定位于细胞质和核膜。阳性表达评分采用二级积分法[9]:阳性细胞染色强度分为阴性(0分)、弱阳性(1分)、中度阳性(2分)、强阳性(3分),阳性细胞百分比为0~100%,根据阳性细胞染色强度和阳性细胞比例的乘积,计分0~300分。Ki-67的阳性表达呈褐色,定位于细胞核。阳性表达评分采用细胞比值法[10],即选取5个高倍镜视野计数阳性细胞所占比例,≥5%被认为是阳性。
1.5 CCK-8细胞增殖实验QBC939细胞经胰酶消化、重悬、计数、稀释后以500/mL的密度接种于96孔板,每孔加入100 μL细胞悬液,待细胞贴壁后分别加入不同浓度(0、10、20 μmol/L)的阿伐麦布,置于37 ℃、5% CO2孵箱中培养,培养12、48和72 h时每孔加入10 μL CCK-8试剂(日本株式会社同仁化学研究所),孵育4 h,震荡混匀,用酶标仪检测450 nm波长处的光密度(D)值。以12 h测定值为基准计算48、72 h的细胞活力。
1.6 qRT-PCR检测用不同浓度(0、10、20 μmol/L)的阿伐麦布处理QBC939细胞,48 h后向细胞中加入适量TRIzol试剂(美国Invitrogen公司)。根据说明书提取细胞中总RNA。用NanoDrop紫外分光光度计测定RNA浓度,用反转录试剂盒(美国Promega公司)将RNA反转录为cDNA,采用SYBR Green PCR试剂盒(日本TaKaRa公司)对AKR1C1和内参基因β-actin进行PCR反应。引物序列:AKR1C1上游引物5’-AGA CAT ATT CTA CAC TTC AA-3’,下游引物5’-GAG GTC AAC ATA ATC CAA-3’;β-actin上游引物5’-CAT GTA CGT TGC TAT CCA GGC-3’,下游引物5’-CTC CTT AAT GTC ACG CAG AT-3’。PCR反应条件:95 ℃ 15 min;95 ℃ 15 s、58 ℃ 15 s、72 ℃ 60 s,共35个循环;72 ℃ 10 min。采用2-ΔΔCt法计算目标基因的相对表达量。实验重复3次,取平均值。
1.7 蛋白质印迹分析将QBC939细胞以1×106/mL的密度接种于6孔板,分别加入不同浓度(0、10、20 μmol/L)的阿伐麦布,置于37 ℃、5% CO2孵箱中培养。培养48 h后用RIPA裂解液裂解并收集蛋白,测定蛋白浓度,变性后行SDS-PAGE,然后转至PVDF膜。封闭液封闭,加入一抗(1︰1 000)孵育过夜,加入二抗(1︰2 000)室温孵育1 h,TBS洗涤3次,X线片曝光显色。
1.8 统计学处理应用SPSS 11.0软件进行统计学分析,用GraphPad Prism 5.0软件绘图。数据以x±s表示,组间比较采用独立样本t检验。检验水准(α)为0.05。
2 结果 2.1 药物安全性在6个月的饲养过程中,未见药物相关的大鼠死亡,大鼠的日常生活状态正常,未见烦躁、活动减少、激动等异常表现,对照组大鼠的体质量为(495.8±19.9)g,阿伐麦布干预组大鼠的体质量为(475.7±19.7)g,两组大鼠的体质量差异无统计学意义(P>0.05)。收集阿伐麦布干预组大鼠的心、肺、脾脏和肠道组织,光学显微镜下未见明显病变。第6个月处死大鼠之前收集血清样本,检测血清AST和ALT水平,对照组和阿伐麦布干预组大鼠血清AST[(33.5±3.17)U/L vs(32.9±3.36)U/L]和ALT[(55.0±5.30)U/L vs(53.4±5.56)U/L]水平差异均无统计学意义(P均>0.05)。结果初步显示阿伐麦布的长期使用未产生严重不良反应。
2.2 阿伐麦布大鼠中断胆管癌发生进程H-E染色结果(图 1)显示,中断化学致癌物TAA刺激,在不予以任何干预、任其自行发展情况下,对照组大鼠肝脏切面可见散布的胆管扩张、纤维组织增生,并可见不同程度的疑似肿瘤或肿瘤形成,肿瘤发生率高达100%(5/5);在阿伐麦布干预组,大鼠肝脏切面仍然存在胆管扩张和纤维组织增生,但肿瘤发生率明显下降,5只大鼠中有1只出现肿瘤,肿瘤发生率为20%。
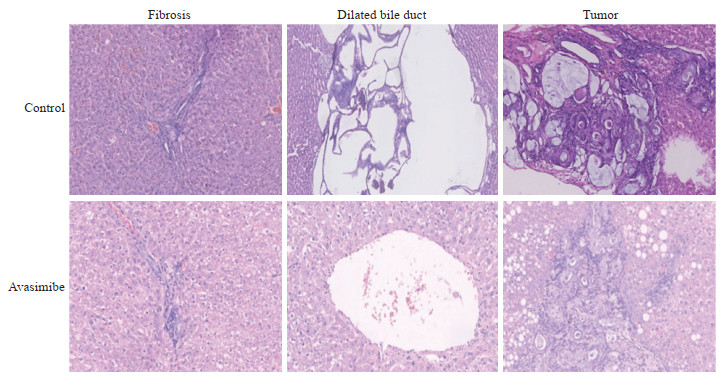
|
图 1 阿伐麦布中断大鼠胆管癌进展的形态学表现 Fig 1 Morphological features of avasimibe interrupting the progression of cholangiocarcinoma in rats The control group had fibrosis, bile duct dilatation and tumor formation, and no obvious abnormalities were observed in most of the liver in the avasimibe intervention group. H-E staining. Original magnification: ×200 |
2.3 阿伐麦布抑制胆管癌细胞增殖
CCK-8细胞增殖实验结果(图 2)显示,10 μmol/L和20 μmol/L阿伐麦布均能够抑制QBC939细胞的增殖。

|
图 2 阿伐麦布抑制胆管癌细胞QBC939增殖 Fig 2 Avasimibe inhibited the proliferation of cholangiocarcinoma cells QBC939 **P < 0.01 vs 0 μmol/L; △△P < 0.01 vs 48 h. n=3, x±s |
2.4 阿伐麦布靶向AKR1C1
qRT-PCR结果(图 3A)显示,经10、20 μmol/L阿伐麦布处理后,QBC939细胞中AKR1C1 mRNA表达水平下降,与0 μmol/L组比较差异均有统计学意义(P均<0.01)。蛋白质印迹分析结果(图 3B)显示,经10、20 μmol/L阿伐麦布处理后,QBC939细胞中AKR1C1蛋白的表达水平下降,其中20 μmol/L组AKR1C1蛋白的表达水平与0 μmol/L组比较差异有统计学意义(P<0.01)。
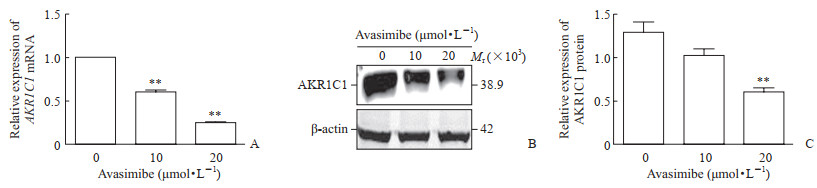
|
图 3 AKR1C1是阿伐麦布的潜在作用靶点 Fig 3 AKR1C1 is a potential target of avasimibe A: qRT-PCR for AKR1C1 mRNA expression in QBC939 cells treated with avasimibe; B, C: Western blotting for AKR1C1 protein expression in QBC939 cells treated with avasimibe. AKR1C1: Aldo-keto reductase family 1 member C1; qRT-PCR: Quantitative real-time polymerase chain reaction. **P < 0.01 vs 0 μmol/L. n=3, x±s |
免疫组织化学染色结果显示,对照组大鼠的肝脏病变组织中AKR1C1呈高表达,而阿伐麦布干预组大鼠的肝脏病变组织中AKR1C1的表达水平下降(P<0.05,图 4A);对照组大鼠肝脏病变组织中Ki-67的表达水平也高于阿伐麦布干预组(P<0.01,图 4B)。
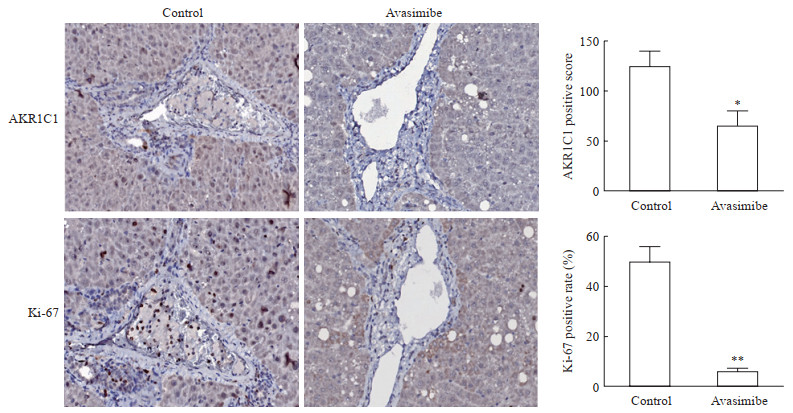
|
图 4 阿伐麦布抑制大鼠肝脏病变组织中AKR1C1和Ki-67的表达 Fig 4 Avasimibe inhibited the expression of AKR1C1 and Ki-67 in rat liver lesions AKR1C1: Aldo-keto reductase family 1 member C1. Immunohistochemical staining. Original magnification: ×200. *P < 0.05, **P < 0.01 vs control. n=5, x±s |
3 讨论
环境污染是我国癌症防治的重点领域之一[2],环境致癌物诱发的肿瘤具有明显特点,如突变谱系以T>C和C>T为主[11],而且突变诱发后会持续积累,难以逆转。模拟环境致癌物诱发的肿瘤模型易于构建,且符合人类社区中致癌物所致肿瘤的特点,本课题组前期即成功构建了TAA诱导的胆管癌模型,经阿司匹林干预后,取得较好的中断效果[10]。本研究拟进一步探索阿伐麦布是否也具有中断胆管癌发生的作用。
TAA早期主要用于诱导建立大鼠肝硬化模型,模型成功率高达80%[12]。通过改变TAA的给药途径、剂量和时间,TAA在诱导肝纤维化的基础上,可继发胆管细胞增殖和畸变,3个月左右出现胆管上皮异型增生,4~5个月左右出现浸润性胆管癌,成瘤率为100%[13]。本课题组成功复制了该模型,但通过观察大鼠肝脏的病理形态学特点,我们发现第3个月是一个关键节点,在这个时间点,肝脏切面还未形成镜下肿瘤,但第4个月所有大鼠均形成了胆管癌[10]。这和现实情况极为类似,如环境致癌物、吸烟所致肺癌和酗酒所致食管癌等,虽然体格检查时未发现肿瘤,但不代表个体健康,即使戒烟和戒酒,体内的突变积累依然有可能导致肿瘤的发生。在即将形成肿瘤之前的时间点予以化学预防,是否能够中断肿瘤的发生呢?这对于无症状高危人群的提早干预、最大程度地预防肿瘤发生具有重要意义。
许多药物已经成功用于预防特定肿瘤的发生,如用阿司匹林预防结直肠癌[14]、二甲双胍预防2型糖尿病诱发的肿瘤[15]、氢+中药预防胆管癌[16]。这些药物的特点是可长期服用、安全有效。阿伐麦布是一种新型ACAT抑制剂,具有降低胆固醇和直接抗动脉粥样硬化作用,能够减少动脉壁中脂质的积累、抑制巨噬细胞浸润到基质、降低基质金属蛋白酶的表达和活性,进而增加斑块稳定性[7, 17]。研究显示阿伐麦布还可用于小鼠黑素瘤的治疗,与抗程序性死亡蛋白1抗体联合使用在控制肿瘤进展方面疗效更显著[18]。鉴于阿伐麦布在临床试验中显示出良好的人体安全性[7],我们拟探讨其在预防胆管癌发生方面是否具有一定作用。本研究以TAA处理SD大鼠3个月后再给予阿伐麦布治疗,经过长时间的干预,肿瘤发生率下降,与对照组的100%成瘤率相比,阿伐麦布干预组肿瘤发生率下降了80%。本研究结果证明阿伐麦布的长期应用能够中断或者减少TAA诱发的肝内胆管癌的发生,但还需要在今后实验中增加更多时间点,观察其抑制肿瘤发生、发展的动态变化,在肿瘤形成并有侵袭性生长时是否仍有抑制作用,以及停用阿伐麦布后大鼠肝脏是否再发肿瘤,通过长期研究确定最佳使用时间。
阿伐麦布是ACAT1抑制剂。ACAT1介导了多个肿瘤的发展和转移。在Lewis肺癌中,ACAT1的过表达促进了肺癌细胞的增殖、侵袭和转移,阿伐麦布则能逆转这种效果[19]。除了ACAT1是阿伐麦布的作用靶点外,AKR1C1是阿伐麦布的另一个潜在靶点[9]。AKR1C1的表达水平与肿瘤恶性转化及对治疗的耐药性密切相关[20]。本课题组前期研究显示阿伐麦布能够抑制AKR1C1的表达,进而抑制骨肉瘤细胞的增殖和体内成瘤能力[9]。本研究发现在胆管癌中AKR1C1也是阿伐麦布的作用靶点,细胞学实验证实阿伐麦布可降低AKR1C1的表达水平,提示阿伐麦布可通过降低AKR1C1的表达中断或延缓TAA诱导的肝内胆管癌的发生。但阿伐麦布调控AKR1C1的机制少见报道,我们前期在对骨肉瘤的研究中发现叉头框M1(forkhead box M1,FoxM1)可以转录活化AKR1C1,而FoxM1是阿伐麦布的作用靶点,因此,推测阿伐麦布通过靶向FoxM1抑制AKR1C1的转录活化,进而抑制肿瘤的发生、发展[9],然而在胆管癌中阿伐麦布是否具有同样机制还需要深入研究。
综上所述,阿伐麦布的长期使用能够中断或减少化学致癌物所致的肝内胆管癌的发生,而AKR1C1是阿伐麦布的潜在作用靶点,也是胆管癌治疗的潜在治疗靶标。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, SIEGEL R L, TORRE L A, JEMAL A. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
BODE A M, DONG Z, WANG H. Cancer prevention and control:alarming challenges in China[J]. Natl Sci Rev, 2016, 3: 117-127. DOI:10.1093/nsr/nwv054 |
| [3] |
ALBINI A, DECENSI A, CAVALLI F, COSTA A. Cancer prevention and interception:a new era for chemopreventive approaches[J]. Clin Cancer Res, 2016, 22: 4322-4327. DOI:10.1158/1078-0432.CCR-16-0695 |
| [4] |
BAGANTE F, GAMBLIN T C, PAWLIK T M. Cholangiocarcinoma risk factors and the potential role of aspirin[J]. Hepatology, 2016, 64: 708-710. |
| [5] |
KHEIRANDISH M, MAHBOOBI H, YAZDANPARAST M, KAMAL W, KAMAL M A. Anti-cancer effects of metformin:recent evidences for its role in prevention and treatment of cancer[J]. Curr Drug Metab, 2018, 19: 793-797. DOI:10.2174/1389200219666180416161846 |
| [6] |
JIAO L, BI L, LU Y, WANG Q, GONG Y, SHI J, et al. Cancer chemoprevention and therapy using Chinese herbal medicine[J/OL]. Biol Proced Online, 2018, 20: 1. doi: 10.1186/s12575-017-0066-1.
|
| [7] |
BURNETT J R, HUFF M W. Avasimibe Pfizer[J]. Curr Opin Investig Drugs, 2002, 3: 1328-1333. |
| [8] |
JIANG Y, SUN A, ZHAO Y, YING W, SUN H, YANG X, et al. Proteomics identifies new therapeutic targets of early-stage hepatocellular carcinoma[J]. Nature, 2019, 567: 257-261. DOI:10.1038/s41586-019-0987-8 |
| [9] |
WANG L, LIU Y, YU G. Avasimibe inhibits tumor growth by targeting FoxM1-AKR1C1 in osteosarcoma[J]. Onco Targets Ther, 2019, 12: 815-823. DOI:10.2147/OTT.S165647 |
| [10] |
王革芳, 陈颖, 魏培莲, 赵行, 李超富, 高云姝, 等. 阿司匹林中断硫代乙酰胺诱发大鼠胆管上皮癌变[J]. 第二军医大学学报, 2018, 39: 285-290. WANG G F, CHEN Y, WEI P L, ZHAO X, LI C F, GAO Y S, et al. Aspirin interrupts bile duct carcinoma in rats induced by thioacetamide[J]. Acad J Sec Mil Med Univ, 2018, 39: 285-290. |
| [11] |
ALEXANDROV L B, NIK-ZAINAL S, WEDGE D C, APARICIO S A, BEHJATI S, BIANKIN A V, et al. Signatures of mutational processes in human cancer[J]. Nature, 2013, 500: 415-421. DOI:10.1038/nature12477 |
| [12] |
AN J H, SEONG J, OH H, KIM W, HAN K H, PAIK Y H. [Protein expression profiles in a rat cirrhotic model induced by thioacetamide][J]. Korean J Hepatol, 2006, 12: 93-102. |
| [13] |
YEH C N, MAITRA A, LEE K F, JAN Y Y, CHEN M F. Thioacetamide-induced intestinal-type cholangiocarcinoma in rat:an animal model recapitulating the multi-stage progression of human cholangiocarcinoma[J]. Carcinogenesis, 2004, 25: 631-636. |
| [14] |
CHAN A T, ARBER N, BURN J, CHIA W K, ELWOOD P, HULL M A, et al. Aspirin in the chemoprevention of colorectal neoplasia:an overview[J]. Cancer Prev Res (Phila), 2012, 5: 164-178. DOI:10.1158/1940-6207.CAPR-11-0391 |
| [15] |
HECKMAN-STODDARD B M, DECENSI A, SAHASRABUDDHE V V, FORD L G. Repurposing metformin for the prevention of cancer and cancer recurrence[J]. Diabetologia, 2017, 60: 1639-1647. DOI:10.1007/s00125-017-4372-6 |
| [16] |
李超富, 高云姝, 周洲, 魏培莲, 徐家华, 康志敏, 等. 富氢水协同金复康口服液阻断硫代乙酰胺诱发胆管癌上皮癌变的大鼠实验研究[J]. 解放军医学院学报, 2019, 40: 586-589, 604. DOI:10.3969/j.issn.2095-5227.2019.06.018 |
| [17] |
LLAVERIAS G, LAGUNA J C, ALEGRET M. Pharmacology of the ACAT inhibitor avasimibe (CI-1011)[J]. Cardiovasc Drug Rev, 2003, 21: 33-50. |
| [18] |
YANG W, BAI Y, XIONG Y, ZHANG J, CHEN S, ZHENG X, et al. Potentiating the antitumour response of CD8+ T cells by modulating cholesterol metabolism[J]. Nature, 2016, 531: 651-655. DOI:10.1038/nature17412 |
| [19] |
BI M, QIAO X, ZHANG H, WU H, GAO Z, ZHOU H, et al. Effect of inhibiting ACAT-1 expression on the growth and metastasis of Lewis lung carcinoma[J]. Oncol Lett, 2019, 18: 1548-1556. |
| [20] |
ZENG C M, CHANG L L, YING M D, CAO J, HE Q J, ZHU H, et al. Aldo-keto reductase AKR1C1-AKR1C4: functions, regulation, and intervention for anti-cancer therapy[J/OL]. Front Pharmacol, 2017, 8: 119. doi: 10.3389/fphar.2017.00119.
|
 2020, Vol. 41
2020, Vol. 41


