2. 上海捷瑞生物工程有限公司, 上海 201615
2. Shanghai Generay Biotech Co., Ltd, Shanghai 201615, China
2019年底,新型冠状病毒肺炎疫情暴发[1-3],之后迅速发展为全球大流行。2020年2月11日(当地时间),国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)将引起此次疫情的新型冠状病毒命名为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2);WHO同日宣布,将这一病毒引起的疾病正式命名为coronavirus disease 2019(COVID-19)。目前,我国疫情逐渐控制,新确诊SARS-CoV-2感染者日趋减少,但全球的疫情形势依然严峻。相关药物与疫苗的研发是疫情控制非常迫切的需要,而SARS-CoV-2的高感染特性给药物与疫苗研发的临床前效果评价带来了很大困难。
对于有包膜病毒,利用慢病毒或反转录病毒载体的包装系统可制备出表面装配有介导病毒感染靶细胞的包膜糖蛋白、基因组中含有荧光素酶或荧光蛋白报告基因的假型病毒(pseudotype virus)或假型颗粒(pseudoparticles,pps),简称为假病毒[4]。假病毒具有与原真病毒类似的感染性,但无复制能力,因而可以在生物安全二级防护条件下进行实验操作,又因其检测方便,是一种可替代高感染、高致病性病毒进行病毒感染侵入机制研究及病毒细胞侵入抑制剂评价的有效模型,被广泛用于高致病性禽流感病毒[4]、丙型肝炎病毒(hepatitis C virus,HCV)[5]、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)[6]、严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)[7]等病毒的相关研究。为了能在生物安全二级实验室进行SARS-CoV-2抗体中和活性评价及病毒细胞侵入抑制剂筛选,本研究建立了SARS-CoV-2假病毒的制备方法,并对其感染性进行验证。
1 材料和方法 1.1 质粒载体、细胞、试剂哺乳动物细胞质粒表达载体pcDNA3.1(+)为美国Thermo Fisher公司产品,pCI-neo为美国Promega公司产品,phCMV-E1E2[8]由法国国立健康与医学研究院Cosset博士赠送,兔抗SARS-CoV-2刺突蛋白(spike protein,S蛋白)S1亚基单克隆抗体为北京义翘神州科技有限公司产品,人源抗SARS-CoV-2 S1单克隆抗体为上海三优生物医药有限公司产品。2份COVID-19患者恢复期血清样本取自江苏大学附属镇江第三人民医院收治的2例确诊COVID-19患者(在患者治疗康复出院3周后采集),健康成年人血清取自本实验室人员,所有样本提供者均签署知情同意书。兔血清总IgG为本实验室用protein A从新西兰兔血清中纯化,Vero E6细胞由复旦大学上海医学院张荣研究员赠送,Huh7细胞由本实验室保存,质粒转染试剂Lipofectamine 2000、Alexa Fluor® 488标记的抗兔及抗人IgG为美国Thermo Fisher公司产品,分子克隆所用的工具酶均为美国New England Biolabs公司产品,氯喹与盐酸阿比朵尔为美国MedChemExpress公司产品。
1.2 SARS-CoV-2 S基因设计、合成与表达质粒构建根据GenBank(登录号:MN975262)中的序列信息,合成SARS-CoV-2的野生型S基因序列,同时根据哺乳动物细胞偏爱使用的密码子、mRNA二级结构的稳定性、排除潜在的真核或原核启动子等原则设计3条序列优化的S基因序列,并对其中1条序列中胞质区肽段(KFDEDD SEPVLKGVKLHYT)进行局部缺失突变,该基因被命名为Sopti。将上述共5条S基因通过酶切、连接插入到质粒载体pcDNA3.1(+)和pCI-neo中,用酶切、连接联合同源重组方法将S基因置换phCMV-E1E2载体里的HCV包膜蛋白E1E2基因。
1.3 SARS-CoV-2 S基因表达产物鉴定将293T细胞接种于24孔板,将上述S基因表达质粒用Lipofectamine 2000试剂转染293T细胞,转染24 h后,将细胞重新接种于96孔板,继续培养24 h,用免疫荧光法检测S蛋白的表达[9]。所用的检测抗体包括兔抗SARS-CoV-2 S1单克隆抗体、人源抗SARS-CoV-2 S1单克隆抗体、COVID-19患者恢复期血清,荧光二抗用Alexa Fluor® 488标记的抗兔及抗人IgG。
1.4 假病毒制备与感染性检测将SARS-CoV-2 S基因表达质粒与慢病毒骨架质粒pCMV-Gag/Pol、pCMV-ReV和pLenti-EGFP共转染293T细胞,仅转染3种HIV骨架质粒的细胞作为阴性对照[9]。转染60 h后,收集细胞培养上清,用0.45 μm微量滤器过滤除去上清中可能残留的293T细胞后,用于靶细胞感染[9]。Vero E6细胞和Huh7细胞均是SARS-CoV-2的易感细胞[1],因此分别以这2种细胞为靶细胞进行假病毒感染性检测。Vero E6细胞和Huh7细胞提前12 h接种于96孔板,每孔8 000个细胞。用于假病毒感染时,每孔先吸除20 μL培养液,再加入假病毒20 μL,混匀,置于细胞培养箱内,6 h后吸除培养液,每孔加入完全DMEM培养液100 μL。置于细胞培养箱内,18 h后每次间隔12 h于荧光显微镜下观察细胞内是否出现绿色荧光,并用细胞成像及分析系统(BioTek Cytation 5 Imaging Reader)对EGFP阳性细胞进行计数,计算感染滴度(FFU/mL,FFU为focus forming unit)。
1.5 检测膜融合抑制剂和S抗体对SARS-CoV-2 pps感染的影响将Vero E6细胞接种于96孔板,12 h后用于假病毒感染。将感染滴度约200 FFU的SARS-CoV-2 pps加入Vero E6细胞,同时加入膜融合抑制剂氯喹或盐酸阿比朵尔,设置10、5、2.5 μmol/L 3个工作浓度,6 h后换培养液,再次加入相同浓度膜融合抑制剂,继续培养30 h,计数绿色荧光细胞;将SARS-CoV-2 pps分别与兔抗SARS-CoV-2 S1单克隆抗体、人源抗SARS-CoV-2 S1单克隆抗体、COVID-19患者恢复期血清混匀,2种单克隆抗体浓度均为2.5 μg/mL,血清稀释度为1:100,以完全DMEM培养液稀释,总体积100 μL,将病毒/抗体混合液置于细胞培养箱内静置30 min,然后吸除Vero E6细胞的培养液,将病毒/抗体混合液加入细胞培养孔中,6 h后换培养液,继续培养30 h,计数EGFP阳性细胞。计算感染抑制率:感染抑制率(%)=(1-处理组EGFP阳性细胞数)/未处理组EGFP阳性细胞数×100%。
1.6 统计学处理应用Excel软件进行统计学分析,计量资料以x±s表示,两组间比较用独立样本t检验。检验水准(α)为0.05。
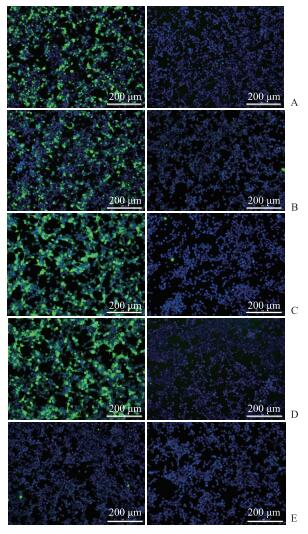
2 结果 2.1 SARS-CoV-2 S蛋白在293T细胞中的表达鉴定我们比较了野生型S基因、3条序列优化的S基因及1条序列优化且胞质区肽段缺失19个氨基酸残基的S基因Sopti制备出的假病毒滴度,结果显示phCMV-Sopti质粒与慢病毒骨架质粒共转染293T细胞能产生相对较高滴度的假病毒,故仅展示该质粒的实验结果。如图 1所示,兔抗SARS-CoV-2 S1单克隆抗体、人源抗SARS-CoV-2 S1单克隆抗体、2份COVID-19患者恢复期血清均可与phCMV-Sopti质粒转染的293T细胞结合,不与空载体phCMV转染的293T细胞结合。作为阴性对照的健康人血清不与phCMV-Sopti质粒转染的293T细胞结合。
|
图 1 免疫荧光检测SARS-CoV-2 S抗体与phCMV-Sopti质粒转染的293T细胞的结合 Fig 1 Immunofluorescence detection of SARS-CoV-2 S antibodies binding to 293T cells transfected with phCMV-Sopti plasmid A: Monoclonal antibody of rabbit against SARS-CoV-2 S1 protein; B: Monoclonal antibody of human against SARS-CoV-2 S1 protein; C: Convalescent serum of patient 1 with COVID-19; D: Convalescent serum of patient 2 with COVID-19; E: Serum of a healthy adult. The left panel shows 293T cells transfected with phCMV-Sopti plasmid, and the right panel shows 293T cells transfected with mock vector phCMV. SARS-CoV-2: Severe acute respiratory syndrome coronavirus 2; COVID-19: Coronavirus disease 2019 |
2.2 SARS-CoV-2 pps感染靶细胞的鉴定
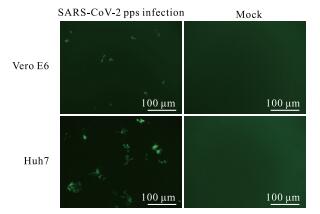
phCMV-Sopti与慢病毒骨架质粒共转染293T细胞的培养上清加入Vero E6细胞和Huh7细胞,随后通过荧光显微镜观察细胞内的绿色荧光。如图 2所示,36 h后可观察到Vero E6细胞内明显的绿色荧光,而Huh7细胞在72 h以后才可以观察到较明显的绿色荧光(观察时2种细胞均100%汇合,明场照片未显示)。对照转染的293T细胞上清加入Vero E6细胞和Huh7细胞在相应时间点均未观察到绿色荧光。结果表明phCMV-Sopti与慢病毒包装骨架质粒共转染293T细胞可产生感染性的SARS-CoV-2 pps。计数绿色荧光阳性细胞的数量,计算出SARS-CoV-2 pps滴度,感染Vero E6细胞约为1×104 FFU/mL,感染Huh7细胞约为4×104 FFU/mL。
|
图 2 SARS-CoV-2 pps感染Vero E6细胞(36 h)与Huh7细胞(72 h)的绿色荧光成像 Fig 2 Green fluorescence imaging of Vero E6 cells (36 h) and Huh7 cells (72 h) infected with SARS-CoV-2 pps Mock: Supernatants of 293T cells transfected with lentiviral backbone plasmids devoid of phCMV-Sopti. SARS-CoV-2 pps: Severe acute respiratory syndrome coronavirus 2 pseudoparticles |
2.3 2种膜融合抑制剂对SARS-CoV-2 pps感染的影响
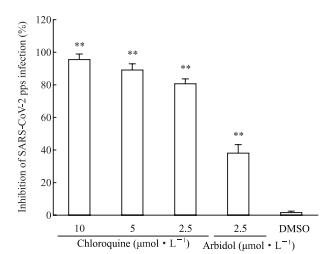
氯喹和盐酸阿比朵尔均可通过抑制内体的酸化而抑制病毒被胞吞以后病毒包膜与内体膜的融合过程,目前两者都被用于COVID-19患者的临床治疗。在SARS-CoV-2 pps感染Vero E6细胞的体系中加入这2种膜融合抑制剂,检测其对假病毒感染的影响。如图 3所示,与DMSO溶剂相比,氯喹在10、5、2.5 μmol/L 3个浓度梯度均可抑制SARS-CoV-2 pps的感染(P均<0.01);盐酸阿比朵尔在10 μmol/L浓度时对Vero E6细胞有明显毒性效应,在2.5 μmol/L浓度时对Vero E6细胞存活无明显影响(CCK-8法检测,结果未显示),但能显著抑制假病毒的感染。
|
图 3 膜融合抑制剂对SARS-CoV-2 pps感染的影响 Fig 3 Effects of membrane fusion inhibitors on SARS-CoV-2 pps infection SARS-CoV-2 pps: Severe acute respiratory syndrome coronavirus 2 pseudoparticles; DMSO: Dimethyl sulfoxide. **P<0.01 vs DMSO (control) group. n=3, x±s |
2.4 S1单克隆抗体及COVID-19患者恢复期血清对SARS-CoV-2 pps感染的影响
假病毒是用于评价抗体中和活性的有效模型,如表 1所示,与对照兔IgG相比,兔抗SARS-CoV-2 S1单克隆抗体未显示明显中和活性(P>0.05);与健康人血清相比,人源S1单克隆抗体及2份COVID-19患者恢复期血清均能有效中和SARS-CoV-2 pps的感染(P均<0.01)。
|
|
表 1 S1单克隆抗体及COVID-19患者恢复期血清对SARS-CoV-2 pps感染的影响 Tab 1 Effect of monoclonal antibodies against S1 protein and convalescent sera of COVID-19 patients on SARS-CoV-2 pps infection |
3 讨论
虽然目前中国已经迈过了SARS-CoV-2疫情的至暗时刻,但境外多国疫情仍在扩散。由于相关各国社会经济发展和公共卫生与医疗体系结构、基础设施、能力以及人群结构分布的差异,一些国家的疫情防控可能要经历较为长久的时间。由于RNA病毒高度变异,SARS-CoV-2将类似于流感病毒长期与人类共存的可能性难以排除。当前,基于已有抗病毒药物开展的临床试验显示有效药物寥寥无几,药物与疫苗研发在全球范围内受到高度关注。众多公司已开展基于不同类型的疫苗研发,其中美国Moderna制药公司的mRNA疫苗于2020年3月中旬最先开始由美国国立卫生研究院(National Institutes of Health,NIH)开展临床试验。
SARS-CoV-2、SARS-CoV及MERS-CoV均为高致病性冠状病毒,针对这3种病毒的实验操作需要在具备相应资质的生物安全三级实验室内开展,这成为制约药物和疫苗研发的瓶颈。基于反转录病毒或HIV骨架的假病毒可在较大程度上替代真病毒进行药物筛选(限于阻止病毒侵入细胞的药物)和疫苗评价,具有较高安全性且检测方便[4-7]。影响假病毒包装效率的因素很多,包括包装骨架质粒的结构、病毒包膜蛋白的表达水平、转染前293T细胞的生长状态、包装质粒组合比例、质粒转染效率、293T细胞培养液的血清含量、假病毒上清的收集时间等多种因素。这类假病毒包装技术已成功应用于多种有包膜病毒,关键影响因素在于病毒包膜蛋白的表达水平和结构特征。我们先前曾制备HCV和流感病毒的假病毒,用于研究病毒的细胞侵入机制和评价抗体的中和活性[9-11]。基于这些工作,我们尝试制备SARS-CoV-2 pps。
镶嵌于病毒包膜的S蛋白是介导SARS-CoV-2感染宿主细胞的关键结构蛋白[1]。我们合成了天然序列的S基因,分别用常用的2种商品化质粒pcDNA3.1和pCI-neo为表达载体,联合HIV骨架质粒共转染293T细胞,获得的上清中假病毒感染性均很低(感染Huh7细胞的滴度小于100 FFU/mL)。于是对S基因序列进行优化,其设计原则如“材料和方法”1.2项中所述,共合成了3条序列优化的S基因,仍以pcDNA3.1和pCI-neo为表达载体,尽管获得的假病毒滴度提高了3~5倍,但仍不具备实用价值。与此不同的是,SARS-CoV序列优化的S基因表达质粒在同样实验条件下,上清感染Huh7细胞的滴度可以达到105 FFU/mL(结果未显示),这提示与SARS-CoV相比,SARS-CoV-2的S蛋白与HIV衣壳蛋白及基因组被共同包装成假病毒的效率较低。
我们进一步对其中1条序列优化的S基因的胞内段进行截短突变,截短胞内段可能会促进S蛋白与HIV衣壳蛋白共同从细胞膜出芽释放。此外,基于我们先前制备HCV pps的经验,改用质粒phCMV作为S基因的表达载体。质粒phCMV与pcDNA3.1和pCI-neo均以CMV启动子为转录调控元件,但其还含有内含子和内部核糖体进入位点(IRES)序列,二者可分别提高mRNA的稳定性和蛋白质翻译效率。质粒pCI-neo含有内含子序列,但不含IRES序列。质粒pcDNA3.1中,IRES和内含子序列均不具备。结果显示,这些策略有效提高了SARS-CoV-2 pps的滴度。磷酸氯喹与抗流感药物盐酸阿比朵尔被用于COVID-19的抗病毒治疗,均显示了一定疗效[12-13]。二者均是膜融合抑制剂,对于SARS-CoV-2 pps的感染具有显著的抑制作用。人源抗SARS-CoV-2 S1单克隆抗体及来自2例COVID-19患者的恢复期血清均可与SARS-CoV-2 S蛋白结合,且均能有效中和假病毒感染。这提示SARS-CoV-2感染可诱导产生保护性体液免疫应答,有助于预防再次感染。
综上所述,我们通过对SARS-CoV-2 S基因的序列优化等策略建立了感染性SARS-CoV-2 pps的制备方法,获得的假病毒对靶细胞的感染能被膜融合抑制剂及S蛋白抗体所抑制,可作为抗SARS-CoV-2药物筛选与疫苗评价的一种安全、方便的替代模型。
志谢 本研究所用的COVID-19患者恢复期血清由海军军医大学(第二军医大学)长海医院呼吸与危重症医学科吴俊杰教授提供,在此表示感谢。
| [1] |
ZHOU P, YANG X L, WANG X G, HU B, ZHANG L, ZHANG W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020, 579: 270-273. DOI:10.1038/s41586-020-2012-7 |
| [2] |
ZHU N, ZHANG D Y, WANG W L, LI X W, YANG B, SONG J D, et al. A novel coronavirus from patients with pneumonia in China, 2019[J]. N Engl J Med, 2020, 382: 727-733. DOI:10.1056/NEJMoa2001017 |
| [3] |
WU F, ZHAO S, YU B, CHEN Y M, WANG W, SONG Z G, et al. A new coronavirus associated with human respiratory disease in China[J]. Nature, 2020, 579: 265-269. DOI:10.1038/s41586-020-2008-3 |
| [4] |
GARCIA J M, LAI J C. Production of influenza pseudotyped lentiviral particles and their use in influenza research and diagnosis:an update[J]. Expert Rev Anti Infect Ther, 2011, 9: 443-455. DOI:10.1586/eri.11.25 |
| [5] |
CATANESE M T, DORNER M. Advances in experimental systems to study hepatitis C virus in vitro and in vivo[J]. Virology, 2015, 479-480: 221-233. DOI:10.1016/j.virol.2015.03.014 |
| [6] |
YANG Y, DU L Y, LIU C, WANG L L, MA C Q, TANG J, et al. Receptor usage and cell entry of bat coronavirus HKU4 provide insight into bat-to-human transmission of MERS coronavirus[J]. Proc Natl Acad Sci USA, 2014, 111: 12516-12521. DOI:10.1073/pnas.1405889111 |
| [7] |
GIROGLOU T, CINATL J J R, RABENAU H, DROSTEN C, SCHWALBE H, DOERR H W, et al. Retroviral vectors pseudotyped with severe acute respiratory syndrome coronavirus S protein[J]. J Virol, 2004, 78: 9007-9015. DOI:10.1128/JVI.78.17.9007-9015.2004 |
| [8] |
BARTOSCH B, DUBUISSON J, COSSET F L. Infectious hepatitis C virus pseudo-particles containing functional E1-E2 envelope protein complexes[J]. J Exp Med, 2003, 197: 633-642. DOI:10.1084/jem.20021756 |
| [9] |
GUAN M, WANG W B, LIU X Q, TONG Y M, LIU Y, REN H, et al. Three different functional microdomains in the hepatitis C virus hypervariable region 1(HVR1) mediate entry and immune evasion[J]. J Biol Chem, 2012, 287: 35631-35645. DOI:10.1074/jbc.M112.382341 |
| [10] |
LIU Y, LIU X Q, FANG J, SHEN X N, CHEN W, LIN X J, et al. Characterization of antibodies specific for hemagglutinin and neuraminidase proteins of the 1918 and 2009 pandemic H1N1 viruses[J]. Vaccine, 2010, 29: 183-190. DOI:10.1016/j.vaccine.2010.10.059 |
| [11] |
WANG W B, PENG H R, TAO Q Y, ZHAO X T, TANG H L, TANG Z W, et al. Serologic assay for avian-origin influenza A (H7N9) virus in adults of Shanghai, Guangzhou and Yunnan, China[J]. J Clin Virol, 2014, 60: 305-308. DOI:10.1016/j.jcv.2014.04.006 |
| [12] |
CORTEGIANI A, INGOGLIA G, IPPOLITO M, GIARRATANO A, EINAV S. A systematic review on the efficacy and safety of chloroquine for the treatment of COVID-19[J/OL]. J Crit Care, 2020. doi: 10.1016/j.jcrc.2020.03.005.
|
| [13] |
DENG L S, LI C N, ZENG Q, LIU X, LI X H, ZHANG H T, et al. Arbidol combined with LPV/r versus LPV/r alone against corona virus disease 2019: a retrospective cohort study[J/OL]. J Infect, 2020. doi: 10.1016/j.jinf.2020.03.002.
|
 2020, Vol. 41
2020, Vol. 41


