甲状腺相关眼病(thyroid-associated ophthalmopathy,TAO)是成人最常见的眼眶病之一,与甲状腺自身免疫异常密切相关[1]。眼外肌功能障碍导致的视物重影是TAO较为常见的临床表现之一,对患者生活质量影响较大,通常发生于疾病后期及眼眶减压术后[2]。TAO的发病机制尚不明确,就目前研究结果来看,眼眶成纤维细胞(orbital fibroblast,OF)是患者眼眶内病理改变的基础,TGF-β诱导的OF纤维化也是患者视物重影的主要原因[3]。
在以往的研究中,我们发现穿透素3(pentraxin 3,PTX3)作为一种体液免疫中的模式识别分子,在TAO患者眼眶脂肪结缔组织及血液中高表达[4],同时促甲状腺激素(thyroid stimulating hormone,TSH)可以诱导OF表达PTX3[5],因此我们认为PTX3与TAO的发病高度相关。研究发现PTX3参与人体皮肤创伤修复、特发性肺纤维化及肾间质纤维化等多个病理生理过程[6-7],但PTX3在TAO后期纤维化中的作用尚未见报道。本研究拟应用人重组PTX3(human recombinant PTX3,rhPTX3)蛋白和重组TGF-β1刺激体外培养的OF,探索PTX3对TGF-β1诱导的OF纤维化过程的影响。
1 材料和方法 1.1 样本收集本研究所纳入的TAO患者来源OF取自2018年7月至2019年2月在我科行眼眶减压术的TAO患者,共3例3眼,女2例、男1例,年龄27~45岁,均按照欧洲Graves眼病专家组(European Group on Graves’ Orbitopathy,EUGOGO)标准[8]确诊TAO,患者术前甲状腺功能稳定6个月以上,眼部情况稳定6个月以上,无放射治疗史,未行大剂量糖皮质激素冲击治疗或停用6个月以上。健康来源OF取自2018年8月至2019年1月在我科行上睑下垂矫正术及眼袋整形术的患者,共3例3眼,女2例、男1例,年龄29~34岁,排除自身免疫性疾病及其他眼病,根据患者病情于术中取得脱出眶隔的脂肪结缔组织标本。本研究经海军军医大学(第二军医大学)生物医学伦理委员会审批,患者及家属签署知情同意书后获取相关标本。
1.2 试剂和仪器DMEM高糖培养液、FBS及0.25%胰蛋白酶-EDTA消化液购自美国Gibco公司,青霉素-链霉素溶液(100×)购自上海碧云天生物技术有限公司,TRIzol试剂购自美国Invitrogen公司,无水乙醇及甲醇购自上海国药集团,TB Green® Premix Ex TaqTM和PrimeScriptTM RT Master Mix试剂盒购自日本TaKaRa公司,人重组TGF-β1购自美国Peprotech公司,rhPTX3蛋白和重组α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体购自英国Abcam公司。
低温超速离心机(德国Hettich公司),超净工作台和CO2恒温培养箱(美国Thermo公司),倒置相差显微镜(日本Nikon公司),ABI 7900HT荧光定量PCR仪和普通PCR仪(美国ABI公司),荧光分光光度计(美国NanoDrop公司)。
1.3 OF培养手术中取下眼眶脂肪结缔组织标本后,于无菌条件下迅速转移至盛有含20% FBS和1%青霉素-链霉素双抗的DMEM高糖培养液的离心管中。将离心管置入冰水混合物中,快速转运(1 h内)至细胞房超净台(超净台经紫外线消毒30 min)。采用经典组织块培养法培养细胞并传代,第4~10代OF用于后续实验。
1.4 实验分组用含1% FBS的培养液饥饿处理细胞12 h后,分别将TAO患者来源OF和健康来源OF分为4组:空白组加入完全培养液处理细胞;rhPTX3组加入含1 μg/mL rhPTX3的完全培养液处理细胞;TGF-β1组加入含10 ng/mL TGF-β1的完全培养液处理细胞;rhPTX3+TGF-β1组加入含1 μg/mL rhPTX3和10 ng/mL TGF-β1的完全培养液处理细胞。
1.5 细胞免疫荧光实验按照实验分组将OF以每孔3×104个细胞的密度接种到96孔细胞培养板中,并置于5% CO2、37 ℃细胞培养箱孵育至细胞贴壁融合生长。细胞处理完成后,吸弃原有培养液后加入100 μL甲醇,置于-20 ℃进行细胞固定。用0.1% Triton X-100(PBS配制)溶液完成细胞透化后,封闭非特异性抗原位点。室温下依次孵育特异性一抗及二抗,DAPI染核后于荧光显微镜下观察。
1.6 qRT-PCR采用TRIzol法提取细胞总RNA,经PrimeScriptTM RT Master Mix反转录试剂盒将RNA反转录为cDNA后,应用TB Green® Premix Ex TaqTM试剂盒配制反应体系,384孔板加样离心混匀后进行PCR反应,用SDS 2.4软件分析目的基因相对表达量。具体实验方法见各试剂盒说明书。该部分实验所使用的引物均由生工生物工程(上海)股份有限公司代为合成,具体序列如下:α-SMA上游引物5′-GGT GAT GGT GGG AAT GGG-3′,下游引物5′-GCA GGG TGG GAT GCT CTT-3′;GAPDH上游引物5′-TTG CCA TCA ATG ACC CCT A-3′,下游引物5′-CGC CCC ACT TGA TTT TGG-3′;Ⅰ型胶原蛋白α1(collagen typeⅠα1,ColIα1)上游引物5′-GAG GGC CAA GAC GAA GAC ATC-3′,下游引物5′-CAG ATC ACG TCA TCG CAC AAC-3′;IL-6上游引物5′-ACT CAC CTC TTC AGA ACG AAT TG-3′,下游引物5′-CCA TCT TTG GAA GGT TCA GGT TG-3′。
1.7 统计学处理采用GraphPad Prism 7.04软件绘图,SPSS 21.0软件进行统计学分析。数据以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。检验标准(α)为0.05。
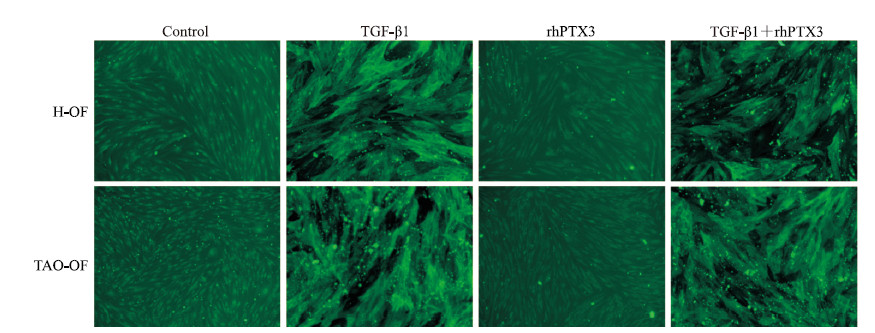
2 结果 2.1 rhPTX3蛋白对TGF-β1诱导的OF分化的影响细胞免疫荧光实验结束(图 1)显示,OF培养5 d后,空白组中OF均为纺锤形、低荧光的正常成纤维细胞形态;rhPTX3组OF细胞形态及α-SMA蛋白表达未发生明显变化;TGF-β1组OF形态明显改变,α-SMA蛋白强阳性、表达增加,说明其已分化为肌成纤维细胞并发生纤维化;rhPTX3+TGF-β1组与TGF-β1组相比没有明显改变,且TAO患者来源OF和健康来源OF对TGF-β1和rhPTX3的反应无明显差异。
|
图 1 rhPTX3对TGF-β1诱导的OF向肌成纤维细胞分化的影响 Fig 1 Effect of rhPTX3 on TGF-β1-induced fibrosis in OFs Green fluorescence showing positive expression of α-smooth muscle actin. rhPTX3: Human recombinant pentraxin 3; TGF-β1: Transforming growth factor β1; OF: Orbital fibroblast; H-OF: OF cultured from healthy donors; TAO-OF: OF cultured from patients with thyroid-associated ophthalmopathy. Original magnification: ×100 |
2.2 rhPTX3蛋白对TGF-β1诱导的ColIα1和α-SMA mRNA表达的影响
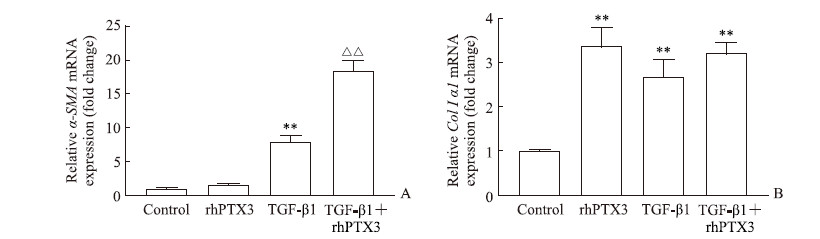
结果如图 2A所示,TGF-β1上调OF内α-SMA mRNA的表达量(相当于对照组的7.97±0.69倍,P<0.01),rhPTX3本身对α-SMA mRNA的表达无明显影响,但与TGF-β1共处理OF可增强TGF-β1对α-SMA的诱导作用,α-SMA mRNA的表达量上升(相当于对照组的18.43±1.23倍,P<0.01);rhPTX3对ColIα1 mRNA的表达并没有表现出类似的效应(图 2B),rhPTX3、TGF-β1及两者共同刺激均可上调ColIα1 mRNA表达(分别相当于对照组的3.27±0.35、2.69±0.32、3.24±0.18倍,与对照组比较P<0.01),但3组间差异无统计学意义。
|
图 2 rhPTX3对OF内α-SMA和ColIα1 mRNA表达的影响 Fig 2 Effect of rhPTX3 on α-SMA and ColIα1 mRNA expression in OFs rhPTX3: Human recombinant pentraxin 3; OF: Orbital fibroblast (cultured from healthy donors); α-SMA: α-smooth muscle actin; ColⅠα1: Collagen typeⅠα1; TGF-β1: Transforming growth factor β1. **P < 0.01 vs control group; △△P < 0.01 vs TGF-β1 group. n=3, x±s |
2.3 rhPTX3蛋白对TGF-β1诱导的IL-6 mRNA表达的影响
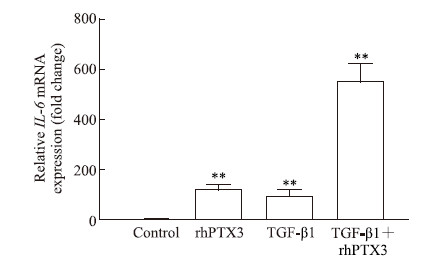
TGF-β1和rhPTX3均上调OF内IL-6 mRNA的表达量,分别相当于对照组的93.33±19.22倍和121.25±18.81倍(P均<0.01)。rhPTX3与TGF-β1共处理OF组IL-6 mRNA表达的上调幅度远远超过两者单独作用的诱导效应之和,相当于对照组的549.32±59.69倍(P<0.01)。见图 3。
|
图 3 rhPTX3对OF内IL-6 mRNA表达的影响 Fig 3 Effect of rhPTX3 on IL-6 mRNA expression in OFs rhPTX3: Human recombinant pentraxin 3; OF: Orbital fibroblast (cultured from healthy donors); IL-6: Interleukin 6; TGF-β1: Transforming growth factor β1. **P<0.01 vs control group. n=3, x±s |
3 讨论
自20世纪90年代研究者发现TGF-β可以诱导OF产生黏多糖并发生纤维化改变[9]以来,对TAO发病过程中纤维化的探索均围绕这一病理过程展开。近年有研究发现TGF-β1可以诱导TAO患者来源OF中鞘氨醇磷酸酯和miRNA-146a的水平升高,前者可能介导了OF内纤维化相关指标的升高[10],而后者在TGF-β诱导的纤维化过程中发挥了负性调节的作用[11]。此外,Fang等[12]研究发现,IL-17A可以促进TGF-β诱导的CD90+ OF纤维化,同时抑制CD90- OF的脂肪化。
我们的前期研究已经证实PTX3与TAO发病高度相关[4-5],而PTX3与组织重构纤维化之间的紧密联系也被越来越多的研究所证实,如Hung等[13]发现PTX3可以通过激活JNK信号通路调节上皮间质转化诱导细胞迁移,参与肾小管间质纤维化;Pilling等[14]发现PTX3广泛分布于特发性肺纤维化患者的肺组织中,同时促进人外周血中单核细胞来源的纤维细胞分化。有趣的是,目前在TAO的研究中发展出一个新的观点,该观点认为外周血中CD34+纤维细胞有可能通过血液循环到达眼眶,并分化成眼眶中CD34+ OF,参与TAO的发病[15]。上述发现说明PTX3很可能参与了TAO纤维化的病理过程。考虑到TAO患者来源的眼眶脂肪结缔组织中PTX3表达较高[4],我们选择在培养液中加入rhPTX3,模拟OF在TAO患者眼眶中的高水平PTX3环境,观察TGF-β1的纤维化效应是否发生改变。细胞免疫荧光实验结果表明,rhPTX3对TGF-β1诱导的纤维化没有明显的抑制效应。qRT-PCR结果中α-SMA mRNA表达量发生改变,进一步证明rhPTX3不影响α-SMA表达,却可以与TGF-β1协同上调α-SMA的表达,符合PTX3促进纤维化的假设。令人费解的是,ColIα1并未表现出与α-SMA同样的特征,rhPTX3、TGF-β1或是两者共同刺激均可上调其表达,但3组的调节幅度间差异无统计学意义。由于论证手段的局限性,以上结果仅能在一定程度上提示PTX3可能会促进TGF-β1诱导OF纤维化,还需要更多针对OF的功能学实验证明PTX3含量改变对OF表型的影响。
此外,IL-6作为一个传统的内生性致热原和炎性因子,近期在纤维化疾病的领域中得到了关注。Papiris等[16]研究了特发性肺纤维化患者血液样本,发现存在IL-6增高的特征。无独有偶,在2020年的一项研究中发现,特发性肺纤维化患者来源的人肺成纤维细胞中IL-6受体表达较高,IL-6可以激活细胞内TGF-β信号通路相关蛋白[17]。然而,在TAO发病机制的研究中,IL-6的升高仅仅被认为是TSH受体激活、CD40-CD154诱导、前炎性因子刺激的结果,并参与TAO眼眶炎症环境的延续和B淋巴细胞的成熟[18],其在纤维化中的作用及其与TGF-β之间的关系尚未见研究报道。本研究首次发现TGF-β1可以上调OF中IL-6表达,且PTX3蛋白对该诱导效应有协同作用,能大幅度上调IL-6的表达。PTX3最初是作为一种急性期炎症蛋白被发现的,IL-6可以诱导其他2种穿透素的生成,却对PTX3的表达没有明显作用[19]。本研究发现OF中PTX3对IL-6表达具有上调作用,即PTX3、TGF-β和IL-6三者的相互作用可能是TAO眼眶中炎症和纤维化进程交联的关键环节,该作用为TAO发病机制的研究提供了新的思路,也为临床提供了潜在的治疗靶点。
| [1] |
BAHN R S, GARRITY J A, GORMAN C A. Clinical review 13: diagnosis and management of graves' ophthalmopathy[J]. J Clin Endocrinol Metab, 1990, 71: 559-563. DOI:10.1210/jcem-71-3-559 |
| [2] |
HARRAD R. Management of strabismus in thyroid eye disease[J]. Eye (Lond), 2015, 29: 234-237. DOI:10.1038/eye.2014.282 |
| [3] |
VAN STEENSEL L, DIK W A. The orbital fibroblast: a key player and target for therapy in Graves' ophthalmopathy[J]. Orbit, 2010, 29: 202-206. DOI:10.3109/01676831003668443 |
| [4] |
MOU P, CHEN Z, JIANG L, CHENG J, WEI R. PTX3: a potential biomarker in thyroid associated ophthalmopathy[J]. Biomed Res Int, 2018, 2018: 5961974. DOI:10.1155/2018/5961974 |
| [5] |
WANG H, ATKINS S J, FERNANDO R, WEI R L, SMITH T J. Pentraxin-3 is a TSH-inducible protein in human fibrocytes and orbital fibroblasts[J]. Endocrinology, 2015, 156: 4336-4344. DOI:10.1210/en.2015-1399 |
| [6] |
DONI A, MUSSO T, MORONE D, BASTONE A, ZAMBELLI V, SIRONI M, et al. An acidic microenvironment sets the humoral pattern recognition molecule PTX3 in a tissue repair mode[J]. J Exp Med, 2015, 212: 905-925. DOI:10.1084/jem.20141268 |
| [7] |
XIAO Y, YANG N, ZHANG Q, WANG Y, YANG S, LIU Z. Pentraxin 3 inhibits acute renal injury-induced interstitial fibrosis through suppression of IL-6/Stat3 pathway[J]. Inflammation, 2014, 37: 1895-1901. DOI:10.1007/s10753-014-9921-2 |
| [8] |
BARTALENA L, BALDESCHI L, BOBORIDIS K, ECKSTEIN A, KAHALY G J, MARCOCCI C, et al. The 2016 European Thyroid Association/European Group on Graves' Orbitopathy guidelines for the management of Graves' orbitopathy[J]. Eur Thyroid J, 2016, 5: 9-26. DOI:10.1159/000443828 |
| [9] |
KORDUCKI J M, LOFTUS S J, BAHN R S. Stimulation of glycosaminoglycan production in cultured human retroocular fibroblasts[J]. Invest Ophthalmol Vis Sci, 1992, 33: 2037-2042. |
| [10] |
KO J, CHAE M K, LEE J H, LEE E J, YOON J S. Sphingosine-1-phosphate mediates fibrosis in orbital fibroblasts in Graves' orbitopathy[J]. Invest Ophthalmol Vis Sci, 2017, 58: 2544-2553. DOI:10.1167/iovs.16-20684 |
| [11] |
JANG S Y, PARK S J, CHAE M K, LEE J H, LEE E J, YOON J S. Role of microRNA-146a in regulation of fibrosis in orbital fibroblasts from patients with Graves' orbitopathy[J]. Br J Ophthalmol, 2018, 102: 407-414. DOI:10.1136/bjophthalmol-2017-310723 |
| [12] |
FANG S, HUANG Y, ZHONG S, LI Y, ZHANG Y, LI Y, et al. Regulation of orbital fibrosis and adipogenesis by pathogenic Th17 cells in Graves orbitopathy[J]. J Clin Endocrinol Metab, 2017, 102: 4273-4283. DOI:10.1210/jc.2017-01349 |
| [13] |
HUNG T W, TSAI J P, LIN S H, LEE C H, HSIEH Y H, CHANG H R. Pentraxin 3 activates JNK signaling and regulates the epithelial-to-mesenchymal transition in renal fibrosis[J]. Cell Physiol Biochem, 2016, 40: 1029-1038. DOI:10.1159/000453159 |
| [14] |
PILLING D, COX N, VAKIL V, VERBEEK J S, GOMER R H. The long pentraxin PTX3 promotes fibrocyte differentiation[J]. PLoS One, 2015, 10: e0119709. DOI:10.1371/journal.pone.0119709 |
| [15] |
SMITH T J. Potential roles of CD34+ fibrocytes masquerading as orbital fibroblasts in thyroid-associated ophthalmopathy[J]. J Clin Endocrinol Metab, 2019, 104: 581-594. DOI:10.1210/jc.2018-01493 |
| [16] |
PAPIRIS S A, TOMOS I P, KARAKATSANI A, SPATHIS A, KORBILA I, ANALITIS A, et al. High levels of IL-6 and IL-8 characterize early-on idiopathic pulmonary fibrosis acute exacerbations[J]. Cytokine, 2018, 102: 168-172. DOI:10.1016/j.cyto.2017.08.019 |
| [17] |
EPSTEIN SHOCHET G, BROOK E, BARDENSTEIN-WALD B, SHITRIT D. TGF-β pathway activation by idiopathic pulmonary fibrosis (IPF) fibroblast derived soluble factors is mediated by IL-6 trans-signaling[J]. Respir Res, 2020, 21: 56. DOI:10.1186/s12931-020-1319-0 |
| [18] |
HWANG C J, AFIFIYAN N, SAND D, NAIK V, SAID J, POLLOCK S J, et al. Orbital fibroblasts from patients with thyroid-associated ophthalmopathy overexpress CD40: CD154 hyperinduces IL-6, IL-8, and MCP-1[J]. Invest Ophthalmol Vis Sci, 2009, 50: 2262-2268. DOI:10.1167/iovs.08-2328 |
| [19] |
ALLES V V, BOTTAZZI B, PERI G, GOLAY J, INTRONA M, MANTOVANI A. Inducible expression of PTX3, a new member of the pentraxin family, in human mononuclear phagocytes[J]. Blood, 1994, 84: 3483-3493. DOI:10.1182/blood.V84.10.3483.3483 |
 2020, Vol. 41
2020, Vol. 41


