2. 武汉科技大学附属汉阳医院超声科, 武汉 430050
2. Department of Ultrasound, Hanyang Hospital Affiliated to Wuhan University of Science and Technology, Wuhan 430050, Hubei, China
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)是由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染导致的传染性疾病[1],以发热、干咳和乏力为主要表现,重症患者多在发病1周后出现呼吸困难和(或)低氧血症,严重者快速进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、弥散性血管内凝血(disseminated intravascular coagulation,DIC)甚至发生感染性休克[2],最终导致多器官功能衰竭。目前确诊主要依靠SARS-CoV-2核酸检测[3]。由于核酸检测的技术条件要求高,肺部CT检查已作为临床前期筛查疑似患者的必备影像学项目。然而在隔离重症监护区,当患者行动不便、CT检查受限、医师在三级防护的情况下听诊器使用不便时,超声是唯一能进入隔离区进行床旁检查的可视化设备。超声检查具有动态、实时、无创、无辐射、可重复、便携等独特优势,Narula等[4]提倡将超声作为除视、触、叩、听外的第5项临床首诊检查手段,以更好地满足现代化诊疗需求。临床实践证明,超声可作为有力的影像学手段尽快筛选出疑似患者,实时监测危重COVID-19患者的肺部病变,并可同步完成心脏、血管及其他脏器(肝、肾等)的整体联合评估,为COVID-19诊疗策略的调整提供指导。本文就超声技术在COVID-19患者肺部损伤及全身多脏器疾病诊断、病情监测、治疗评估等方面的应用进展进行总结,并探讨远程超声、超声人工智能在COVID-19中的应用优势。
1 COVID-19的发病特点COVID-19发病时最常见的症状为发热、干咳、乏力等,部分患者可出现腹泻、恶心、呕吐等不典型腹部症状[2, 5]。临床上可将COVID-19分为4型:(1)轻型,未见肺炎表现;(2)普通型,影像学可见肺炎表现;(3)重型,呼吸频率≥30/min、静息状态下指氧饱和度≤93%、动脉血氧分压(arterial partial pressure of oxygen,PaO2)/吸入气氧分数(fraction of inspiration oxygen,FiO2)≤300 mmHg(1 mmHg=0.133 kPa);(4)危重型,出现呼吸衰竭、休克、多器官功能障碍[6]。轻型、普通型一般给予抗病毒、氧疗等对症处理,重型、危重型患者多合并基础疾病,需监测病情综合评估,及时治疗基础疾病、防治并发症,防止病情恶化。
2 肺部超声在COVID-19诊疗中的应用 2.1 COVID-19所致肺炎的超声诊断近20年来关于肺部超声的研究报道日益增多,肺部超声检查已不局限于胸腔积液测量,还广泛应用于肺实质检查、急性呼吸困难病因鉴别、新生儿呼吸窘迫综合征严重程度判断等。Lissaman等[7]对儿童肺炎超声检查与胸部X线片进行对比,认为肺部超声可作为疑似肺炎患者的一线影像学检查方法,因其无辐射、便携、可视化等优势,尤其适用于儿童、孕产妇及危重症患者。由中华医学会超声医学分会、中华医学会呼吸病学分会、中华医学会心血管病学分会心血管病影像学组等共同编写发布的《新型冠状病毒肺炎肺部超声检查及远程诊断实施方案(第一版)》指出,肺部超声可作为有力的影像学手段辅助诊断评估危重COVID-19患者的肺部病变[8]。正常情况下,使用高频线阵探头或低频凸阵探头垂直于肋骨,通过二维超声可观察相邻肋骨及声影间光滑、平整的线性高回声(胸膜线),以及与之平行的间距相等、由浅入深逐渐消失的一系列线性高回声(A线,图 1A);在实时超声下于胸膜线处可见肺滑动征,M型超声正常情况下可获得由胸膜线上方的波浪状线样高回声、胸膜线及胸膜下方由肺滑动征产生的均匀颗粒点状回声构成的超声影像,称为沙滩征(图 1B)。肺部病变超声图像特征包括:出现起始于胸膜线并与之垂直、放射至肺野深部的线形高回声(B线,图 2A),根据累及程度不同可为融合B线、致密B线(白肺),胸膜下出现“肝样变”的肺实变组织(图 2B),与充气肺组织交界区形成高回声反射,形成“碎片征”,大片肺实变可伴有支气管充气/液征或动态支气管充气征。实时超声可观察到接近心脏边缘处肺实变组织随心脏而搏动,称肺搏动征。M型超声示肺滑动征消失,胸膜线下方被一系列平行线代替,称平流层征或条形码征,可见于气胸。另针对COVID-19患者双肺多发、多种病变性质、可同时累及周边及中央等影像学特征[9],建议采用肺超声评分(lung ultrasound score,LUS)定量评估肺炎严重程度及进展情况[10]。肺脏扫查可选择8分区或12分区法进行全面评估,LUS为各检查区域的综合评分。每个区域评分标准:A线存在、零星B线为0分,显示A线、存在间断分布B线为1分,显示A线、存在多发融合状B线为2分,A线消失、致密B线为3分,肺实变为4分。通过肺部超声可清晰显示肺部炎症病灶大小[11],结合LUS能够更全面地为临床诊疗提供依据。
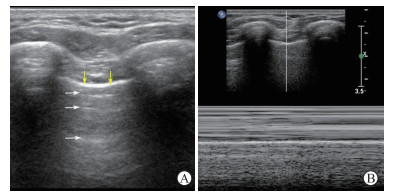
|
图 1 肺部正常二维超声及M型超声特征 图片由海军军医大学(第二军医大学)长征医院超声诊疗科提供.A:二维超声,黄色箭头所示为胸膜线,白色箭头所示为与之平行的一系列A线;B:M型超声示正常肺呈沙滩征 |
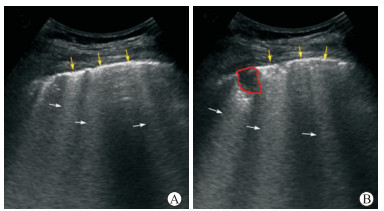
|
图 2 COVID-19重型患者肺部超声表现 图片由武汉科技大学附属汉阳医院超声科提供.A:黄色箭头所示为连续的胸膜线,白色箭头所示为B线;B:红色标注区域为肺部分实变,黄色箭头所示胸膜线可见中断,白色箭头所示为B线.COVID-19:新型冠状病毒肺炎 |
2.2 肺部超声在COVID-19重型患者气管插管、有创机械通气中的指导作用
国家卫生健康委员会印发的《新型冠状病毒肺炎诊疗方案(试行第七版)》中提出,对于重型或危重型患者使用高流量鼻导管氧疗或无创通气后,若短时间内(1~2 h)病情无改善甚至恶化,应及时进行气管插管或有创机械通气[6]。在紧急插管过程中应用气管快速超声检查(tracheal rapid ultrasound exam,T.R.U.E.),通过超声可视化技术显示气道结构、测量气道径线,有利于选择合适通气管径,迅速完成气管插管[12],必要时还可辅助临床进行颈部解剖结构定位、安全快速气管切开,避免意外发生。气管快速超声盐水试验(tracheal rapid ultrasound saline test,T.R.U.S.T.)利用超声可视化技术结合生理盐水灌注气囊[13]来确定气管插管深度,并通过肺部超声对比观察双侧肺搏动征、膈肌活动度等排除插入到一侧支气管内引起对侧肺不张的可能。焦子育等[14]对接受自带声门下吸引装置的气管插管进行机械通气的患者开展研究,证实利用床旁超声可有效显示气管插管气囊上方分泌物,及时清理,避免分泌物吸入下呼吸道,预防呼吸机相关肺炎。膈肌作为主要呼吸肌,是影响机械通气患者成功撤机的主要因素,使用M型超声可准确、定量分析膈肌运动幅度、膈肌收缩速度(膈肌运动幅度/吸气时间)等指标,进而评估患者呼吸运动能力,指导机械通气患者撤机时机,提高撤机的成功率[15]。
3 全身多器官超声联合检查在COVID-19诊疗中的应用 3.1 心脏超声在COVID-19患者心脏损害检查中的应用COVID-19重型患者在治疗过程中可出现心慌、胸闷等心血管系统疾病临床表现,甚至出现心律失常、心力衰竭等[2]。分析其心脏损害原因可能是病毒直接作用及免疫损伤,又或肺部病变缺氧导致肺循环障碍、损害右心系统等。由中华医学会超声医学分会超声心动图学组、中华医学会心血管病学分会心血管病影像学组等共同编写发布的《新型冠状病毒肺炎超声心动图检查及远程诊断实施建议(第一版)》指出,心脏超声可直接观察房室大小、瓣膜结构功能、室壁厚度、节段运动等,测量心率和每搏输出量,评估左、右心室收缩舒张功能[16]。COVID-19患者主要影响部位为右心系统,需动态对比观察肺动脉压力变化及右心大小,如出现肺动脉内径增宽、下腔静脉增宽、右心增大、收缩期室间隔向左心室侧偏移,则认为存在肺动脉高压,动态观察过程中需注意排除左心疾病、右心室流出道梗阻、肺动脉狭窄等其他原因引起的肺动脉高压;肺动脉压测量应结合二维超声表现及血流动力学,必要时可结合肺动脉收缩压、肺动脉舒张末压和肺血管阻力等多个参数综合评价;当出现McConnell征,即右心室心尖出现不同步收缩增强而游离壁运动降低时,需高度关注急性肺栓塞可能;对于怀疑COVID-19合并心肌炎患者,需观察是否存在新出现或不能解释的心室收缩、舒张功能异常,弥漫性室壁运动减低,室间隔或室壁厚度改变、心室壁节段性运动异常,或心包积液等[16]。
此外,研究发现近50%的COVID-19患者合并1种或1种以上基础疾病,如糖尿病、心血管疾病、肿瘤等[5]。利用心脏超声早期评估患者心功能及循环容量等参数,有助于及早发现问题,采取有效的预防和干预措施,降低病情恶化风险。
3.2 血管超声在COVID-19危重型患者容量管理及并发症中的应用对容量状态和容量反应性进行评估是危重症患者容量管理的一项重要内容。超声技术因具有无创、可重复、便携、多项指标同时监测等优势,可以在传统体格检查、实验室检查、静态及动态指标检测的基础上,通过测量下腔静脉内径、计算呼吸变异指数(即吸气塌陷率),快速有效地进行容量评估[17]。(1)低血容量状态:下腔静脉内径缩小(<2 cm)伴吸气塌陷率超过50%;(2)容量负荷过重:下腔静脉内径增宽(>2 cm)伴吸气塌陷率<50%。肺栓塞、肺动脉高压、心包填塞等右心压力增高疾病亦可表现为下腔静脉内径增宽、吸气塌陷率异常,检查过程中需结合心脏超声检查进行排除[16]。值得注意的是,对于机械通气、肥胖、胃肠道积气等患者,推荐利用超声测量多种静脉的直径和吸气塌陷率,包括下腔静脉、锁骨下静脉、上腔静脉、颈内静脉和股静脉,综合多种静脉评估容量反应,判断患者容量是否充足及补液是否适当,提高评估的准确性[18]。
合并有心血管疾病、糖尿病和肿瘤等其他疾病的COVID-19患者发生严重并发症和死亡的风险更高[5],在对症治疗基础上,应积极防治并发症,治疗基础疾病[6]。合并心脑血管基础疾病、体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)挽救治疗过程中患者均可能出现脑出血、脑梗死等并发症[19-20]。经颅多普勒(transcranial Doppler,TCD)超声可获取颅内主要动脉的血流参数频谱形态,评估COVID-19危重型患者颅内压(intracranial pressure,ICP)变化情况,当ICP增高时颅内血管(大脑中动脉、大脑前动脉、大脑后动脉等)血流频谱发生特征性改变,收缩期峰值血流速度(systolic blood flow velocity,FVs)增高、舒张期末血流速度(diastolic blood flow velocity,FVd)降低、搏动指数(pulsatility index,PI)升高。目前,临床上常用TCD超声基于PI多参数建模定量评估ICP,其经典模型无创颅内压(non-invasive intracranial pressure,nICP)=4.47×PI+12.68,评估误差范围为±4.2 mmHg[21]。TCD超声联合颈部血管超声检查可排查大脑椎-基底动脉供血不足、椎动脉盗血等疾病[22],联合下肢血管超声检查可评估糖尿病患者肢体远端微循环灌注情况[23]。有病例报告显示,重症COVID-19患者具有并发急性肺栓塞的风险[24]。发生肺栓塞的危险因素较多,如年龄(>50岁)、肥胖、下肢静脉曲张、腹盆腔手术病史等,其中深静脉血栓(deep venous thrombosis,DVT)是其发生的独立危险因素[25]。DVT确诊首选下肢静脉血管超声检查,存在多个危险因素时,扫查时应包括肌间静脉并进行抗凝治疗[26]。下肢血管超声联合心脏超声右心系统参数及右心系统血栓重点筛查,结合心电图、实验室检查(D-二聚体、脑钠肽、动脉血气分析)综合判断,有助于评估重症COVID-19患者肺栓塞风险。
3.3 超声在COVID-19患者其他脏器检查中的应用研究显示,COVID-19患者可在发病初期出现发热症状前即出现腹痛、腹泻、恶心、呕吐等消化道症状,而呼吸道症状不典型,随着疾病的进展,患者的血尿素氮和肌酐水平迅速增高,可出现严重的急性肾损伤[2, 5]。利用超声可观察胃内容物残余量、是否存在肠胀气、肠扩张、肠壁回声减低等,有助于判断胃肠功能;通过动态观察肾脏大小、实质回声变化及血流充盈情况,可判断肾脏损害程度及预测肾脏功能可复性。目前虽无证据表明SARS-CoV-2可经过宫内垂直传播对胎儿产生不良影响,但针对SARS-CoV-2感染的孕妇这一特殊人群,定期进行安全、简单、无辐射的超声检查结合其他产前筛查,可全面评估宫内胎儿生长发育情况。
4 信息网络支持下的超声新技术在COVID-19诊疗中的尝试 4.1 远程超声的应用远程超声技术由美国国家航空航天局(National Aeronautics and Space Administration,NASA)首次提出并用于宇航员太空检查,作为国际宇宙空间站唯一可用的医学影像技术,能够将仅经短时间理论、操作学习的宇航员所采集的超声图像实时传输到地面,由地面医师给出临床指导和康复建议[27]。在目前疫情发展迅速、全国专家数量有限、一线影像资源受地域限制的情况下,可在隔离病房内配备可搭载基于4G/5G互联网的远程超声诊断技术的便携式超声仪,一线超声医师使用该超声设备登录诊断云平台,向各地专家发送会诊请求,随后对患者进行扫查;与此同时,超声专家采用移动互联网设备(手机或计算机)登录云平台,与隔离病房内超声医师实现检查互联和实时互动,进行实时诊断指导。还可通过云平台建立超声专家会诊群组,组织超声各亚专业学组的专家进行远程交流讨论疑难病例,实现多学科远程专家会诊[8, 16]。
4.2 超声机器人的应用远程超声的应用在一定程度上缓解了抗击疫情一线超声医疗资源的紧张,但尚存在一些不足:一线超声医师在扫查时难以避免与患者直接接触,增加了感染机会,提高了重复暴露和交叉感染风险;有的一线超声医师经验不足、手法不熟练,采集的图像不能达到专家要求;疫情一线或偏远地区缺少相关亚专业超声医师等。随着机械臂技术的飞速发展,利用实时远程超声机器人技术[28]将机器人装置和上述远程5G传输技术相结合,即可实现医患无接触式的异地超声检查。在隔离病房内放置机械臂装置,在机械臂前端安装常规超声探头,调整探头位置、方向和倾斜角度,模拟远程端医师的手持探头习惯以适应检查,同时在机械臂后端配置语音通话装置,以便医师嘱咐患者做配合动作、变动体位。操作医师通过虚拟操作杆远程遥控机械臂扫查患者,实时、动态采集图像并给出诊断建议。由于此前国内应用远程超声机器人技术的病例有限,且感染病房内机械臂装置消毒程序烦琐,COVID-19疫情中应用5G远程超声机器人的稳定性及普适性有待进一步论证。
4.3 其他超声人工智能工具超声相比于高分辨率CT具有便携、实时、无辐射等优点,且是唯一可以进入隔离区和重症病房进行床旁检查的可视化装备,在COVID-19疫情防治中被广泛认可。LUS评估B线、胸膜线高度灵敏,对肺间质综合征能够快速诊断,但尚不能准确定量,且疫情一线超声医师对肺部超声诊断经验不一,判读准确率有限。随着人工智能技术的迅速发展,借助计算机手段辅助超声影像获得了客观可靠的判读结果[29]。Raso等[30]已着手研发针对于肺部超声B线的自动检测分析软件,研究结果表明,基于软件计算的B线分析能够客观地对肺水肿和肺纤维化程度进行分类,具有很高的准确率和定量可行性。今后可借鉴开发一种基于B线自动分析系统的便携式超声设备,用于肺间质水肿或纤维化的个体化自动检测,获取可靠的量化指标,提高超声对各类肺损伤疾病的诊断准确率。
5 小结本文从COVID-19肺部、心脏等多脏器超声检查及危重型患者呼吸、循环管理监测等方面总结了超声技术的应用情况,并展望了远程超声专家会诊、超声机器人与超声人工智能在此种烈性传染病诊疗中的应用前景和可行性,旨在为抗疫一线临床诊疗提供更多思路。针对COVID-19疫情全面拓展超声技术的应用领域也对超声人才的综合素质培养目标提出了更高要求,超声医师在深入学习实践某一超声亚专业的同时,还应全面掌握其他超声亚专业的关键技术,并加强人工智能相关技术的学习。
| [1] |
World Health Organization. WHO Director-General's remarks at the media briefing on 2019-nCoV on 11 February 2020[EB/OL]. (2020-02-11)[2020-03-03]. https://www.who.int/dg/speeches/detail/who-director-general-s-remarks-at-the-media-briefing-on-2019-ncov-on-11-february-2020.
|
| [2] |
HUANG C, WANG Y, LI X, REN L, ZHAO J, HU Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395: 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [3] |
LI Z, YI Y, LUO X, XIONG N, LIU Y, LI S, et al. Development and clinical application of a rapid IgM-IgG combined antibody test for SARS-CoV-2 infection diagnosis[J/OL]. J Med Virol, 2020. doi: 10.1002/jmv.25727.
|
| [4] |
NARULA J, CHANDRASHEKHAR Y, BRAUNWALD E. Time to add a fifth pillar to bedside physical examination: inspection, palpation, percussion, auscultation, and insonation[J]. JAMA Cardiol, 2018, 3: 346-350. DOI:10.1001/jamacardio.2018.0001 |
| [5] |
WANG D, HU B, HU C, ZHU F, LIU X, ZHANG J, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China[J/OL]. JAMA, 2020. doi: 10.1001/jama.2020.1585.
|
| [6] |
中华人民共和国国家卫生健康委员会.关于印发新型冠状病毒肺炎诊疗方案(试行第七版)的通知[EB/OL].(2020-03-04)[2020-04-03]. http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7dfe4cef80dc7f5912eb1989.shtml.
|
| [7] |
LISSAMAN C, KANJANAUPTOM P, ONG C, TESSARO M, LONG E, O'BRIEN A. Prospective observational study of point-of-care ultrasound for diagnosing pneumonia[J]. Arch Dis Child, 2019, 104: 12-18. DOI:10.1136/archdischild-2017-314496 |
| [8] |
中华医学会超声医学分会, 中华医学会呼吸病学分会, 中华医学会心血管病学分会心血管病影像学组, 中国医药教育协会超声医学专业委员会, 四川省超声医学质量控制中心.新型冠状病毒肺炎肺部超声检查及远程诊断实施方案(第一版)[J/OL].中华医学超声杂志(电子版), 2020, 17: E001.doi: 10.3877/cma.j.issn.1672-6448.2020.0001.
|
| [9] |
龚晓明, 李航, 宋璐, 李莉, 张笑春, 余开湖, 等. 新型冠状病毒肺炎(COVID-19) CT表现初步探讨[J]. 放射学实践, 2020, 35: 261-265. |
| [10] |
张斌, 吴秀, 曹薇, 王胜昱. 肺部超声评分在呼吸重症疾病中的应用[J]. 中国呼吸与危重监护杂志, 2019, 18: 93-97. |
| [11] |
徐程, 梁桂文, 蒋海, 丁俊华, 黄中伟, 祁雷. 床旁肺超声在肺部感染灶解剖定位及大小判断中的应用[J]. 解剖学报, 2019, 50: 786-790. |
| [12] |
CHOU H C, TSENG W P, WANG C H, MA M H, WANG H P, HUANG P C, et al. Tracheal rapid ultrasound exam (T.R.U.E) for confirming endotracheal tube placement during emergency intubation[J]. Resuscitation, 2011, 82: 1279-1284. DOI:10.1016/j.resuscitation.2011.05.016 |
| [13] |
TESSARO M O, SALANT E P, ARROYO A C, HAINES L E, DICKMAN E. Tracheal rapid ultrasound saline test (T.R.U.S.T.) for confirming correct endotracheal tube depth in children[J]. Resuscitation, 2015, 89: 8-12. DOI:10.1016/j.resuscitation.2014.08.033 |
| [14] |
焦子育, 罗渝昆, 闫鹏, 宋青, 张颖, 徐建桥. 床旁超声在气管插管气囊上方分泌物探查中的应用研究[J]. 中华医学超声杂志(电子版), 2019, 16: 927-930. DOI:10.3877/cma.j.issn.1672-6448.2019.12.008 |
| [15] |
易欣, 高虹, 郭峻梅, 李雪娇, 樊伟, 刘乔建. 超声测量膈肌运动的临床价值[J]. 影像研究与医学应用, 2019, 3: 241-242. |
| [16] |
中华医学会超声医学分会超声心动图学组, 中华医学会心血管病学分会心血管影像学组, 中国医药教育协会超声医学专业委员会, 四川省超声医学质量控制中心.新型冠状病毒肺炎床旁超声心动图检查及远程诊断实施建议(第一版)[J/OL].中华医学超声杂志(电子版), 2020, 17: E006.doi: 10.3877/cma.j.issn.1672-6448.2020.0006.
|
| [17] |
周梅. 容量状态及容量反应性评估指标、技术的研究进展[J]. 山东医药, 2019, 59: 111-114. |
| [18] |
程志, 张小宝, 冯继英, 刘金东, 赵志斌. 超声测量静脉内径和变异率应用于容量评估的研究进展[J]. 国际麻醉学与复苏杂志, 2018, 39: 230-238. DOI:10.3760/cma.j.issn.1673-4378.2018.03.008 |
| [19] |
任剑, 周红军, 冀建文, 沈光建, 张云东. 原发性脑干出血患者死亡危险因素分析[J]. 中国神经精神疾病杂志, 2019, 45: 744-747. DOI:10.3969/j.issn.1002-0152.2019.12.009 |
| [20] |
黑飞龙, 龙村, 于坤. 体外膜肺氧合并发症研究[J]. 中华体外循环杂志, 2005, 3: 243-245. |
| [21] |
韩帅, 李文臣, 王海峰, 别黎. 基于TCD脑血流频谱评估颅脑损伤患者颅内压的研究进展[J]. 中华神经创伤外科电子杂志, 2020, 6: 53-56. DOI:10.3877/cma.j.issn.2095-9141.2020.01.013 |
| [22] |
何冬若, 李卉, 韩国超, 王余广, 于海明, 刘洋, 等. 颈动脉超声联合经颅多普勒超声检测颈外动脉和颈内动脉窃血[J]. 中华老年心脑血管病杂志, 2019, 21: 1253-1255. DOI:10.3969/j.issn.1009-0126.2019.12.006 |
| [23] |
候贺翔, 李利, 姚克纯, 赵国政, 刘淑萍. 超声对Ⅱ型糖尿病下肢动脉病变相关测量的新指标[J]. 中国超声医学杂志, 2017, 33: 459-462. DOI:10.3969/j.issn.1002-0101.2017.05.027 |
| [24] |
邹文彬, 宋斌, 吴晓伟. 重症新型冠状病毒肺炎并发急性肺栓塞1例报告并文献复习[J]. 武汉大学学报(医学版), 2020, 41: 369-372. |
| [25] |
王行海. 急性下肢深静脉血栓患者发生无症状肺栓塞影响因素研究[J]. 西南国防医药, 2016, 26: 720-723. DOI:10.3969/j.issn.1004-0188.2016.07.009 |
| [26] |
SCHWARZ T, BUSCHMANN L, BEYER J, HALBRITTER K, RASTAN A, SCHELLONG S. Therapy of isolated calf muscle veinthrombosis: a randomized, controlled study[J]. J Vasc Surg, 2010, 52: 1246-1250. DOI:10.1016/j.jvs.2010.05.094 |
| [27] |
FINCKE E M, PADALKA G, LEE D, VAN HOLSBEECK M, SARGSYAN A E, HAMILTON D R, et al. Evaluation of shoulder integrity in space: first report of musculoskeletal US on the International Space Station[J]. Radiology, 2005, 234: 319-322. DOI:10.1148/radiol.2342041680 |
| [28] |
DELGORGE C, COURRÈGES F, AL BASSIT L, NOVALES C, ROSENBERGER C, SMITH-GUERIN N, et al. A tele-operated mobile ultrasound scanner using a light-weight robot[J]. IEEE Trans Inf Technol Biomed, 2005, 9: 50-58. DOI:10.1109/TITB.2004.840062 |
| [29] |
赵佳琦, 刁宗平, 徐琪, 章建全. 人工智能时代超声医学新发展[J]. 第二军医大学学报, 2019, 40: 478-482. ZHAO J Q, DIAO Z P, XU Q, ZHANG J Q. New development of ultrasound medicine in the era of artificial intelligence[J]. Acad J Sec Mil Med Univ, 2019, 40: 478-482. |
| [30] |
RASO R, TARTARISCO G, MATUCCI CERINIC M, PIOGGIA G, PICANO E, GARGANI L. A soft computing-based B-line analysis for objective classification of severity of pulmonary edema and fibrosis[J]. JACC Cardiovasc Imaging, 2015, 8: 495-496. DOI:10.1016/j.jcmg.2014.06.022 |
 2020, Vol. 41
2020, Vol. 41


