心血管疾病是致死率和致残率最高的疾病之一,严重危害着人类健康[1]。血管内皮细胞不仅能阻断血液与血管壁的直接接触,而且具有分泌血管活性物质、血管保护因子及血管生长因子等生物活性因子的功能[2-4]。血管内皮细胞受损会引起高血压、心力衰竭及动脉粥样硬化等心脑血管疾病的发生,这些疾病也会加重血管内皮的损伤[5-7],因此研发血管内皮细胞保护类药物已成为治疗心脑血管疾病的研究热点之一[8]。
卡托普利是临床常用的降压药,可通过抑制血管紧张素转化酶(angiotensin-converting enzyme,ACE)活性、降低醛固酮分泌等降低血压,具有间接的血管内皮细胞保护活性[9]。卡托普利具有毒性低、安全性高及药代动力学性质明确等众多优势,其结构主要由脯氨酸、侧链甲基和巯基丙酰胺骨架3个部分组成,以其为先导物进行结构改造的空间较大且化学合成难度相对较低。因此,我们选择从卡托普利出发研发新型血管内皮细胞保护类药物。
鉴于巯基在生物体的组成、生物活性及药物代谢方面的重要作用[10-11],并基于卡托普利结构上的巯基丙酰胺核心骨架,本研究选择从先导物卡托普利结构中的脯氨酸进行结构改造,再进行二聚化,设计并合成了一系列二硫代二丙酰胺类衍生物,通过体外血管内皮细胞保护活性实验考察其对氧化诱导损伤的血管内皮细胞的保护活性,旨在发现全新结构的血管内皮细胞保护剂。
1 仪器和试剂合成所用试剂均为国药集团化学试剂有限公司或上海毕得医药科技有限公司生产的分析纯或化学纯试剂,GF254薄层色谱分析硅胶板和柱层析硅胶为青岛海洋化工有限公司生产。核磁共振波谱(1HNMR、13CNMR)用Bruker AC-300P或Bruker AC-600P型核磁共振仪测试,溶剂为DMSO-d6或氯仿(CDCl3),内标为四甲基硅烷。采用Agilent 6538 UHD Accurate-Mass Q-TOF LC/MS质谱仪进行电喷雾电离质谱分析(electrospray ionization-mass spectrometry,ESI-MS)。人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)购于中国科学院上海细胞库。DMEM培养液、过氧化氢(H2O2)和卡托普利(纯度≥ 98%)均购于美国Sigma公司。
2 方法和结果 2.1 目标化合物的合成以甲基丙烯酸(1)和硫代乙酸为起始原料,经Michael加成生成中间体2,再与不同的芳香苄胺缩合生成中间体3a~3e,最后用NaOH水解脱除酯基,得到目标化合物4a~4e,具体的合成路线如图 1所示。
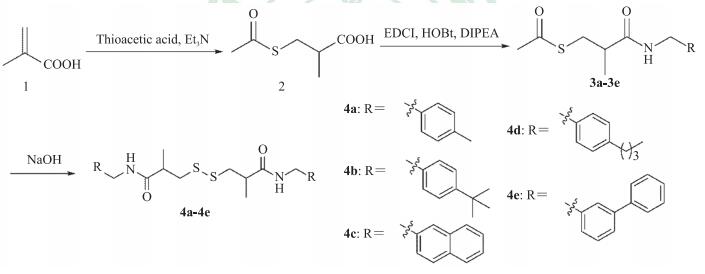
|
图 1 目标化合物4a~4e的合成路线 Fig 1 Synthesis of target compounds 4a-4e Et3N: Triaethylamin; EDCI: N-(3-dimethylaminopropyl)-N'-ethylcarbodiimide hydrochloride; HOBt: 1-Hydroxybenzotriazole; DIPEA: N, N-diisopropylethylamine |
2.1.1 3-乙酰硫基-2-甲基丙酸(2)的制备
将甲基丙烯酸3.0 g(34.87 mmol)溶于50 mL无水二氯甲烷,加入催化量三乙胺,然后在氮气保护、室温、搅拌条件下滴加溶于50 mL无水二氯甲烷的硫代乙酸5.3 g(69.63 mmol),室温搅拌反应15 h,后减压蒸除硫代乙酸和有机溶剂,得到3.8 g淡黄色固体粗品中间体2。
2.1.2 S -(2-甲基-3-(4-甲基苄基氨基)-3-氧代丙基)乙硫醇酸酯(3a)的制备称取1.0 g(6.17 mmol)粗品2、1.8 g(9.26 mmol)1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐、1.25 g(9.26 mmol)1-羟基苯并三唑、1.5 mL N, N -二异丙基乙胺及1.5 g(12.34 mmol)4-甲基苄胺溶于40 mL无水二氯甲烷,在氮气保护、室温下搅拌反应过夜。反应完成后,向反应液中加入50 mL二氯甲烷,再依次用5%柠檬酸洗2次、饱和NaCl溶液洗1次,无水硫酸钠干燥后减压蒸除有机溶剂,硅胶柱分离(石油醚:乙酸乙酯= 10:1)得白色固体1.1 g(4.15 mmol),两步收率45%。1HNMR(400 MHz,CDCl3)化学位移:7.13(q,J= 8.1 Hz,4H),5.81(s,1H),4.38(d,J= 5.5 Hz,2H),3.08(dd,J= 13.6、7.7 Hz,1H),2.82(dd,J= 13.6、6.2 Hz,1H),2.40(dd,J= 13.8、7.0 Hz,1H),2.29(d,J= 10.5 Hz,6H),1.19(d,J= 7.0 Hz,3H)。
中间体3b~3e均参照化合物3a合成方法合成。
2.1.3 3, 3’-二硫(2-甲基-N-(4-甲基苄基)丙酰胺)(4a)的制备称取0.9 g(3.4 mmol)中间体3a溶于5 mL四氢呋喃,加入3 mol/L NaOH水溶液30 mL,室温搅拌反应6 h后加入2 mol/L硫酸调节pH至6 ~ 7,二氯甲烷萃取3次,合并有机层,无水硫酸钠干燥,减压蒸除有机溶剂,硅胶柱分离(石油醚:乙酸乙酯= 5:1),得到目标化合物4a,收率69%。1HNMR(400 MHz,CDCl3)化学位移:7.16(d,J= 8.0 Hz,4H),7.13(d,J= 8.0 Hz,4H),6.52(s,1 H),6.42(s,1H),4.24 ~ 4.42(m,4H),2.94 ~ 3.12(m,2H),2.53 ~ 2.72(m,4H),2.30(s,6H),1.20(d,J= 6.5 Hz,3H),1.14(d,J= 6.8 Hz,3H)。13CNMR(150 MHz,CDCl3)化学位移:173.95,136.48,134.50,128.67,127.17,42.71,41.25,40.38,39.55,20.45,16.74,16.45。ESI-MS(m/z):445.2(M + H)+。C24 H32N2O2S2[M + H]+计算值为445.197 8,实测值为445.198 0。
其他目标化合物4b~4e均参照4a合成方法合成。
2.1.4 3, 3’-二硫(N-(4-叔丁基苄基)-2-甲基丙酰胺)(4b)的结构鉴定白色固体,收率75%。1HNMR(400 MHz,CDCl3)化学位移:7.25(d,J= 8.0 Hz,4H),7.13(d,J= 8.0 Hz,4H),6.55(s,1H),6.39(s,1H),4.25 ~ 4.33(m,4H),3.03(s,1H),2.89(s,1H),2.60(d,J= 8.5 Hz,4H),1.21 ~ 1.30(m,18H),1.05(d,J= 8.0 Hz,3H),1.03(d,J=8.0 Hz,3H)。13CNMR(150 MHz,CDCl3)化学位移:174.00,149.82,134.49,126.94,124.93,42.61,41.34,40.38,39.52,33.87,30.72,16.83,16.47。ESI-MS(m/z):529.2(M + H)+。C30H44N2O2S2 [M + H] +计算值为529.291 7,实测值为529.292 1。
2.1.5 3, 3’-二硫(2-甲基-N-(萘-2-基甲基)丙酰胺)(4c)的结构鉴定白色固体,收率82%。1 HNMR(400 MHz,DMSO-d 6)化学位移:8.62(s,2H),7.74 ~ 7.90(m,8H),7.41 ~ 7.50(m,6H),4.51(s,4H),2.77 ~ 2.99(m,6H),1.12(d,J= 8.4 Hz,6H)。13CNMR(150 MHz,CDCl3)化学位移:173.75,136.91,132.69,131.89,127.70,127.35,127.27,126.01,125.60,125.45,125.00,42.02,41.92,39.87,17.51。ESI-MS(m/z):517.2(M + H)+。C30H32N2O2S2[M + H]+计算值为517.197 8,实测值为517.198 1。
2.1.6 3, 3’-二硫(N-(4-丁基苄基)-2-甲基丙酰胺)(4d)的结构鉴定白色固体,收率77%。1HNMR(400 MHz,CDCl3)化学位移:7.08 ~ 7.17(m,8H),6.76(s,1H),6.58(s,1H),4.35(s,4H),3.08(dd,J= 10.2、7.8 Hz,1H),2.94(dd,J= 10.7、7.9 Hz,1H),2.63 ~ 2.79(m,8H),1.53 ~ 1.59(m,4H),1.30 ~ 1.34(m,4H),1.18(d,J= 6.1 Hz,3H),1.11(d,J= 6.6 Hz,3H),0.91(t,J= 7.3 Hz,6H)。13CNMR(150 MHz,CDCl3)化学位移:174.07,141.51,128.01,127.11,42.68,41.31,40.32,39.44,34.65,33.02,21.73,16.81,16.48,13.33。ESI-MS(m/z):529.2(M + H)+。C 30H44N2O2S2[M + H]+计算值为529.291 7,实测值为529.293 2。
2.1.7 3, 3’-二硫(N-([1, 1’-联苯]-3-基甲基)-2-甲基丙酰胺)(4e)的结构鉴定白色固体,收率83%。1HNMR(400 MHz,CDCl3)化学位移:7.54(t,J= 7.0 Hz,4H),7.49(s,1H),7.38 ~ 7.47(m,7H),7.33(q,J= 6.7 Hz,4H),7.16 ~ 7.26(m,2H),6.73(d,J= 5.3 Hz,1H),6.56(s,1H),4.44(s,4H),2.91 ~ 3.10(m,2H),2.51 ~ 2.68(m,4H),1.17(d,J= 6.3 Hz,3H),1.06(d,J= 6.8 Hz,3H)。13CNMR(150 MHz,CDCl3)化学位移:174.17,140.91,140.13,138.10,128.44,128.17,126.82,126.50,126.00,125.82,125.55,42.88,41.28,40.49,39.50,16.82,16.48。ESI-MS(m/z):569.2(M + H)+。C34H36N2O2S2[M + H]+计算值为569.229 1,实测值为569.229 5。
2.2 不同浓度H2O2对HUVEC活力的影响分别取100、200、400、600、800 μmol/L浓度H2O2溶液处理HUVEC,3 h后观察细胞形态,利用CCK-8法测定细胞存活率(n= 3),结果分别为(94.15 ± 1.87)%、(81.48 ± 3.49)%、(63.88 ± 2.86)%、(42.17 ± 6.45)%、(13.35 ± 1.13)%,空白对照组细胞存活率为(100.00 ± 2.34)%。当H2O2溶液浓度为100 μmol/L或200 μmol/L时,HUVEC有一定损伤;H2O2溶液浓度提高至400 μmol/L时,细胞存活率约65%,显微镜下观察到细胞开始收缩变圆并出现部分脱落等现象;继续提高H2O2溶液的浓度至600 μmol/L或800 μmol/L,细胞存活率均大幅度降低,显微镜下观察到细胞出现大面积损伤破裂和大片的脱落。综上分析,选取400 μmol/L的H2O2溶液处理3 h建立氧化诱导损伤细胞模型。
2.3 目标化合物对氧化诱导损伤HUVEC的保护活性取处于对数生长期的HUVEC接种于96孔板,随机分成4组:正常对照组,常规培养;H2O2诱导损伤模型组,常规培养24 h后换成含400 μmol/L的H2O2培养液处理3 h;阳性对照组,在含100 μmol/L卡托普利的培养液中培养24 h后,换成含400 μmol/L的H2O2培养液处理3 h;给药组,在含100 μmol/L或200 μmol/L目标化合物的培养液中培养24 h后,换成含400 μmol/L的H2O2培养液处理3 h。用CCK-8法测定细胞存活率,结果见表 1。目标化合物4a、4b、4d和4e对氧化诱导损伤的HUVEC均有不同程度的保护活性。其中化合物4e的保护活性最优,相对于H2O2处理的模型组,经100 μmol/L与200 μmol/L的化合物4e保护后,细胞存活率分别提高了22.16%和14.43%。
|
|
表 1 目标化合物对氧化诱导损伤HUVEC的保护活性 Tab 1 Protective activity of target compounds on oxidative damage of HUVECs |
3 讨论
血管内皮细胞损伤引起的血管内皮功能障碍是心脑血管疾病发生的始发因素和关键环节,研发血管内皮细胞保护类药物是治疗心脑血管疾病的重要策略和研究热点之一。本研究从老药卡托普利出发,以一种简便、高效的方法合成了5个二硫代二丙酰胺类衍生物。生物活性测试结果显示,除化合物4c外4个目标化合物均表现出不同程度的血管内皮细胞保护活性,尤其是化合物4e对氧化诱导损伤血管内皮细胞具有最优保护活性,值得进一步研究。此外,通过分析目标化合物的结构与生物活性结果可初步得到以下构效关系:对比目标化合物4a、4b、4d和4e与先导化合物卡托普利,可发现脯氨酸替换成4-甲基苄胺及4-叔丁基苄胺等结构并进行二聚化有助于活性的改善;化合物4c无血管内皮细胞保护活性,说明不适合选取2-萘甲胺替代脯氨酸;相对于化合物4a、4b、4d,化合物4e的保护活性更优,表明在苄胺的苯环上引入苯基比烷基活性更优。综上所述,本研究发现了新型二硫代二丙酰胺类的血管内皮细胞保护剂,并获得了对氧化诱导损伤血管内皮细胞具有较高保护活性的化合物4e,但其作用机制以及药代动力学性质有待进一步研究。
| [1] |
陈伟伟, 高润霖, 刘力生, 朱曼璐, 王文, 王拥军, 等. 《中国心血管病报告2017》概要[J]. 中国循环杂志, 2018, 33: 1-8. |
| [2] |
CAHILL P A, REDMOND E M. Vascular endothelium- gatekeeper of vessel health[J]. Atherosclerosis, 2016, 248: 97-109. DOI:10.1016/j.atherosclerosis.2016.03.007 |
| [3] |
XU F, LIU Y, ZHU X, LI S, SHI X, LI Z, et al. Protective effects and mechanisms of vaccarin on vascular endothelial dysfunction in diabetic angiopathy[J/OL]. Int J Mol Sci, 2019, 20:E4587. doi: 10.3390/ijms20184587.
|
| [4] |
KRÜGER-GENGE A, BLOCKI A, FRANKE R P, JUNG F. Vascular endothelial cell biology:an update[J]. Int J Mol Sci, 2019, 20: E4411. DOI:10.3390/ijms20184411 |
| [5] |
DAVIGNON J, GANZ P. Role of endothelial dysfunction in atherosclerosis[J]. Circulation, 2004, 109(23 Suppl 1): Ⅲ 27-Ⅲ 32. |
| [6] |
FÉLÉTOU M. Endothelium-dependent hyperpolarization and endothelial dysfunction[J]. J Cardiovasc Pharmacol, 2016, 67: 373-387. DOI:10.1097/FJC.0000000000000346 |
| [7] |
LEVINE A B, PUNIHAOLE D, LEVINE T B. Characterization of the role of nitric oxide and its clinical applications[J]. Cardiology, 2012, 122: 55-68. DOI:10.1159/000338150 |
| [8] |
CHATZIZISIS Y S, COSKUN A U, JONAS M, EDELMAN E R, FELDMAN C L, STONE P H. Role of endothelial shear stress in the natural history of coronary atherosclerosis and vascular remodeling:molecular, cellular, and vascular behavior[J]. J Am Coll Cardiol, 2007, 49: 2379-2393. DOI:10.1016/j.jacc.2007.02.059 |
| [9] |
GAVRAS H, BRUNNER H R. Role of angiotensin and its inhibition in hypertension, ischemic heart disease, and heart failure[J]. Hypertension, 2001, 37(2 Pt 2): 342-345. |
| [10] |
WINTERBOURN C C, HAMPTON M B. Thiol chemistry and specificity in redox signaling[J]. Free Radic Biol Med, 2008, 45: 549-561. DOI:10.1016/j.freeradbiomed.2008.05.004 |
| [11] |
张力文, 尚中博, 常志显, 祁志冲, 李德亮. 巯基检测方法研究进展[J]. 河南大学学报(自然科学版), 2018, 48: 430-443. |
 2020, Vol. 41
2020, Vol. 41


