2. 海军军医大学(第二军医大学)长海医院神经内科, 上海 200433
2. Department of Neurology, Changhai Hospital, Naval Medical University (Second Military Medical University), Shanghai 200433, China
患者女,52岁,因“反复上腹部疼痛半年”于2018年6月14日入住海军军医大学(第二军医大学)长海医院消化科。患者自2017年12月起无明确诱因下出现上腹部疼痛,无恶心、呕吐,无呕血、黑便,无发热,至当地医院住院治疗,考虑急性胰腺炎发作,给予对症处理后症状好转出院。近半年患者反复出现上腹部疼痛,按胰腺炎治疗共4次。2018年5月至长海医院消化科门诊就诊,胰腺增强CT检查示胰腺体部占位、胰腺周围渗出、淋巴结肿大;胃镜检查提示反流性食管炎、贲门炎、慢性萎缩性胃炎、十二指肠球炎;胃活组织检查病理结果示慢性萎缩性胃炎、中度肠腺化生。同月复查胰腺增强CT,提示急性胰腺炎伴胰腺假性囊肿形成,周围淋巴结增大、胆管炎。2018年6月上消化道造影提示胃炎、十二指肠球部溃疡,胃占位性病变待排除。6月14日消化科门诊以“胰腺占位待查”收入院。入院后体格检查:一般状态可,上腹部触压时有不适感,未触及明显包块,肝脾肋下未及,Murphy征阴性,双肾区无叩痛。6月15日,在全身麻醉下行超声内镜引导下细针穿刺术。术中胃、十二指肠未见明显异常。超声所见:胰头部一低回声区,截面大小4.7 cm × 3.8 cm,边界欠清,内部回声不均匀,可见散在点状高回声改变,上游胰管扩张,直径约0.5 cm,胆总管及肝内胆管不扩张,胆总管直径约0.8 cm,胰尾周围可见一大小0.7 cm × 0.3 cm的淋巴结。于实时超声内镜引导下用COOK-ECHO-3-22内镜超声专用穿刺针刺入胰腺低回声病灶内,第1针在5 mL负压下反复提插15次,抽出组织2条;第2针在5 mL负压下反复提插15次,抽出少许组织碎屑;第3针在5 mL负压下反复提插15次,抽出组织2条。拔出穿刺针,穿刺点无渗血。手术顺利,术后患者安返病房。给予禁食、抑酶、抗酸、止血、抗感染、输液支持治疗,并监测血淀粉酶。术后3 h血淀粉酶为84 U/L;次日清晨血淀粉酶为47 U/L,血红蛋白103 g/L。6月16日(术后第1天)患者神志清楚、精神较差,生命体征平稳,腹部柔软,上腹部触压有不适感,肠鸣音正常,恢复半流质饮食。6月17日(术后第2天),患者仍精神差,别无特殊。6月18日,患者生命体征平稳,诉食欲差、乏力、肢体疲软、无呕吐,给予补充电解质。6月21日,患者精神更差,诉四肢麻木,全身乏力明显,进行性加重,伴有头晕、耳鸣、胸闷、吞咽困难、偶有呛咳、并有视物重影。体格检查;四肢肌张力低下,右上肢肌力3级,其余三肢肌力均2级;双侧肱二头肌反射、双侧膝跳反射消失;四肢肌肉压痛;双侧Babinski征阴性。同日,经鼻-胃-十二指肠置入营养管。神经科医师会诊考虑急性吉兰-巴雷综合征、肌炎、重症肌无力、甚至脑干脑炎等疾病可能。6月22日腰椎穿刺查脑脊液,脑脊液葡萄糖0.1 mmol/L,总蛋白0.01 g/L,腺苷脱氨酶1 U/L,细胞总数480 × 10 9 /L,有核细胞数2 × 10 9 /L。6月22日、23日头颅MRI及脑干薄层MRI增强检查均提示第三脑室周围及四叠体区异常信号(图 1),考虑B族维生素缺乏所致脑病。于6月22日开始肌内注射维生素B1针剂100 mg,每天2次。6月26日血肌酐38 μmol/L,血清白蛋白28 g/L,血清维生素B1测定值49.064 nmol/L(正常值48.440 ~ 120.580 nmol/L)。为进一步诊治周围神经病,于6月29日转入神经内科治疗。
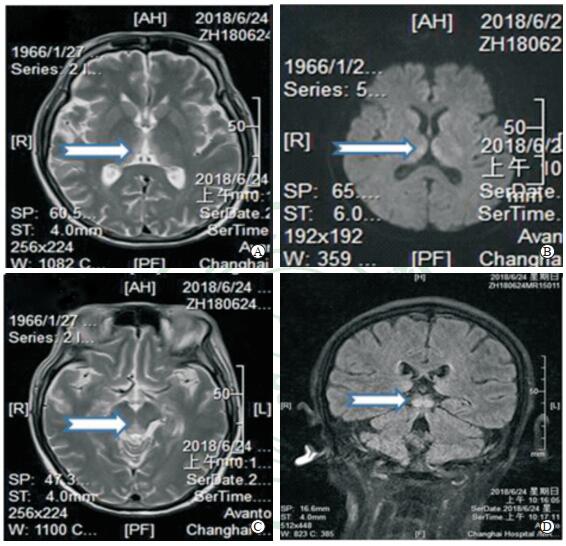
|
图 1 头颅磁共振及脑干薄层磁共振增强扫描影像 A:头颅磁共振T2加权像显示双侧丘脑高信号(箭头所示);B:扩散加权成像显示丘脑内侧高信号;C:头颅磁共振T2加权像显示四叠体下丘高信号(箭头所示);D:扩散加权成像显示四叠体下丘高信号(箭头所示) |
入神经内科后体格检查:神志清楚,但计算、思维能力下降;双眼球各向运动自如,有水平型眼震,双侧闭目有力,伸舌居中,四肢肌张力低,双上肢肌力3级,双下肢肌力2级;四肢深、浅感觉均有减退;双侧肱二头肌反射和膝跳反射消失,双侧Babinski征阴性;脐部以下膨隆,叩诊呈浊音,系尿潴留,遂予留置导尿管。6月29日血液学检查提示:血红蛋白68 g/L,血肌酐170 μmol/L,血钾6.1 mmol/L。入神经内科后立即给予维生素B1针剂100 mg肌内注射、每天2次,甲钴胺0.5 mg肌内注射、每天2次,以及其他支持、对症治疗。
7月6日,在局部麻醉下行腓肠神经活组织检查术。神经病理报告:光镜下(图 2A)可见神经外膜周围有数个小血管,血管旁未见淋巴细胞浸润,血管壁未见纤维素样坏死;神经束膜未见明显增厚,神经束内有髓神经纤维减少,可见轴索变性和髓鞘崩解,变性的轴索形成絮状碎屑,见薄髓纤维,未见小型有髓纤维成簇排列(再生丛)现象,未见有髓纤维洋葱皮样改变;神经束内小血管管壁未见明显增厚或闭塞现象,未见淀粉样物质沉积。甲苯胺蓝染色(图 2B)及透射电镜(图 2C、2D)检测提示部分有髓神经重度脱髓鞘,髓球形成,可见沃勒变性(Wallarian degeneration),轴索消失;少量薄髓神经。免疫组织化学染色:髓鞘碱性蛋白(myelin basic protein,MBP)标记显示有髓神经纤维减少,鼠抗人神经丝蛋白(neurofilament,NF)标记显示有髓神经纤维减少(图 2E),CD68标记显示神经纤维内较多组织细胞浸润(图 2F),CD4标记显示神经纤维内及血管周围未见淋巴细胞浸润,CD8标记显示神经纤维内及血管周围未见淋巴细胞浸润,CD20标记显示神经纤维内及血管周围未见淋巴细胞浸润。过碘酸-希夫及刚果红染色均未见淀粉样变性或异常沉积物。

|
图 2 腓肠神经活组织检查结果 A:光镜下(苏木精-伊红染色)可见神经外膜周围有数个小血管,血管旁未见淋巴细胞浸润,血管壁未见纤维素样坏死;神经束膜未见明显增厚,神经束内有髓神经纤维减少,可见轴索变性和髓鞘崩解,变性的轴索形成絮状碎屑,见薄髓纤维,未见小型有髓纤维成簇排列(再生丛)现象,未见有髓纤维洋葱皮样改变;神经束内小血管管壁未见明显增厚或闭塞现象,未见淀粉样物质沉积. B~D:甲苯胺蓝染色(B)和透射电镜(C、D)可见部分有髓神经重度脱髓鞘,髓球形成,可见沃勒变性(Wallarian degeneration),轴索消失;可见少量薄髓神经. E、F:免疫组织化学染色神经丝蛋白标记(E)显示有髓神经纤维减少,CD68标记(F)显示神经纤维内较多组织细胞浸润 |
治疗20余天后患者神志清晰,计算、思维等能力好转,言语洪亮有力,眼球震颤消失,上肢肌力4级,下肢肌力3级,导尿管拔除后能自行排尿。出院后继续肌内注射维生素B1。3个月后随访,患者智力、精神正常,反应灵敏,但仍需卧床;1年后随访患者仅能扶杖行走。
2 讨论维生素B1缺乏可引起一系列神经系统并发症,常见的有周围神经病、小脑共济失调、Korsakoff综合征、Wernicke脑病等。慢性维生素B1缺乏多见于长期酗酒者,一般表现为慢性周围神经病、小脑共济失调、Korsakoff遗忘综合征[1];而急性缺乏则常见于胰腺炎、胃肠道手术等需要较长时间禁食又没有及时补充足够B族维生素的患者,常表现为Wernicke脑病[2-3],以“共济失调、眼肌麻痹、精神智能异常”三联征为特点,也有以急性双侧耳聋为首发症状者[4]或迅速出现四肢瘫痪而酷似吉兰-巴雷综合征者[5]。
胰腺炎治疗过程中出现急性四肢瘫痪是一种少见的并发症。本例为中年女性,胰腺穿刺病理诊断为复发性胰腺炎。在半年时间内曾有4次急性发作,治疗过程中均有不同期限的禁食和肠外输液,在此期间是否经肠外给予足够的维生素B1未能详知。入住我院消化科时患者神志清楚、智力正常、四肢肌力5级。而在丙泊酚全麻下行胰腺穿刺手术后第3天,患者精神状态非但无好转迹象,反而恶化,并有肢体麻木和无力;随后病情继续恶化,到手术后第6天患者出现头晕、耳鸣、视物重影、胸闷、呛咳、偶有幻觉。神经内科检查发现有认知障碍、眼球震颤、眼肌麻痹(视物重影)、四肢弛缓性瘫痪。这些症状和体征高度提示Wernicke脑病,随之进行的头颅MRI所见双侧丘脑、导水管周围异常信号更进一步证实了该诊断。
但是,该患者的临床表现已超出Wernicke脑病的范畴,因为同时合并了严重的四肢瘫痪。对于肢体瘫痪的原因,在诊断上曾有分歧,有的医师考虑为急性炎性脱髓鞘性周围神经病(吉兰-巴雷综合征)、重症肌无力、甚至认为是脑干脑炎等。实际上,患者四肢瘫痪是在半年复发性胰腺炎、长期纳差的背景下出现,同时伴有严重贫血和血清白蛋白不足,维生素检测也显示维生素B1缺乏,这些均提示患者存在营养不良。此外,脑脊液检测显示白细胞数正常;更为关键的是,外周神经活组织检查光镜、电镜和免疫组织化学特征均提示周围神经为轴索变性和髓鞘崩解,但无炎症细胞浸润的证据,该神经病理结果足以说明患者四肢瘫痪不是炎症性周围神经病(吉兰-巴雷综合征)所致。
Faigle等[5]曾报道1例酗酒者出现急性四肢麻木和无力,10 ~ 14 d达高峰,首诊医院曾按吉兰-巴雷综合征治疗,但3周后患者出现意识模糊和步态不稳,才被另一家医院诊断为干脚气(dry beriberi)合并Wernicke脑病。可见维生素B1缺乏不仅会导致急性脑病,而且还可引起急性周围神经病,后者临床表现可酷似吉兰-巴雷综合征,神经活组织检查是区分病因的直接证据。
本例患者的另一重要特点是在丙泊酚全身麻醉后数天内迅速出现症状。已有研究发现,氧化亚氮全身麻醉后会迅速发生脊髓亚急性联合变性,这些患者多无甲钴胺缺乏的背景,推测其机制是氧化亚氮造成维生素B12中钴离子的持久氧化状态,从而抑制甲基丙二酰单酰辅酶A转化为琥珀酰辅酶A,以及同型半胱氨酸转化为甲硫氨酸,从而抑制髓鞘碱性蛋白的形成[6-7]。大剂量丙泊酚能引起肌肉松弛已是不争的事实,但其药理机制尚未被阐明[8-9];最新体外研究发现,丙泊酚对成年小鼠神经肌肉接头处各亚型的N型乙酰胆碱受体均有强的抑制作用[10]。这一分子机制可能是该患者麻醉后迅速出现四肢无力的诱发因素。
本例患者在出现维生素B1缺乏的症状后,及时给予每天200 mg维生素B1肌内注射,持续3个月以上,尽管患者精神、智力状态明显好转,但是周围神经损害后的肢体麻木和无力症状仅有部分改善。这一现象说明,对于原已有胰腺炎且可能存在营养不良的患者实施麻醉应慎重使用丙泊酚,至少事先应评估是否有B族维生素的缺乏,并提早数日肌内注射足量的维生素B1,以预防可能出现的严重并发症。
| [1] |
ROPPER A H, BROWN R H. Adams and victor's principles of meurology[M]. 8th ed. New York: The McGraw-Hill Companies Inc, 2005: 984-988.
|
| [2] |
BRAZG J, RUEST A, LAW S, BOSOY D. A therapeutic fast for lymphoma resulting in Wernicke encephalopathy[J]. J Emerg Med, 2015, 49: 471-474. DOI:10.1016/j.jemermed.2015.03.022 |
| [3] |
ARSLAN E A, EKINCI S, AKKUŞ P Z, GÖÇMEN R, HALILOĞLU G. Wernicke encephalopathy due to thiamine deficiency after surgery on a child with duodenal stenosis[J]. Pediatr Neurol, 2014, 51: 840-842. DOI:10.1016/j.pediatrneurol.2014.08.034 |
| [4] |
ZHANG S Q, GUAN Y T. Acute bilateral deafness as the first symptom of Wernicke encephalopathy[J/OL]. Am J Neuroradiol, 2012, 33:E44-E45.doi:10.3174/ajnr.A3040.
|
| [5] |
FAIGLE R, MOHME M, LEVY M. Dry beriberi mimicking Guillain-Barre syndrome as the first presenting sign of thiamine deficiency[J/OL]. Eur J Neurol, 2012, 19:e14-e15. doi:10.1111/j.1468-1331.2011.03602.x.
|
| [6] |
PATEL K K, MEJIA MUNNE J C, GUNNESS V R N, HERSEY D, ALSHAFAI N, SCIUBBA D, et al. Subacute combined degeneration of the spinal cord following nitrous oxide anesthesia:a systematic review of cases[J]. Clin Neurol Neurosurg, 2018, 173: 163-168. DOI:10.1016/j.clineuro.2018.08.016 |
| [7] |
RENARD D, DUTRAY A, REMY A, CASTELNOVO G, LABAUGE P. Subacute combined degeneration of the spinal cord caused by nitrous oxide anaesthesia[J]. Neurol Sci, 2009, 30: 75-76. |
| [8] |
TAHA S, SIDDIK-SAYYID S, ALAMEDDINE M, WAKIM C, DAHABRA C, MOUSSA A, et al. Propofol is superior to thiopental for intubation without muscle relaxants[J]. Can J Anaesth, 2005, 52: 249-253. DOI:10.1007/BF03016058 |
| [9] |
EASTWOOD P R, PLATT P R, SHEPHERD K, MADDISON K, HILLMAN D R. Collapsibility of the upper airway at different concentrations of propofol anesthesia[J]. Anesthesiology, 2005, 103: 470-477. DOI:10.1097/00000542-200509000-00007 |
| [10] |
JONSSON FAGERLUND M, KRUPP J, DABROWSKI M A. Propofol and AZD3043 inhibit adult muscle and neuronal nicotinic acetylcholine receptors expressed in xenopus oocytes[J/OL]. Pharmaceuticals (Basel), 2016, 9. pii:E8. doi:10.3390/ph9010008.
|
 2020, Vol. 41
2020, Vol. 41


