2. 承德医学院附属医院内分泌科, 承德 067000
2. Department of Endocrinology, Affiliated Hospital of Chengde Medical College, Chengde 067000, Hebei, China
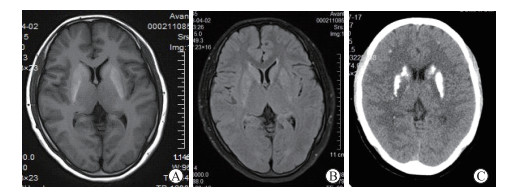
患者女,29岁,因“间断手足抽搐20余年,加重1年”于2019年7月15日入住承德医学院附属医院。患者于20余年前多次因寒冷、情绪激动出现手足抽搐,表现为双侧手指伸直,拇指内收,强直痉挛,踝关节伸直,四肢肌张力增高,无意识丧失、口吐白沫,每次持续约1 h后自行缓解,每年发作10余次。1年前患者上述症状发作较前频繁,每月发作3~4次,每次持续1~2 h后自行缓解,伴头晕、头痛,就诊于承德医学院附属医院神经内科门诊。于2018年4月2日完善头颅MRI检查示脑内多发异常信号,考虑钙化可能(图 1A、1B);查甲状旁腺激素(parathyroid hormone,PTH)为367.60 pg/mL(正常参考值为15.00~65.00 pg/mL),血钙1.23 mmol/L(正常参考值为2.11~2.52 mmol/L),血磷2.43 mmol/L(正常参考值为0.85~1.51 mmol/L),给予碳酸钙D3片600 mg每天3次、骨化三醇0.25 μg每天3次口服治疗。患者未规律服药,仍有间断抽搐发作,并出现头晕、耳鸣及视物旋转,遂于2019年7月15日入住承德医学院附属医院内分泌科进一步治疗。
|
图 1 患者影像学检查结果 A,B:磁共振成像T1加权(A)和T2抑脂序列(B)示双侧基底节区及双侧脑室旁多发异常高信号,考虑钙化;C:头颅计算机断层扫面检查示双侧基底节区可见对称性高密度钙化影 |
患者既往无头颈部手术史及放射治疗史。家族中无类似病例。体格检查:血压90/60 mmHg(1 mmHg=0.133 kPa),身高162 cm,体质量54 kg,BMI为20.58 kg/m2,心、肺、腹部无异常,面神经叩击征阴性,束臂加压试验可疑阳性。辅助检查:血钙1.56 mmol/L,血磷2.29 mmol/L,血镁及碱性磷酸酶在正常参考值范围内,PTH为378.20 pg/mL,尿钙为2.20 mmol/24 h,尿磷17.7 mmol/24 h。查垂体功能六项未见异常,双能X线吸收法测骨密度结果正常,心电图正常,头颅CT检查示双侧小脑齿状核、双侧基底节区、双侧额叶见对称性高密度钙化影(图 1C),脑血管多普勒超声检查未见异常。诊断为假性甲状旁腺功能减退症(pseudohypoparathyroidism,PHP)。给予骨化三醇0.25 μg每天2次、碳酸钙D3片600 mg每天3次口服治疗。经治疗患者病情好转,未再发作抽搐,血钙逐渐升高,住院期间血钙波动在1.46~1.78 mmol/L,于2019年7月22日出院。
2 讨论PHP指一组遗传性疾病,其特征为低血钙、高血磷和PTH抵抗。根据外源性给予PTH刺激后尿中cAMP的变化,PHP分为PHP1和PHP2两种类型。与PHP2相比,在给予PTH刺激后PHP1患者尿中cAMP增加不明显,这是由于G蛋白α亚基(G protein subunit α,Gsα)缺陷引起,Gsα在激活腺苷酸中起关键作用。同时cAMP是下游信号转导的第二信使,除了对PTH的反应外,该下游信号转导途径还参与其他多种激素的作用,包括生长激素释放激素(growth hormone releasing hormone,GHRH)、黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle stimulating hormone,FSH)和促甲状腺激素(thyroid stimulating hormone,TSH)等[1-2]。
PHP1进一步分为3个亚型,即PHP1A、PHP1B和PHP1C。PHP1A是由母体Gs蛋白α亚基(Gs protein α subunit,GNAS)基因突变导致功能缺陷引起。Gsα在人体参与多种功能,因此PHP1A的特征性表现是对PTH以外的多种激素(包括TSH、GHRH、LH和FSH等)具有抵抗性及造成Albright遗传性骨营养不良(Albright’s hereditary osteodystrophy,AHO);另外肥胖也被认为是PHP1A/C患者的特征,这可能与静息能量消耗减少和内脏脂肪堆积增加直接相关,其表现包括圆脸、身材矮小、肢体短缩和智力低下。PHP1C是PHP1的特殊亚型,由于所有突变位点都聚集在Gsα的羧基末端区域,从而影响受体激活[3]。根据家族史,PHP1B在临床上分为散发性和家族性PHP1B。家族性PHP1B为常染色体显性遗传,通常是由突触融合蛋白16(syntaxin 16,STX16)缺失引起,STX16位于GNAS上游220 kb处,是一种远程印记基因位点,可维持差异甲基化区(differentially methylatedregion,DMR)GNAS A/B:转录起始位点(transcriptional start site,TSS)-DMR的甲基化[4]。散发性PHP1B大多由于DMR甲基化广泛破坏引起,如20q父系单亲二倍体(patUPD20q)可出现广泛的DMR甲基化异常,这种形式的PHP被认为是不可遗传的[5]。
PHP2患者分子缺陷未知,推测是cAMP下游信号通路发生异常。这类患者可能未表现出典型的AHO特征,但由于维生素D缺乏而有骨骼畸形。目前在这类患者中已经发现了cAMP依赖性蛋白激酶1α型调节亚基蛋白(protein kinase cAMP-dependent regulatory type 1α,PRKAR1α)和磷酸二酯酶4D(phosphodiesterase 4D,PDE4D)突变[6]。
本例患者幼年起病,多次因寒冷、情绪激动等诱因出现手足抽搐,无身材矮小等AHO表现,生物化学检查表现为血钙明显降低、血磷升高及PTH水平明显升高,头颅CT检查示双侧小脑齿状核、双侧基底节区、双侧额叶见对称性高密度钙化影,故PHP诊断成立。临床上PHP1A和PHP1B最多见,该患者无明显的AHO表现和语言、智力异常,除PTH外无其他激素抵抗表现,无家族史且发病年龄稍晚,考虑散发性PHP1B可能性大,但基于资源和条件有限,未能进行PTH兴奋试验及基因诊断。
2.1 鉴别诊断在大多数PHP患者中,最重要的临床表现是PTH抵抗引起低钙血症而导致的手足抽搐症状,影像学检查常有颅内多发对称性钙化,伴有骨骼发育异常。现围绕PHP临床表现、实验室检查及影像学特点进行鉴别。(1)原发性甲状旁腺功能减退症[7]:患者常反复发作手足抽搐,Chvostek征(+)和Trousseau征(+),实验室检查血钙常低于2 mmol/L、血磷常高于2 mmol/L,同时血PTH明显低于正常,外源性给予PTH后尿磷及尿cAMP增加。(2)假假性甲状旁腺功能减退症:主要表现为出生后骨骼发育受限,皮下骨化形成骨瘤和骨斑块等,但血PTH、血钙、血磷正常,无PTH抵抗表现。(3)特发性对称性大脑基底核钙化症(Fahr病):常由于慢性低钙血症和相关高磷血症导致颅内钙沉积,临床表现为智力发育迟缓、癫痫发作、手足搐搦,头颅CT检查示两侧对称性基底节区异常多发性钙化,但血PTH、血钙、血磷等生物化学指标正常,既无PTH抵抗又无AHO表现。(4)维生素D缺乏性手足抽搐症:此病多见于6个月以内婴儿,以无热性惊厥最常见,发作后神志清醒,无神经系统体征,常有牙齿及骨骼发育不良、O形腿和X形腿等佝偻病表现,血钙明显低于正常,但血PTH正常,无AHO表现。
2.2 治疗 2.2.1 最新治疗理念及理论依据由于PHP限制了近端肾小管通过1α羟化酶将25-羟维生素D转化成1, 25-二羟维生素D,因此患者通常需要补充骨化三醇[8]。由于远端肾小管重吸收钙的机制完好,钙和骨化三醇联合治疗通常不会增加尿钙;但血清钙正常后,尿钙排泄可能增加,在这种情况下,将血钙控制在正常范围的低值可以较好地防止高钙尿症的发生。因此每天补充1~2 g钙通常足以将血钙水平提高至正常范围,并能阻止肠道磷酸盐的吸收以避免高磷酸盐血症。同时膳食中应补充钙,以减少肠道磷酸盐的吸收。骨化三醇的半衰期短,为2~3 h,通常以0.25~0.50 μg的起始剂量每天至少2次使用。碳酸钙D2或D3的使用可以参照美国医学研究所2011年制定的标准[9],但不应给予太大剂量,因为高剂量可导致血清25-羟维生素D增加,严重时可引起高钙血症和肾功能不全。此外,噻嗪类利尿剂可限制尿中钙的流失,这可能有助于稳定或改善PHP患者的血清钙水平。但长期使用噻嗪类利尿剂易导致尿中钾的流失,因此需要补充钾以预防低钾血症。除此之外,不建议将PTH用于PHP患者,因为血清PTH水平已经处于较高水平,体内PTH抵抗很难使外源性PTH产生有益效果[10]。
2.2.2 急性低钙血症的处理[11]当患者因严重低血钙导致抽搐时,可立即给予10%葡萄糖酸钙10 mL+葡萄糖注射液10 mL缓慢静脉推注,通常症状立即缓解;如果患者反复低钙性抽搐,可给予10%葡萄糖酸钙100 mL+5%葡萄糖液1 000 mL,按50 mL/h静脉滴注;如果病情严重,抽搐仍未缓解,可短期内辅以地西泮或苯妥英钠肌内注射,以迅速控制搐搦与痉挛。
PHP患者通常因突发抽搐而就诊于神经内科或急诊科,容易被误诊为癫痫发作等神经系统疾病。临床工作中如遇到以手足抽搐为主要表现的患者时,应注意完善头颅CT、电解质检查,必要时检测PTH水平,以便早期诊断PHP,降低患者死亡率。
| [1] |
THIELE S, WERNER R, GRÖTZINGER J, BRIX B, STAEDT P, STRUVE D, et al. A positive genotype-phenotype correlation in a large cohort of patients with pseudohypoparathyroidism type Ⅰa and pseudo-pseudohypoparathyroidism and 33 newly identified mutations in the GNAS gene[J]. Mol Genet Genomic Med, 2015, 3: 111-120. |
| [2] |
JÜPPNER H. Genetic and epigenetic defects at the GNAS locus cause different forms of pseudohypoparathyroidism[J]. Ann Endocrinol (Paris), 2015, 76: 92-97. |
| [3] |
TAFAJ O, HANN S, AYTURK U, WARMAN M L, JÜPPNER H. Mice maintain predominantly maternal Gαs expression throughout life in brown fat tissue (BAT), but not other tissues[J]. Bone, 2017, 103: 177-187. |
| [4] |
MANTOVANI G, ELLI FM. Pseudohypoparathyroidism type Ⅰb in 2015[J]. Ann Endocrinol (Paris), 2015, 76: 101-104. |
| [5] |
CHU X, ZHU Y, WANG O, NIE M, QUAN T, XUE Y, et al. Clinical and genetic characteristics of pseudohypoparathyroidism in the Chinese population[J]. Clin Endocrinol (Oxf), 2018, 88: 285-294. |
| [6] |
ELLI F M, BORDOGNA P, DE SANCTIS L, GIACHERO F, VERRUA E, SEGNI M, et al. Screening of PRKAR1A and PDE4D in a large Italian series of patients clinically diagnosed with Albright hereditary osteodystrophy and/or pseudohypoparathyroidism[J]. J Bone Miner Res, 2016, 31: 1215-1224. |
| [7] |
葛均波, 徐永健, 王辰. 内科学[M]. 9版. 北京: 人民卫生出版社, 2018: 716-717.
|
| [8] |
LOPES M P, KLIEMANN B S, BINI I B, KULCHETSCKI R, BORSANI V, SAVI L, et al. Hypoparathyroidism and pseudohypoparathyroidism: etiology, laboratory features and complications[J]. Arch Endocrinol Metab, 2016, 60: 532-536. |
| [9] |
ROSS A C, MANSON J E, ABRAMS S A, ALOIA J F, BRANNON P M, CLINTON S K, et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know[J]. J Clin Endocrinol Metab, 2011, 96: 53-58. |
| [10] |
CLARKE B L. Pseudohypoparathyroidism: a case-based approach[M]//CAMACHO P M. Metabolic bone diseases. Cham: Springer, 2019: 67-81.
|
| [11] |
中华医学会骨质疏松和骨矿盐疾病分会, 中华医学会内分泌分会代谢性骨病学组. 甲状旁腺功能减退症临床诊疗指南[J]. 中华骨质疏松和骨矿盐疾病杂志, 2018, 11: 323-337. |
 2020, Vol. 41
2020, Vol. 41


