2. 北京卫戍区海淀第十三退休干部休养所门诊部, 北京 100393;
3. 解放军91251部队卫生队药房, 上海 200940
2. Department of Outpatient, No. 13 Cadre Santatorium of Beijing Garrison in Haidian District, Beijing 100393, China;
3. Department of Pharmacy, No. 91251 Troop of PLA, Shanghai 200940, China
心脏瓣膜置换术对心脏血流动力学参数有较好的改善效果[1],但由于它是侵入性操作,对患者心脏内膜会造成一定程度的损伤,因此患者术后发生血栓性疾病的概率较高[2-3]。置换机械瓣膜的患者需要终身口服华法林来防止血栓形成,而口服华法林对于心脏瓣膜置换术后早期阶段患者预防血栓性疾病尤为重要[4]。《心房颤动抗凝治疗中国专家共识》中将华法林作为防止患者心脏瓣膜置换术后形成血栓的首选药物[5]。
口服华法林的治疗窗窄、个体差异较大、影响因素多[6-8],其抗凝效果与患者术后出血、栓塞并发症、预后和长期生活质量等紧密相关[9],所以对于口服华法林患者抗凝监测非常重要。
华法林为香豆素类口服抗凝药,与血浆蛋白(主要是白蛋白)结合率高达98%~99%[8],但只有游离华法林能发挥抗凝作用;与血浆蛋白的结合率高的药物和食物可竞争性抑制华法林与血浆蛋白的结合,使游离华法林浓度增加、抗凝作用增强。凝血酶原时间比值是国内抗凝监测中应用较为广泛的指标,但其稳定性和可比性较差[10]。国际标准化比值因为校正了试剂灵敏度差异产生的误差,可以在一定程度上准确反映抗凝强度,但其结果和临床上抗凝效果的一致性较差[11]。因此,需要选择其他指标用于口服华法林的抗凝监测[10]。血浆中华法林的浓度是一个稳定且灵敏的指标,可以作为口服华法林抗凝治疗的监测指标。HPLC虽然能够提供更高的特异度,却没有足够的灵敏度[12-13]。采用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法检测华法林的含量,特异度和灵敏度都有所提高[14]。本研究拟建立一种方便、可靠、灵敏的LC-MS/MS方法,用于检测血浆中游离华法林和总华法林的含量,为临床个体化用药提供参考。
1 材料和方法 1.1 仪器Agilent 6410A型三重四极杆串联质谱仪,包括Agilent 1200 G1311A四元泵、G1322A真空脱气机、G1329A自动进样器、G1316A柱温箱,使用MassHunter软件控制系统及数据处理(美国Agilent公司)。Vortex Mixer旋涡混合器(美国Labnet公司),Centrifuge 5810R台式冷冻高速离心机(德国Eppendorf公司),CPA225D电子分析天平(德国Sartorius公司),SK7200H超声仪(上海科导超声仪器有限公司),Ultrafree-MC超滤离心管(数均分子量为5 000)。
1.2 药品与试剂华法林(大连美仑生物技术有限公司,货号:MB1974-S),尼群地平(中国食品药品检定研究院,纯度98%),甲醇、乙腈、甲酸均为HPLC级(美国默沙东公司)。
1.3 液相色谱条件色谱柱为Agilent Poroshell 120 Phenyl Hexyl column(2.1 mm×50 mm,2.7 μm;美国Agilent公司);流动相A(0.2%甲酸+1%乙腈水溶液):B(0.2%甲酸乙腈溶液)=60:40(体积比),流速为0.3 mL/min,进样量为10 μL,柱温为25 ℃;每个样品的分析周期为4 min。
1.4 质谱检测条件采用电喷雾离子源、正离子、多反应监测(multiple reaction monitoring,MRM)模式。氮气为雾化气和干燥气;高纯氮气为碰撞气,压力是0.1 MPa;雾化气压力为40 psi(1 psi=6 894.8 Pa),干燥气温度为350 ℃,干燥气流速为10.0 L/min;毛细管电压为4 000 V;用于定量分析的检测离子为:华法林质荷比(mass-to-charge ratio,m/z)309→163,碰撞诱导解离能量为106 V,碰撞能源为14 eV;尼群地平m/z 361.2→315.1,碰撞诱导解离能量为80 V,碰撞能源为6 eV。
1.5 溶液的制备 1.5.1 对照品溶液精密称华法林约2.04 mg,用甲醇溶解,移至2.0 mL的容量瓶中,定容,制得质量浓度为1.02 mg/mL的标准储备液,分装,置于-20 ℃冰箱冷冻保存。取标准储备液适量,以5%甲醇按1:10比例稀释,得到质量浓度为50、100、200、500、1 000、2 000、5 000、10 000、20 000、50 000 ng/mL的系列溶液。
1.5.2 内标溶液精密称取尼群地平标准品约2.08 mg,用甲醇溶解,移至2.0 mL的容量瓶中,定容,制得质量浓度为1.04 mg/mL的内标储备液,再用甲醇稀释至质量浓度为1 μg/mL的内标溶液。
1.5.3 超滤血浆取400 μL血浆样品[海军军医大学(第二军医大学)]于Ultrafree-MC超滤离心管中以6 500×g 37 ℃离心30 min即得。
1.6 样品采集和预处理收集海军军医大学(第二军医大学)长海医院行心脏瓣膜置换术后服用华法林抗凝的20例患者的血浆样本,本实验经海军军医大学(第二军医大学)长海医院医学伦理委员会审批。分别取100 μL血浆样品(用于检测总华法林浓度)或100 μL超滤血浆(用于检测游离华法林浓度),精密加入10 μL内标溶液(1 μg/mL)和300 μL乙腈,涡旋离心后取上清液200 μL置挥发仪中40 ℃挥干。以流动相50 μL复溶,离心,取上清液进样分析。
1.7 方法学考察 1.7.1 专属性6个来自不同患者的空白血浆和标准添加水标样品,按照1.6样品预处理方法处理后进样分析,考察标准添加样品的色谱图、华法林和内标的出峰时间、血浆中的杂质成分是否对华法林峰存在干扰。
1.7.2 标准曲线和最低定量限(lowest limit of quantification,LLOQ)精确吸取各标准对照品适量于1.5 mL离心管中,分别用人空白超滤血浆、人空白血浆按1:10比例稀释,涡旋混合,得标准曲线血浆样品,按1.3项条件进样分析,以华法林标准对照品浓度为X,以华法林标准对照品与内标峰面积的比值为Y,采用1/χ2加权最小二乘法计算线性回归方程。取LLOQ浓度方法学样品(游离华法林5 ng/mL和总华法林50 ng/mL)进行定量下限考察,连续测定3 d,每天测定6批。
1.7.3 精密度按1.6项方法制备低、中、高3个不同浓度的血浆样品(游离华法林:5、50、200 ng/mL;总华法林:100、500、2 000 ng/mL),每个浓度样品平行制备5份,连续测定3 d。根据当天的标准曲线计算游离华法林和总华法林的实测浓度及日内、日间相对标准偏差(relative standard deviation,RSD)与准确度。
1.7.4 提取回收率和基质效应按1.6项方法制备低、中、高3个不同浓度的血浆样品(游离华法林:5、50、200 ng/mL;总华法林:100、500、2 000 ng/mL),每个浓度样品平行制备3份,将所得峰面积与空白基质提取制备液和相应浓度的工作液混合进样所得峰面积相比,计算提取回收率,将空白基质处理溶液和相应浓度的工作液混合进样所得峰面积与相应浓度的工作液直接进样所得峰面积相比计算基质效应。
1.7.5 稳定性低、中、高3个不同浓度的血浆样品(游离华法林:5、50、200 ng/mL;总华法林:100、500、2 000 ng/mL),按1.6项方法预处理,放置后取样分析,考察其在进样室放置的稳定性;取低、中、高3个不同浓度的血浆样品(游离华法林:5、50、200 ng/mL;总华法林:100、500、2 000 ng/mL)放置在-20 ℃冰箱中分别冻融3次,按1.6项方法预处理后考察冻融的稳定性。
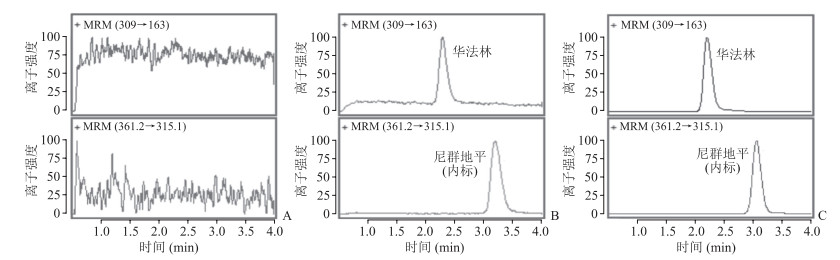
2 结果 2.1 方法专属性见图 1,华法林和内标尼群地平峰形良好,血浆中内源物和杂质均不干扰其测定。
|
图 1 LC-MS/MS测定血浆中华法林的色谱图 A:空白血浆;B:添加华法林(5 ng/mL)和尼群地平(内标)的空白血浆;C:血浆样本.LC-MS/MS:液相色谱-串联质谱;MRM:多反应监测 |
2.2 标准曲线和LLOQ
游离华法林的线性范围为5~500 ng/mL,总华法林的线性范围为50~5 000 ng/mL,相关系数r分别为0.991和0.995,均>0.990,两者的标准曲线分别为Y=6.932 6X-0.145 7和Y=0.011 5X+0.713 9,在线性浓度范围内线性关系良好。批间精密度RSD分别为14.57%和7.72%,均<15%,游离华法林和总华法林的准确度分别为-1.2%和-4.62%,在-20%~20%范围内符合相关要求。
2.3 精密度结果见表 1,游离华法林和总华法林的日间与日内RSD均<15%,符合生物样品的检测要求。
|
|
表 1 游离华法林及总华法林的精密度考察结果 |
2.4 提取回收率与基质效应
结果见表 2,蛋白沉淀法对游离华法林和总华法林的提取回收率分别为78.34%~91.59%和87.33%~89.99%,基质效应为87.50%~104.87%,符合生物样品的检测要求。
|
|
表 2 游离华法林和总华法林及内标血浆提取回收率和基质效应考察结果 |
2.5 稳定性考察
低、中和高3个不同浓度样品经3次冻融循环后测定的RSD均<15%,于室温下放置12 h后测定的RSD均<15%,结果见表 3,华法林的稳定性符合生物样品的检测要求。
|
|
表 3 游离华法林及总华法林的稳定性考察 |
2.6 样品测定
20例患者血浆检测结果:游离华法林浓度为29.77~80.81 ng/mL,总华法林浓度为191.56~618.67 ng/mL。
3 讨论 3.1 质谱检测条件的优化本实验运用电喷雾离子源、正离子、MRM模式检测,加氢峰易于得到有规律的碎片离子,有利于质谱的检测,通过优化电离条件及裂解条件最终找到能够满足测定游离华法林及总华法林浓度的质谱条件,MRM模式下:华法林m/z 309→163,尼群地平(内标)m/z 361.2→315.1。
3.2 色谱条件的优化调节流动相中有机相和水相的组分和比例(如80:20、70:30、60:40、50:50、40:60)进行摸索,结果显示在水相为0.2%甲酸+1%乙腈水溶液、有机相为0.2%甲酸乙腈溶液,且水相与有机相的比例为60:40时,华法林与尼群地平分离效果及峰型良好。
3.3 样品前处理的优化尝试了多种样品前处理方法,如加入乙酸乙酯的液液萃取、固相萃取、选用不同的蛋白沉淀剂(如甲醇、乙腈、丙酮)等,综合考察效果、成本、效率等选择了蛋白沉淀法。
3.4 内标的选择尝试了格列齐特、卡马西平、依托考昔、可的松和尼群地平,最后确定以尼群地平作为内标;尼群地平与华法林出峰时间相近而且响应很好,并且在血浆中未被测到,符合作为内标的条件。
综上所述,本实验建立了一种方便、可靠、灵敏的LC-MS/MS方法,可用于测定血浆中游离和总华法林浓度,样品前处理简单、快速且经济;华法林和内标能够实现基线分离,其测定不受血浆中内源性物质的干扰,具有很好的专属性;通过方法学的验证,游离华法林和总华法林的线性、精密度和稳定性均符合生物样品的检测要求。
| [1] |
URENA M, WEBB J G, ELTCHANINOFF H, MUÑOZ-GARCÍA A J, BOULETI C, TAMBURINO C, et al. Late cardiac death in patients undergoing transcatheter aortic valve replacement:incidence and predictors of advenced heart failure and sudden cardiac death[J]. J Am Coll Cardiol, 2015, 65: 437-448. |
| [2] |
STEINBERG B A, HARRISON J K, FRAZIER-MILLS C, HUGHES G C, PICCINI J P. Cardiac conduction system disease after transcatheter aortic valve replacement[J]. Am Heart J, 2012, 164: 664-671. |
| [3] |
ERDOZAIN J G, RUIZ-IRASTORZA G, SEGURA M I, AMIGO M C, ESPINOSA G, POMAR J L, et al. Cardiac valve replacement in patients with antiphospholipid syndrome[J]. Arthritis Care Res (Hoboken), 2012, 64: 1256-1260. |
| [4] |
徐博, 刘金成, 俞世强, 王欣荣, 马燕燕, 易定华. 人工机械心脏瓣膜置换术后抗凝治疗强度与并发症发生率的关系[J]. 心脏杂志, 2012, 24: 749-752. |
| [5] |
中华医学会心血管病学分会, 中国老年学学会心脑血管病专业委员会, 中国生物医学工程学心律分会, 中华医学会心电生理和起搏分会, 中国医师协会循证医学专业委员会, 心律失常联盟(中国). 心房颤动抗凝治疗中国专家共识[J]. 中华内科杂志, 2012, 51: 916-921. |
| [6] |
姚慧娟, 李平, 刘昕竹, 杨宇, 卜书红, 张健. 药学门诊患者服用华法林随访分析[J]. 医药导报, 2019, 38: 1359-1362. |
| [7] |
刘俊, 栾家杰, 徐文科, 朱艳虹, 汪魏平, 张大发. 中国汉族人群基于临床特征和基因型华法林个体化给药模型的研究[J]. 中国临床药理学与治疗学, 2014, 19: 284-289. |
| [8] |
钱正月, 翟振国, 赵莉. 华法林个体化基因检测临床应用分析[J]. 心血管病学进展, 2019, 40: 433-436. |
| [9] |
TAN S L, LI Z, ZHANG W, SONG G B, LIU L M, PENG J, et al. Cytochrome P450 oxidoreductase genetic polymorphisms A503V and rs2868177 do not significantly affect warfarin stable dosage in Han-Chinese patients with mechanical heart valve replacement[J]. Eur J Clin Pharmacol, 2013, 69: 1769-1775. |
| [10] |
秦蓁蓁. 华法林治疗中监测凝血酶原时间的临床应用[J]. 中国继续医学教育, 2018, 10: 56-57. |
| [11] |
朱君荣, 陈鑫, 洪鲜花, 朱余兵, 陶宜富. 心脏瓣膜置换术后国际标准化比值与华法林对映体血浆浓度及给药剂量的相关性研究[J]. 中国药房, 2015, 26: 4195-4197. |
| [12] |
蔡卫民, 裴斐, 陈冰. 立体选择性高效液相色谱法测定血浆中华法林对映体浓度[J]. 中国药学杂志, 1996, 31: 360-363. |
| [13] |
唐江涛, 陈瑶, 白杨娟, 苗强, 邹远高. 超高效液相色谱法测定血浆华法林浓度及临床应用[J]. 中华临床实验室管理电子杂志, 2019, 7: 133-136. |
| [14] |
RADWAN M A, BAWAZEER G A, ALOUDAH N M, ALQUADEIB B T, ABOUL-ENEIN H Y. Determination of free and total warfarin concentrations in plasma using UPLC MS/MS and its application to a patient samples[J]. Biomed Chromatogr, 2012, 26: 6-11. |
 2020, Vol. 41
2020, Vol. 41


