2. 海军军医大学(第二军医大学)长征医院肝移植中心, 上海 200003
2. Organ Transplantation Center, Changzheng Hospital, Naval Medical University(Second Military Medical University), Shanghai 200003, China
患者女,77岁,2012年4月27日因“胆囊结石”于我院普通外科行全身麻醉下腹腔镜胆囊切除术。术中见胆囊大小约90 mm×40 mm×40 mm,与邻近大网膜粘连,胆囊壁未明显增厚、无明显水肿;清晰显露胆囊动脉前后支,用Hem-o-lok夹分别夹闭后予以切断;在距胆总管5 mm处用Hem-o-lok夹夹闭胆囊管后予以切断;胆囊剥离后对胆囊床彻底电凝止血;术中观察胆囊床及术野无渗血、渗胆汁,未留置腹腔引流条。手术过程顺利,术后恢复良好,2012年5月1日出院。
2012年5月4日午后患者突然发热,无寒战,无恶心、呕吐,无皮肤及巩膜黄染,次日复入我院普通外科诊治。5月8日夜间寒战后高热,最高体温达39.5 ℃。皮肤锁孔切口红肿,见少量淡黄色渗液,予消毒和局部麻醉下置入细纱条引流。外周血常规示白细胞计数19.6×109/L[正常参考值范围为(4.5~11.0)×109/L]、中性粒细胞计数18.72×109/L[正常参考值范围为(1.8~6.3)×109/L]、中性粒细胞比例0.955(正常参考值范围为0.540~0.620);淋巴细胞比例0.035(正常参考值范围为0.200~0.400)、单核细胞比例0.06(正常参考值范围为0.030~0.100)、嗜酸粒细胞比例0.01(正常参考值范围为0.005~0.05)。予克林霉素磷酸酯1 g、头孢曲松钠2 g、甲硝唑0.5 g静滴,行消炎及补液治疗,该治疗方案持续至5月14日穿刺引流术前,在此期间白细胞计数和中性粒细胞比例始终未降至正常。
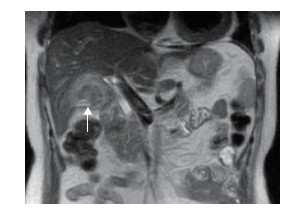
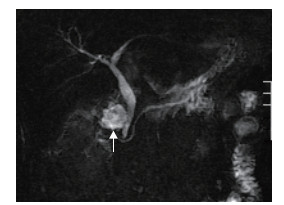
患者于2012年5月5日行超声检查示胆囊窝处见一大小约37 mm×19 mm的低回声灶,边界清晰,内部回声不均。5月9日再次行超声检查示该低回声灶增大至40 mm×25 mm,彩色多普勒血流图(color Doppler flow imaging,CDFI)显示病灶内部无血流信号。结合既往手术史,超声诊断“胆囊窝脓肿”可能。5月10日行腹部MRI检查示胆囊窝片状异常信号影,T1加权像呈低信号,T2加权像呈高信号(图 1)。磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)检查示胆囊窝信号异常,但肝内外胆管无异常(图 2)。因患者临床感染症状持续无缓解,普通外科组织多学科会诊后决定对该“脓肿”行超声引导下穿刺诊断及引流治疗。
|
图 1 腹部磁共振成像T1加权像示胆囊窝片状低信号影(箭头所示) |
|
图 2 磁共振胰胆管造影示胆管旁强度不均的低至高信号(箭头所示) |
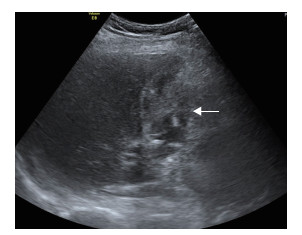
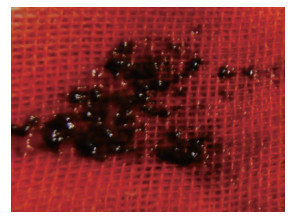
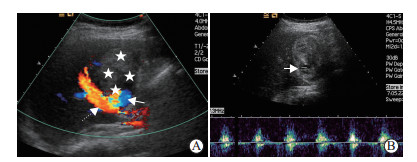
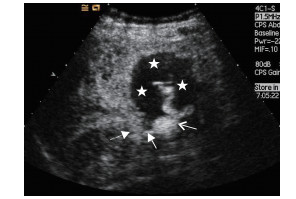
2012年5月14日穿刺前即刻超声检查见“脓肿”大小约44 mm×35 mm(图 3),较前略增大,但CDFI显示内部仍无血流信号。1%利多卡因局部麻醉后经皮经肝穿刺,在CDFI指引下避开穿刺路径上的血流信号区,以改良Seldinger法将10 Fr Skater引流管(丹麦Angiotech公司)从胆囊床准确置入胆囊窝“脓肿”内,超声显示穿刺针远离肝门部血管。妥善置入引流管后,最初引流不畅,增压抽吸出约3 mL暗红色碎渣样物质,肉眼观无明显脓性成分(图 4)。但瞬间有鲜红色血液从引流管涌出,此时声像图显示“脓肿”内有快速流动的密集、细小点状回声,CDFI显示“脓肿”的门静脉侧区域内有杂乱的彩色信号(图 5A),脉冲多普勒取样分析示有搏动特征的曲线(图 5B),疑诊该病灶为“肝动脉假性动脉瘤”;迅速经肘静脉团注2 mL六氟化硫微泡溶液(SonoVue,意大利Bracco公司)行二维超声造影(contrast-enhanced ultrasonography,CEUS;超声造影设备为CPS-Cadence,Sequoia 512,德国Siemens公司)检查,发现肝动脉期该“假性动脉瘤”内未见增强,至门静脉期其内始见造影剂快速充填,但瘤腔大部呈无增强状态(图 6),遂疑诊为“肝外门静脉假性静脉瘤合并瘤内血栓形成”。当即启动介入超声治疗紧急抢救预案,上报我院医疗总值班的同时通知肝外科主任和麻醉科主任直接至麻醉科手术室会诊,在未拔除穿刺引流管状态下迅速将患者转运至手术室实施急诊剖腹探查术。
|
图 3 2012年5月14日穿刺前超声检查见一大小约44 mm×35 mm异常回声灶(箭头所示) 病灶位于胆囊窝,接近椭圆形,境界不清晰,内部回声不均匀,大部区域的回声近似实性,邻近门静脉处可见近似无回声区域 |
|
图 4 2012年5月14日超声引导下引流出瘤腔内暗红色碎渣样物质 |
|
图 5 2012年5月14日引流术中多普勒声像图检查结果 A:彩色多普勒血流图显示瘤腔大部为实性回声充填(五角星所示),仅邻近门静脉主干(虚线箭头所示)处可见红蓝双色血流信号(实线箭头所示),不能确定该异常信号来源于门静脉抑或肝动脉;B:从双色血流信号对应的灰阶声像处(箭头所示)获取的多普勒流速曲线呈搏动特征,疑诊“肝动脉假性动脉瘤” |
|
图 6 2012年5月14日引流术中二维超声造影检查结果 门静脉主干内造影剂强回声(虚线箭头所示);造影剂从门静脉前壁破裂口(实线闭合箭头所示)流入静脉瘤腔内(开放箭头所示),提示该部柔软血栓被抽吸后形成的瘤腔再通;无增强区域(五角星所示)为瘤腔内血栓 |
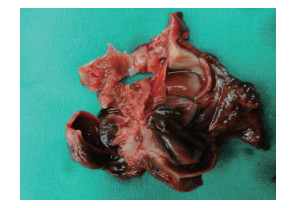
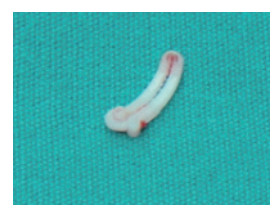
术中腹腔内见少量淡红色血性渗液,肝、脾、胃无异常,胆囊窝网膜组织包裹且炎性水肿明显。钝性分离局部粘连,于胆囊窝处见一大小约50 mm×60 mm的暗红色血肿性包块,压迫胆囊三角区,无脓性成分。术者用手指压迫阻断门静脉近心端时该病灶张力迅即降低,解除阻断后张力立即回升。彻底清除血肿后,在与血肿邻接的门静脉前壁见一活动性出血点,细缝状裂隙长约1 mm,以3-0无损伤血管缝线浅层缝闭出血点。拔除穿刺引流管,清洗腹腔,确认肝脏脏面和膈面的穿刺引流管创面及门静脉原出血点处再无渗血后,于腹壁切口右下方戳孔放置直径为5 mm的腹腔引流管,关腹结束手术。血肿标本中除凝血块外,可见内壁光滑的纤维囊壁(图 7)和Hem-o-lok夹(图 8)。术中出血约200 mL,输注红细胞悬液800 mL、血浆200 mL。探查术后次日起患者发热消退,外周血白细胞计数及中性粒细胞比例逐步降至正常,于2012年5月24日出院。
|
图 7 质韧有弹性的假性门静脉瘤囊壁剖面观 |
|
图 8 从假性门静脉瘤标本中取出的Hem-o-lok夹 |
2 讨论
门静脉瘤十分少见,自Barzilai和Kleckner[1]于1956年首次报道以来,迄今文献刊载的病例数仅约200例[2],而继发于腹腔镜胆囊切除术的假性门静脉瘤则更加罕见。然而,如果将假性门静脉瘤误判为术后胆囊窝脓肿或胆汁淤积时,临床上极易做出对脓液或胆汁淤积实施穿刺引流治疗的决定,从而导致意外的凶险出血。本文报告1例门静脉主干假性门静脉瘤误诊为胆囊切除术后胆囊窝脓肿后采用经皮穿刺引流而发生的出血风险及其处置经验。
腹腔镜胆囊切除术治疗胆囊结石不仅微创,而且总体并发症发生率低于开放性切除术。然而,因患者局部解剖因素、手术器械因素、术者操作技术因素等导致的医源性并发症仍有发生。术中必须处理的结构包括胆囊动脉、胆囊管和胆囊本身,需对胆囊动脉和胆囊管进行夹闭后切断、将胆囊自浆膜下剥离并对胆囊床创面电凝止血等,并发症通常发生于这些环节。并发症中以胆漏最为常见,发生率约为1.7%[3],主要源于术中胆囊穿孔和胆囊床创面处理不善导致胆汁渗漏,极少数是由于胆囊管断端夹闭不严密或夹子脱落所致。Hem-o-lok夹是夹闭胆囊管、血管的常用工具,已有文献报道Hem-o-lok夹在术后可发生脱落、游移进而导致胆漏或出血。渗漏的胆汁常局限在胆囊窝或小网膜囊内,量多时可达上千毫升,合并细菌感染后还可能演变为胆汁性脓肿[4-5]。脓肿是仅次于胆漏的另一严重并发症,发生率约为0.3%,主要源自术中胆道损伤、肠管损伤或结石脱落至腹腔内,脓肿的位置可在胆囊窝、腹壁锁孔处、膈下或肠管间[5]。该患者腹腔镜胆囊切除术后感染征象明显,胆囊窝出现与脓肿极其相似的声像图改变,MRI和MRCP既未认定胆囊窝“脓肿”,也未疑诊“血肿”。多种原因综合促成了腹腔镜胆囊切除术后并发“胆囊窝脓肿”的临床诊断。
腹腔镜胆囊切除术血管并发症中以假性肝动脉瘤多见,且多发于肝右动脉,具有破裂出血的潜在风险[6]。因该手术操作环节不直接涉及门静脉,故假性门静脉瘤的案例十分罕见。Barrett等[7]报道了741例腹腔镜胆囊切除术后并发症发生情况,未出现门静脉瘤。假性肝动脉瘤抑或假性门静脉瘤均是血管壁某个位点出现薄弱或破裂,高速血流从破口涌出后由周围结缔组织包裹再经由破裂口重新回到血管腔内,在血流冲刷下局部逐渐形成由结缔组织包裹的囊状瘤样结构[8],因血流速度快,灰阶声像图上假性动脉瘤或假性门静脉瘤表现为类圆形的无回声囊状结构[9],CDFI上囊腔内可见双向性彩色流动信号[9-10],故超声对腹腔镜胆囊切除术并发的假性动脉瘤或假性门静脉瘤有较强的检出和诊断能力。然而本例假性门静脉瘤于灰阶声像图上被误诊为胆囊窝脓肿,CDFI显示瘤腔内无彩色血流信号,其直接原因是瘤腔内填满了血栓。流经瘤腔内的血液呈涡流,靠近囊壁的血细胞因离心力作用而逐渐沉积,形成向心性逐渐增厚的凝血块,瘤腔逐渐缩小,最终可完全填塞,不再有血流进出,令其血管性疾病的本质被掩盖[11]。充满瘤腔的新鲜血栓代替了流动的血液,既造成灰阶超声显示为黏稠的脓肿,也导致CDFI未见其特征性的双向性彩色流动信号,此种情况下超声检查误诊、误判的风险陡然增大。
胆囊切除术后发生胆囊窝积胆汁或积脓时,超声引导下穿刺引流已成为首选诊治方法[12]。经过引流管可以持续、充分地引流脓液,清洗脓腔并使用抗生素对脓腔进行局部灌洗,提升局部抗感染的效果。此外,超声引导下穿刺由于穿刺的微创性,非常适合外科术后不久或全身情况较虚弱的患者。本例患者在成功穿刺放置引流管后最初抽吸较困难,最可能的原因是瘤腔内新鲜血凝块呈质软、黏稠状态,需用较大的负压力才可抽吸出部分血凝块。当部分凝血块被吸出后,原已填塞的瘤腔腔内压力骤降,血流重新进入瘤腔,此时CDFI才得以显示异常血流信号。最终疑诊假性门静脉瘤的线索是来自CEUS而非CDFI和脉冲多普勒流速曲线分析,乃因为瘤腔内造影剂开始充填的时间与门静脉主干时相相同,此诊断信息对急诊剖腹探查术亦有一定的指导作用。
本病例的诊治结果有以下几点启示:(1)在腹腔镜胆囊切除术中,术者可能会意外误伤门静脉,如Hem-o-lok夹不慎夹住了门静脉壁,致其局部缺血坏死,形成微小破裂口并演变为门静脉假性静脉瘤。(2)假性门静脉瘤可以引起寒战、发热、白细胞计数和中性粒细胞计数升高等感染征象,使临床医师对门静脉瘤的意识和警惕被脓肿冲淡。(3)假性门静脉瘤腔内形成血凝块后,其灰阶声像图表现与胆囊窝脓肿极易混淆,当瘤腔完全为血凝块充填时CDFI乃至CEUS均可能发生误诊,MRI也缺乏确诊价值。(4)一旦被误诊为脓肿进行穿刺引流治疗时,切忌慌乱中轻率地拔除引流管。剖腹探查术证明引流管在位,腹腔内几乎没有明显出血,引流管本身起到了封闭瘤腔穿刺点、阻止出血的作用。(5)介入超声治疗虽然微创,但是亦须有应急预案。迅速正确地启动急会诊程序,有效地组织抢救力量是本病例预后良好的重要保障。
| [1] |
BARZILAI R, KLECKNER M S Jr. Hemocholecyst following ruptured aneurysm of portal vein; report of a case[J]. AMA Arch Surg, 1956, 72: 725-727. |
| [2] |
TSAUO J, LI X. Portal vein aneurysm associated with Budd Chiari syndrome treated with transjugular intrahepatic portosystemic shunt: a case report[J]. World J Gastroenterol, 2015, 21: 2858-2861. |
| [3] |
NIJSSEN M A, SCHREINEMAKERS J M, MEYER Z, VAN DER SCHELLING G P, CROLLA R M, RIJKEN A M. Complications after laparoscopic cholecystectomy: a video evaluation study of whether the critical view of safety was reached[J]. World J Surg, 2015, 39: 1798-1803. |
| [4] |
KOU K, LIU X, HU Y, LUO F, SUN D, WANG G, et al. Hem-o-lok clip found in the common bile duct 3 years after laparoscopic cholecystectomy and surgical exploration[J]. J Int Med Res, 2019, 47: 1052-1058. |
| [5] |
KIM B S, JOO S H, KIM H C. Spilled gallstones mimicking a retroperitoneal sarcoma following laparoscopic cholecystectomy[J]. World J Gastroenterol, 2016, 22: 4421-4426. |
| [6] |
SENTHILKUMAR M P, BATTULA N, PERERA M, MARUDANAYAGAM R, ISAAC J, MUIESAN P, et al. Management of a pseudo-aneurysm in the hepatic artery after a laparoscopic cholecystectomy[J]. Ann R Coll Surg Engl, 2016, 98: 456-460. |
| [7] |
BARRETT M, ASBUN H J, CHIEN H L, BRUNT L M, TELEM D A. Bile duct injury and morbidity following cholecystectomy: a need for improvement[J]. Surg Endosc, 2018, 32: 1683-1688. |
| [8] |
ⅡMURO Y, SUZUMURA K, OHASHI K, TANAKA H, ⅡJIMA H, NISHIGUCHI S, 等. Hemodynamic analysis and treatment of an enlarging extrahepatic portal aneurysm: report of a case[J]. Surg Today, 2015, 45: 383-389. |
| [9] |
SHRIVASTAVA A, RAMPAL J S, NAGESHWAR REDDY D. Giant intrahepatic portal vein aneurysm: leave it or treat it[J]. J Clin Exp Hepatol, 2017, 7: 71-76. |
| [10] |
赵婷婷, 章建全. 三维彩色多普勒超声诊断门静脉主干瘤一例[J]. 宁夏医学杂志, 2007, 29: 859. |
| [11] |
张玲, 章建全, 赵彩. 彩色多普勒超声诊断甲状腺上动脉假性动脉瘤一例报告[J]. 第二军医大学学报, 2003, 24: 402, 405. ZHANG L, ZHANG J Q, ZHAO C. Color Doppler flow image in diagnosis of thyriod pseudo-aneurysm: a case report[J]. Acad J Sec Mil Med Univ, 2003, 24: 402, 405. |
| [12] |
杨忠诚, 尹桂, 张玮琳. 介入性超声置管引流在外科术后腹腔液性包块处理中的应用价值[J]. 实用医学影像杂志, 2018, 19: 33-36. |
 2020, Vol. 41
2020, Vol. 41


