2. 复旦大学附属眼耳鼻喉科医院病理科, 上海 201112
2. Department of Pathology, Eye Ear Nose and Throat Hospital, Fudan University, Shanghai 201112, China
横纹肌肉瘤(rhabdomyosarcoma,RMS)是源于向横纹肌分化的原始间叶细胞,并由不同分化程度的横纹肌细胞组成的软组织恶性肿瘤[1]。最新2013版WHO软组织肉瘤丛书根据病理形态学特征、遗传学特点及临床表现将RMS分为4个亚型:胚胎性、腺泡状、多形性和梭形细胞/硬化性[2],其中梭形细胞/硬化性RMS是新增加的亚型。不同组织学类型RMS的临床特征和预后各异,其中胚胎性RMS预后最好,多形性RMS预后最差[3]。RMS作为一种罕见的恶性肿瘤,20岁以下人群年发病率约为4.3/100万,在成人中发病率更低[4]。成人RMS约占成人恶性实体肿瘤的1%,其中35%~40%成人RMS发生于头颈部[1]。尽管成人头颈部RMS非常罕见,但是其恶性程度高、侵袭性强、预后极差。基于监测、流行病学及预后(surveillance, epidemiology, and end results,SEER)数据库及国内上海交通大学医学院附属第九人民医院数据的回顾性研究表明,成人头颈部RMS的5年生存率仅约为36%[5-6]。近半个世纪以来,现有的细胞毒药物联合放射治疗治疗成人头颈部RMS的疗效已达瓶颈。研究表明某些基因重排、突变或信号通路的改变在RMS发生、发展及预后中发挥着重要作用[7]。因此,识别驱动RMS细胞恶性转化的特异性分子机制,并寻找新的预测因子及治疗靶点是未来改善RMS疗效的研究方向。研究表明,肿瘤干细胞标志物lin-28同源基因B(lin-28 homolog B,LIN28B)的表达与多种恶性肿瘤的发生、发展密切相关[8],然而LIN28B在RMS中的作用目前未见报道。本研究通过检测成人头颈部RMS组织中LIN28B蛋白的表达,分析LIN28B蛋白表达与RMS患者临床病理特征的关系,并进一步探讨其对患者预后的影响。
1 资料和方法 1.1 一般资料选择2009年1月至2015年12月在复旦大学附属眼耳鼻喉科医院放疗科接受治疗的成人头颈部RMS患者22例,年龄为16~75岁,中位年龄为30岁;男14例,女8例;肿瘤原发于筛窦、鼻腔、上颌窦、鼻咽的患者分别为10、6、5、1例。纳入标准:(1)年龄≥16周岁;(2)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况(performance status,PS)评分为0~1分;(3)在复旦大学附属眼耳鼻喉科医院接受活组织检查或手术治疗,并经组织病理学确诊为RMS;(4)初次诊断为头颈部RMS患者,既往未接受化学治疗或放射治疗;(5)无明显心、肝、肾功能障碍和血液系统疾病;(6)有完整的临床随访资料,随访期≥1年或至患者死亡。随机选取5例因其他实体肿瘤在复旦大学附属肿瘤医院行手术切除患者的正常横纹肌组织作为阴性对照。5例患者分别为29岁右肩部侵袭性瘤病女性患者、30岁右臀部腺泡状软组织肉瘤女性患者、37岁右乳浸润性导管癌女性患者、43岁胸背部梭形细胞肉瘤男性患者和66岁左大腿黏液纤维肉瘤男性患者。本研究通过复旦大学附属眼耳鼻喉科医院伦理委员会审批。
1.2 免疫组织化学染色采用免疫组织化学染色检测组织标本中LIN28B蛋白表达情况。LIN28B一抗购自美国Cell Signaling公司(#4196S),稀释浓度1:50,以PBS代替一抗作为阴性对照。每张切片在高倍镜(×200)下随机观察5个视野,每个视野计数100个肿瘤细胞。采用半定量积分法对每张切片的阳性细胞百分比及阳性细胞染色强度分别进行分级计分,然后根据这2项的乘积确定其阳性强度。染色强度分为4级:无染色0分,弱染色1分,中等染色2分,强染色3分;阳性细胞百分比:<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。组织学评分(染色强度×阳性细胞百分比)0~1分为-,2~3分为+,4~6分为┼┼,≥6分为┼┼┼;其中0~3分定义为低表达,≥4分定义为高表达。
1.3 随访采用电话或门诊的方式进行随访,随访截止日期为2019年10月30日。总生存期定义为病理确诊时间至死亡或至随访截止日期。无进展生存期定义为病理确诊时间至患者出现疾病进展或死亡或至随访截止日期。
1.4 统计学处理采用SPSS 23.0软件进行统计学分析。计数资料以例数和百分数表示,组间比较采用Fisher确切概率法。生存分析采用Kaplan-Meier法并进行log-rank检验。检验水准(α)为0.05。
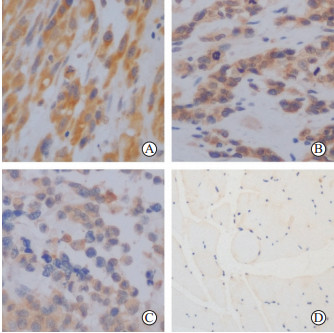
2 结果 2.1 LIN28B在成人头颈部RMS组织标本中的表达免疫组织化学染色结果显示,LIN28B蛋白在成人头颈部RMS肿瘤组织中呈阳性表达,表现为细胞质染色呈棕黄色(图 1A~1C),在正常横纹肌组织中呈阴性表达(图 1D)。根据组织学评分,22例RMS患者中12例LIN28B呈低表达(0~3分),10例呈高表达(≥4分)。
|
图 1 免疫组织化学染色检测LIN28B蛋白在成人头颈部RMS组织及正常横纹肌组织中的表达 Fig 1 Expression of LIN28B protein in adult head and neck RMS tissues and normal striated muscle tissues determined by immunohistochemistry A-C: Strong (A), medium (B) and weak (C) expression of LIN28B in RMS tissues; D: Expression of LIN28B in normal striated muscle tissues. LIN28B: lin-28 homolog B; RMS: Rhabdomyosarcoma. Original magnification: ×200 |
2.2 成人头颈部RMS组织中LIN28B表达与患者临床病理特征的关系
如表 1所示,与胚胎性RMS、肿瘤大小≤5 cm的患者相比,LIN28B在非胚胎性RMS、肿瘤大小>5 cm患者的肿瘤组织中表达水平较高(P=0.020、0.030);LIN28B表达与患者性别、年龄、淋巴结转移与否、TNM分期、危险分组及颅底骨质破坏与否无关(P均>0.05)。
|
|
表 1 成人头颈部RMS组织中LIN28B表达与患者临床病理特征的关系 Tab 1 Relationship between LIN28B expression and clinicopathological parameters of adult head and neck RMS patients |
2.3 成人头颈部RMS组织中LIN28B表达与患者生存期的关系
22例RMS患者中位随访时间为78.4(7.6~140.1)个月,至随访截止日期共有18例患者发生疾病进展并死亡,存活的4例患者中3例无病生存。Kaplan-Meier法分析结果(表 2)显示,非胚胎性RMS、高TNM分期、高危险分组及LIN28B高表达患者的中位无进展生存期较短(P均<0.05);高TNM分期及LIN28B高表达患者的中位总生存期较短(P均<0.05)。如图 2A、2B所示,22例RMS患者的中位无进展生存期及中位总生存期分别为12.4个月及17.9个月,5年无进展生存率及总生存率分别为11.4%及13.6%;其中初治无远处转移的18例患者5年无进展生存率及总生存率分别为13.9%及16.7%。LIN28B低表达RMS患者的中位无进展生存期为17.9个月,长于高表达者的8.2个月,差异有统计学意义(P=0.003);LIN28B低表达RMS患者的中位总生存期为23.5个月,长于高表达者的10.9个月,差异有统计学意义(P=0.009)。见图 2C、2D。
|
|
表 2 不同临床病理特征成人头颈部RMS患者的中位无进展生存期和中位总生存期 Tab 2 mPFS and mOS of adult head and neck RMS patients with different clinicopathological parameters |

|
图 2 成人头颈部RMS患者的Kaplan-Meier生存曲线 Fig 2 Kaplan-Meier survival curves of adult head and neck RMS patients A, B: Progression-free survival (A) and overall survival (B) of the whole cohort; C, D: Progression-free survival (C) and overall survival (D) of patients with different LIN28B expression. RMS: Rhabdomyosarcoma; LIN28B: lin-28 homolog B |
3 讨论
RMS是儿童及青少年最常见的软组织肿瘤,占儿童软组织肿瘤的54%~70%;RMS也可发生于成人各年龄阶段,成人RMS约占全部RMS病例的40%[4]。基于风险分层的多学科综合治疗、长程规律化学治疗及放射治疗技术的进展使儿童RMS的疗效明显改善,目前5年总生存率约为60%左右[4, 9]。但是半个世纪以来成人RMS治疗进展甚微,多种细胞毒药物的加入并未转化为患者的明显生存获益,成人RMS的5年总生存率仅为27%[4],这提示其与儿童RMS临床特征及生物学行为不尽相同。35%~40%的成人RMS发生于头颈部,根据肿瘤原发部位和预后差异又分为眼眶部、脑膜旁(包括鼻咽/鼻腔、鼻旁窦、咽旁、颞下窝、中耳/乳突、翼突等)、非眼眶部非脑膜旁RMS[1, 10]。其中原发脑膜旁RMS约占头颈部RMS的50%[4],并且作为明确的预后不良部位被纳入TNM治疗前分期系统。本组RMS患者的原发部位包括鼻咽、鼻腔、筛窦及上颌窦,均是脑膜旁部位,因而本组患者的预后很差,中位无进展生存期及中位总生存期分别为12.4个月及17.9个月,5年总生存率仅为13.6%。其中初治无远处转移的18例患者5年总生存率为16.7%,这与国内上海交通大学医学院附属第九人民医院的单中心回顾性研究结果几乎一致:40例成人脑膜旁RMS患者的5年总生存率为17%[6]。本研究提示肿瘤的组织学类型为非胚胎性、高TNM分期及高危险分组与不良预后有关,但未发现肿瘤大小、局部淋巴结转移与否与生存期有关,这可能是因为本研究样本量较小所致。
LIN28B及其旁系同源物LIN28A是高度保守的RNA结合蛋白,同属于LIN-28家族,其特征是存在1个冷休克结构域和1对CCHC锌指结构域[11]。LIN28家族参与许多生物学过程,包括细胞发育、多能性、重编程和肿瘤发生[11]。LIN28B最早被发现在人类肝细胞癌中过度表达并克隆,现已发现其在多种人恶性肿瘤中介导细胞的恶性转化,促进肿瘤细胞增殖、侵袭、转移,并维持肿瘤细胞的干性[11]。LIN28B可通过直接与mRNA结合或通过阻止微RNA(microRNA,miRNA)的成熟从而调节基因表达,其潜在机制包括let-7依赖性通路和let-7非依赖性通路[8, 12]。人类有13个密切相关的let-7家族成员,介导了重要的生物学功能。LIN28B可通过阻断抑癌基因let-7 miRNA家族的成熟抑制细胞增殖、促进分化及抑制胰岛素受体底物(insulin receptor substrate,IRS)、Akt、鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)、高迁移率族蛋白A2(high mobility group AT-hook 2,HMGA2)、重组人N-myc原癌基因蛋白(recombinant human N-myc proto-oncogene protein,MYCN)等的表达,从而抑制PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、Ras/MAPK等信号通路[8],此即let-7依赖性通路。此外,LIN28B可通过直接结合mRNA调节转录后翻译而调控基因表达,即let-7非依赖性通路。如在乳腺癌细胞中LIN28B可与人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)mRNA结合促进HER2表达,从而促进恶性表型[13]。上述2种调控机制也可能并存,如视神经母细胞瘤中既存在LIN28B通过let-7调控下游RAN结合蛋白2(RAN binding protein 2,RANBP2),也存在LIN28B直接与mRNA结合调控基因表达[14]。
大量研究表明LIN28B在多种人肿瘤组织及细胞系中高表达,是多种肿瘤的预后因子。目前已发现LIN28B在3个胚层起源的多种成人进展期恶性肿瘤中均有高表达,如肝细胞癌、食管癌、胃癌、结肠癌、肺癌、乳腺癌、卵巢癌及口腔鳞癌等,并且与不良预后有关[12]。Wu等[15]报道72例口腔鳞癌中LIN2B表达水平升高,并且与性别、肿瘤分化及患者生存有关。Wang等[16]发现正常口腔上皮中LIN28B呈阴性或低表达,而在7, 12-二甲基苯并蒽(7, 12-dimethyl-1, 2-benzanthracene,DMBA)诱导的口腔鳞癌模型中,上皮不典型增生和侵袭性癌组织中LIN28B表达增高;在67.2%(39/58)的口腔鳞癌患者中检测到LIN28B高表达,并与肿瘤大小及临床分期显著相关;LIN28B高表达者的总生存期明显缩短,LIN28B表达水平是患者总生存的独立预后因素。另有研究发现LIN28B的表达水平与胃癌患者总生存期呈负相关;相比胃上皮细胞,胃癌细胞中LIN28B的表达水平显著增加;LIN28B过表达增加了胃癌细胞的球体形成及胃癌干性相关标志物的表达,并降低了胃癌细胞对顺铂的敏感性[17]。Zhang等[18]的meta分析显示,LIN28B表达增加与恶性肿瘤患者缩短的总生存期和无复发生存期/无病生存期/无进展生存期显著相关,合并HR分别为1.72(95% CI 1.43~2.08)和2.35(95% CI 1.61~3.43)。本研究结果显示,LIN28B高表达是患者预后不良指标之一,这一发现与此前在其他多种实体肿瘤中的报道一致,即成人头颈部RMS患者中存在LIN28B高表达者更容易发生疾病进展、总生存期更短。
综上所述,成人头颈部RMS中肿瘤干细胞标志物LIN28B的表达与肿瘤大小及组织学类型有关,LIN28B表达水平可以作为判断成人头颈部RMS预后的指标之一。后续研究将进一步在分子水平探讨LIN28B对RMS细胞系的影响及作用机制,以期为RMS的治疗提供新靶点。
| [1] |
CASEY D L, WOLDEN S L. Rhabdomyosarcoma of the head and neck: a multimodal approach[J]. J Neurol Surg B Skull Base, 2018, 79: 58-64. DOI:10.1055/s-0037-1617450 |
| [2] |
JO V Y, FLETCHER C D. WHO classification of soft tissue tumours: an update based on the 2013 (4th) edition[J]. Pathology, 2014, 46: 95-104. DOI:10.1097/PAT.0000000000000050 |
| [3] |
AMER K M, THOMSON J E, CONGIUSTA D, DOBITSCH A, CHAUDHRY A, LI M, et al. Epidemiology, incidence, and survival of rhabdomyosarcoma subtypes: SEER and ICES database analysis[J]. J Orthop Res, 2019, 37: 2226-2230. DOI:10.1002/jor.24387 |
| [4] |
SULTAN I, QADDOUMI I, YASER S, RODRIGUEZ-GALINDO C, FERRARI A. Comparing adult and pediatric rhabdomyosarcoma in the surveillance, epidemiology and end results program, 1973 to 2005: an analysis of 2, 600 patients[J]. J Clin Oncol, 2009, 27: 3391-3397. DOI:10.1200/JCO.2008.19.7483 |
| [5] |
PENG K A, GROGAN T, WANG M B. Head and neck sarcomas: analysis of the SEER database[J]. Otolaryngol Head Neck Surg, 2014, 151: 627-633. DOI:10.1177/0194599814545747 |
| [6] |
WU Y, LI C, ZHONG Y, GUO W, REN G. Head and neck rhabdomyosarcoma in adults[J]. J Craniofac Surg, 2014, 25: 922-925. DOI:10.1097/SCS.0000000000000704 |
| [7] |
SEKI M, NISHIMURA R, YOSHIDA K, SHIMAMURA T, SHIRAISHI Y, SATO Y, et al. Integrated genetic and epigenetic analysis defines novel molecular subgroups in rhabdomyosarcoma[J/OL]. Nat Commun, 2015, 6: 7557. doi: 10.1038/ncomms8557.
|
| [8] |
WANG T, WANG G, HAO D, LIU X, WANG D, NING N, et al. Aberrant regulation of the LIN28A/LIN28B and let-7 loop in human malignant tumors and its effects on the hallmarks of cancer[J/OL]. Mol Cancer, 2015, 14: 125. doi: 10.1186/s12943-015-0402-5.
|
| [9] |
PEREZ E A, KASSIRA N, CHEUNG M C, KONIARIS L G, NEVILLE H L, SOLA J E. Rhabdomyosarcoma in children: a SEER population based study[J/OL]. J Surg Res, 2011, 170: e243-e251. doi: 10.1016/j.jss.2011.03.001.
|
| [10] |
TURNER J H, RICHMON J D. Head and neck rhabdomyosarcoma: a critical analysis of population-based incidence and survival data[J]. Otolaryngol Head Neck Surg, 2011, 145: 967-973. DOI:10.1177/0194599811417063 |
| [11] |
ZHOU J, NG S B, CHNG W J. LIN28/LIN28B: an emerging oncogenic driver in cancer stem cells[J]. Int J Biochem Cell Biol, 2013, 45: 973-978. DOI:10.1016/j.biocel.2013.02.006 |
| [12] |
TSIALIKAS J, ROMER-SEIBERT J. LIN28: roles and regulation in development and beyond[J]. Development, 2015, 142: 2397-2404. DOI:10.1242/dev.117580 |
| [13] |
FENG C, NEUMEISTER V, MA W, XU J, LU L, BORDEAUX J, et al. Lin28 regulates HER2 and promotes malignancy through multiple mechanisms[J]. Cell Cycle, 2012, 11: 2486-2494. DOI:10.4161/cc.20893 |
| [14] |
SCHNEPP R W, KHURANA P, ATTIYEH E F, RAMAN P, CHODOSH S E, OLDRIDGE D A, et al. A LIN28B-RAN-AURKA signaling network promotes neuroblastoma tumorigenesis[J]. Cancer Cell, 2015, 28: 599-609. DOI:10.1016/j.ccell.2015.09.012 |
| [15] |
WU T, JIA J, XIONG X, HE H, BU L, ZHAO Z, et al. Increased expression of Lin28B associates with poor prognosis in patients with oral squamous cell carcinoma[J/OL]. PLoS One, 2013, 8: e83869. doi: 10.1371/journal.pone.0083869.
|
| [16] |
WANG D, ZHU Y, WANG Y, LI Z, YUAN C, ZHANG W, et al. The pluripotency factor LIN28B is involved in oral carcinogenesis and associates with tumor aggressiveness and unfavorable prognosis[J/OL]. Cancer Cell Int, 2015, 15: 99. doi: 10.1186/s12935-015-0252-7.
|
| [17] |
WANG X, HU H, LIU H. RNA binding protein Lin28B confers gastric cancer cells stemness via directly binding to NRP-1[J]. Biomed Pharmacother, 2018, 104: 383-389. DOI:10.1016/j.biopha.2018.05.064 |
| [18] |
ZHANG J, XU A, MIAO C, YANG J, GU M, SONG N. Prognostic value of Lin28A and Lin28B in various human malignancies: a systematic review and meta-analysis[J/OL]. Cancer Cell Int, 2019, 19: 79. doi: 10.1186/s12935-019-0788-z.
|
 2020, Vol. 41
2020, Vol. 41


