2. 武警内蒙古总队医院妇产科, 呼和浩特 010040;
3. 海军军医大学(第二军医大学)长征医院麻醉科, 上海 200003
2. Department of Obstetrics and Gynecology, Inner Mongolia Autonomous Region Corps Hospital of Chinese People's Armed Police Force, Hohhot 010040, Inner Mongolia Autonomous Region, China;
3. Department of Anesthesiology, Changzheng Hospital, Naval Medical University(Second Military Medical University), Shanghai 200003, China
卵巢颗粒细胞与卵巢功能的维持有着密切关系[1-2],因此其在卵巢功能特别是卵巢早衰的研究中具有重要价值。大鼠卵巢颗粒细胞是进行卵巢早衰相关研究的重要工具和载体,高效、简便的颗粒细胞分离方式是开展相关实验的重要基础与前提。机械法是目前大鼠卵巢颗粒细胞的主要分离方法[3-4],而胰酶法[5]作为近年出现的一种新方法,在卵巢颗粒细胞的分离中应用较少。本研究通过比较这2种分离方法分离的大鼠卵巢颗粒细胞的数量、增殖活力和激素分泌功能,探讨胰酶法分离大鼠卵巢颗粒细胞的优势。
1 材料和方法 1.1 实验动物选用3~4周龄、体质量50~60 g的SPF级雌性SD大鼠10只[上海西普尔-必凯实验动物有限公司,动物生产许可证号:SCXK(沪)2013-0016],于温度21~25 ℃、相对湿度50%~70%的条件下饲养于标准塑料笼内,每笼5只,每日光照12 h,自由摄食饮水,适应性喂养1周后开始实验。
1.2 实验药物、试剂与仪器DMEM/F12培养液(货号12400-024)、无支原体FBS(货号16000-044)、0.25%胰酶(货号25200072)、青-链霉素(货号15070063)均购自美国Gibco公司,孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG;货号P9970)购自北京索莱宝科技有限公司,CCK-8试剂盒(货号C0043)、H-E染色试剂盒(货号C0105)、DAB显色试剂盒(货号P0202)购自上海碧云天生物技术有限公司,抗卵泡刺激素受体(follicle-stimulating hormone receptor,FSHR)兔多克隆抗体(货号ab103874)购自英国Abcam公司,雌二醇(货号SBJ-R0048)和孕酮(货号SBJ-R0697)ELISA检测试剂盒购自南京森贝伽生物科技有限公司。主要仪器包括解剖显微镜、倒置显微镜、光学显微镜(日本Olympus公司),CO2培养箱(美国Thermo Forma公司),全自动酶标仪(美国Thermo公司),离心机(湖南湘仪实验室仪器开发有限公司),GC_911型γ放射免疫计数器(上海中佳光电仪器分公司)等。
1.3 卵巢颗粒细胞的分离与培养将10只SD大鼠随机分为两组,每组5只,分别采用机械法和胰酶法分离卵巢颗粒细胞。将每只SD大鼠一次性皮下注射PMSG 40 IU,48 h后采用颈椎脱臼法处死,然后将处死的大鼠以75%乙醇浸泡3 min消毒,在无菌条件下迅速剖取卵巢,并放入预冷的无菌PBS中,去除卵巢周围的脂肪组织和表面的包膜,用PBS清洗后置于预冷的DMEM/F12培养液(含10% FBS、100 U/mL青霉素和100 U/mL链霉素)中,然后分别按照机械法和胰酶法分离卵巢颗粒细胞。
1.3.1 机械法将处理好的卵巢置于40倍解剖显微镜下,用1 mL注射器针头固定并刺破卵巢成熟的卵泡,轻轻推压,使含有卵母细胞及颗粒细胞的卵泡液逸出于DMEM/F12培养液。然后将含有卵巢剩余组织及卵泡液的DMEM/F12培养液用200目滤网过滤,滤液以1 200×g离心5 min,弃去上清液后,加入5 mL DMEM/F12培养液,用吸管轻轻吹打数次,制成颗粒细胞悬液,锥虫蓝染色计数后,置于培养箱(37 ℃、5% CO2、饱和湿度)中培养,每隔48 h更换1次培养液,并于倒置显微镜下观察、拍照。
1.3.2 胰酶法在无菌净化台中,将处理好的卵巢取出置于3.5 cm培养皿中,用无菌眼科剪将卵巢剪成小于2 mm3的小碎块,加入0.25%胰酶(含0.01% EDTA),室温消化1 h,每10 min晃动1次。然后将含有卵巢碎块的消化液用200目滤网过滤,其余步骤同机械法。
1.4 大鼠卵巢颗粒细胞的鉴定 1.4.1 H-E染色观察颗粒细胞的形态于24孔板中接种重悬的大鼠卵巢颗粒细胞,接种密度为1×105/孔,置于培养箱(37 ℃、5% CO2、饱和湿度)中培养,当细胞铺满70%~80%盖玻片时,取出玻片;PBS洗涤玻片3次,每次5 min;4%多聚甲醛固定玻片20 min,再次PBS洗涤玻片3次,每次5 min;加入苏木精染色2 min,流水冲去浮色;盐酸乙醇分色数秒,流水冲洗3 min;加入5%伊红染色2~3 min,流水冲去浮色;梯度乙醇脱水,二甲苯透明,中性树脂封片后镜下观察细胞形态。
1.4.2 免疫细胞化学染色观察颗粒细胞的FSHR表达爬片制作同前,以4%多聚甲醛固定20 min,然后进行免疫细胞化学染色。PBS洗涤玻片3次,每次5 min;加入3%过氧化氢室温下孵育5 min,PBS洗涤玻片3次,每次5 min;以正常的山羊血清封闭无关抗原,室温下孵育20 min,倾去不洗;滴加一抗FSHR兔多克隆抗体(1:200)于玻片上,并置于湿盒中4 ℃过夜,PBS洗涤玻片3次,每次5 min;滴加二抗IgG,37 ℃孵育60 min;PBS洗涤玻片3次,每次5 min。滴加HRP标记的链霉素工作液50 μL,37 ℃孵育30 min;PBS洗涤玻片3次,每次5 min。滴加DAB显色液,镜下控制显色时间;流水冲洗,苏木精复染10 min;流水冲洗3次;常规梯度乙醇脱水,二甲苯透明,中性树脂封片后镜下观察FSHR表达情况。
1.5 CCK-8法检测大鼠卵巢颗粒细胞增殖活力将原代大鼠卵巢颗粒细胞接种于96孔板(1×105/孔),每孔100 μL,置于培养箱(37 ℃、5% CO2、饱和湿度)中培养,之后每24 h测定1次,连续测定9 d,每个时间点设5个复孔。检测时每孔加入CCK-8试剂10 μL,继续培养4 h,用酶标仪于450 nm处测定光密度(D)值,取平均值计算细胞增殖率:细胞增殖率(%)=处理时间组D值/24 h对照组D值×100%。以细胞增殖率为纵坐标、时间为横坐标绘制细胞生长曲线。
1.6 ELISA法检测大鼠卵巢颗粒细胞激素分泌将原代大鼠卵巢颗粒细胞接种于24孔板(1×105/孔),每孔l mL,每组设3个复孔,用含10% FBS的DMEM/F12培养液培养细胞[含100 ng/mL卵泡刺激素(follicle-stimulating hormone,FSH)],置于培养箱(37 ℃、5% CO2、饱和湿度)中培养,每隔24 h进行换液,并收集培养液置于-80 ℃保存,连续收集9 d。最后按照ELISA检测试剂盒说明书检测颗粒细胞中雌二醇和孕酮的含量。
1.7 统计学处理应用SPSS 23.0软件进行统计分析和描述,应用Graphpad Prism 8软件作图。计量资料以x±s表示,采用独立样本t检验或重复测量设计的方差分析进行比较。检验水准(α)为0.05。
2 结果 2.1 大鼠卵巢颗粒细胞的鉴定H-E染色结果(图 1A)显示,机械法和胰酶法分离的大鼠卵巢颗粒细胞在镜下均可见到以下特点:细胞体积较大,为贴壁细胞,呈多角梭状,大小均一,形态完整,边缘清晰;细胞质及细胞核染色均匀,核为深蓝色,位于细胞中央,呈卵圆形或不规则形;胞质淡红色,其内含有许多颗粒。这些特点与文献报道[6]一致。免疫细胞化学染色结果(图 1B)显示,卵巢颗粒细胞的特异性标志物FSHR阳性染色主要定位于细胞质,呈棕褐色着染,细胞核呈深蓝色。机械法和胰酶法分离的颗粒细胞镜下FSHR阳性率分别达(92.00±0.45)%、(93.00±0.78)%,表明这2种方法分离培养的颗粒细胞纯度均很高。
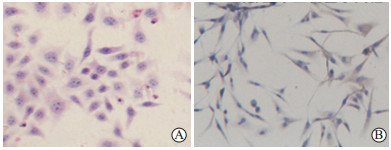
|
图 1 大鼠卵巢颗粒细胞的鉴定 Fig 1 Identification of rat ovarian granulosa cells A: H-E staining (cells were isolated by mechanical method); B: Immunocytochemistry staining of FSHR (cells were isolated by trypsin method). FSHR: Follicle-stimulating hormone receptor. Original magnification: ×200 (A), ×400 (B) |
2.2 2种方法分离的大鼠卵巢颗粒细胞的生长对比
锥虫蓝染色结果表明,机械法和胰酶法分离培养的大鼠卵巢颗粒细胞存活率均>90%。初始阶段镜下观察细胞均呈小圆形或椭圆形,表面可见黑色颗粒。于倒置显微镜下观察细胞生长情况,胰酶法分离的颗粒细胞培养24 h后开始贴壁,而机械法分离的颗粒细胞约36 h才开始贴壁。细胞贴壁后呈多角梭状生长,细胞核大而圆,胞质中富含空泡,细胞间通过丝状伪足相互连接,聚集生长。胰酶法分离的颗粒细胞培养96 h基本铺满培养皿(图 2),而机械法分离的颗粒细胞约120 h才铺满培养皿。

|
图 2 胰酶法分离的大鼠卵巢颗粒细胞培养96 h的生长情况 Fig 2 Growth of rat ovarian granulosa cells isolated by trypsin method cultured for 96 h Original magnification: ×200 |
CCK-8法检测结果显示,机械法和胰酶法分离的大鼠卵巢颗粒细胞的生长曲线具有明显的区别(图 3)。具体表现为:初始培养至24 h,2种方法分离的颗粒细胞均为细胞贴壁生长适应期;培养至48 h,胰酶法分离的颗粒细胞增殖率开始明显增高[(140.09±0.91)%]并迅速进入对数生长期,而机械法分离的颗粒细胞增殖率尚未明显增高[(109.97±0.90)%]。
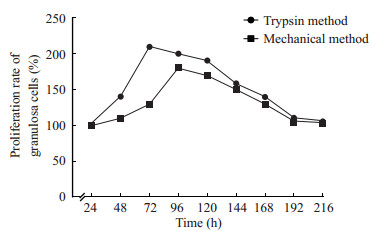
|
图 3 2种方法分离的大鼠卵巢颗粒细胞增殖率比较 Fig 3 Comparison of proliferation rate of rat ovarian granulosa cells isolated by two methods n=5, x±s |
培养至72 h,胰酶法分离的颗粒细胞增殖率达到最大值[(210.09±0.95)%],而机械法分离的颗粒细胞增殖率才开始明显增高[(129.84±1.09)%]并进入对数生长期。培养至96 h,胰酶法分离的颗粒细胞生长密度达到顶峰并进入平台期,细胞增殖率为[(200.30±0.66)%],而机械法分离的颗粒细胞增殖率达到最大值[(180.50±0.74)%]。培养至120 h,胰酶法分离的颗粒细胞增殖率逐渐下降[(190.47±0.73)%],而机械法分离的颗粒细胞生长密度达到顶峰并进入平台期,细胞增殖率为[(170.41±0.86)%]。培养168 h以后,2种方法培养的颗粒细胞的增殖率均逐渐下降,并且均开始出现退化。统计分析结果表明,胰酶法分离的细胞最大增殖率[72 h:(210.09±0.95)%]高于机械法分离的细胞最大增殖率[96 h:(180.50±0.74)%],差异具有统计学意义(P<0.05)。
2.3 2种方法分离的大鼠卵巢颗粒细胞的激素分泌对比ELISA法检测结果(图 4)显示,机械法和胰酶法分离的原代颗粒细胞雌二醇和孕酮的分泌趋势与细胞的生长情况基本一致;胰酶法分离的细胞分泌激素的最大值出现在120 h,而机械法出现在144 h。胰酶法分离的细胞激素的最大分泌量、每日平均分泌量及分泌总量均高于机械法,差异均有统计学意义(P均<0.05,表 1)。
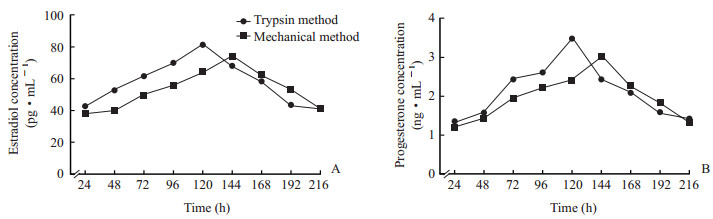
|
图 4 2种方法分离的大鼠卵巢颗粒细胞雌二醇和孕酮分泌的比较 Fig 4 Comparison of estradiol and progesterone secretion in rat ovarian granulosa cells isolated by two methods A: Estradiol; B: Progesterone. n=3, x±s |
|
|
表 1 2种方法分离的大鼠卵巢颗粒细胞中雌二醇和孕酮最大分泌量、每日平均分泌量及分泌总量比较 Tab 1 Comparison of maximum, average daily and total secretion of estradiol and progesteronein rat ovarian granulosa cells isolated by two methods |
3 讨论
早发性卵巢功能不全是卵巢早衰的前驱阶段,其发病率呈上升趋势[7]。颗粒细胞是卵泡内最主要的功能细胞,其生长、增殖与卵巢功能关系密切,通常被作为最主要的对象和载体用于卵巢早衰的研究。高效、便捷地建立颗粒细胞分离和培养体系是此类研究顺利开展的前提与保证。应用机械法分离大鼠卵巢颗粒细胞已有大量的文献[8-9]报道,而应用胰酶法分离大鼠卵巢颗粒细胞的文献报道并不多见。胰酶法不需要解剖显微镜,所需设备简单,而胰酶本身又是培养细胞所必需的试剂,容易获得、使用方便,因此相对于机械法来讲,胰酶法具有操作简便、快捷等优势。
参考既往文献[10]报道的方法,本研究采用PMSG刺激3~4周龄雌性SD大鼠。PMSG能使幼年大鼠处于动情前期,与成年大鼠相比,其体内的卵巢颗粒细胞没有受到过内源性促性腺激素的作用,这样获得的颗粒细胞处于相同的发育阶段,有利于各项实验的开展。颗粒细胞是卵巢内唯一表达FSHR的细胞[11],利用FSHR免疫细胞化学染色可以对卵巢颗粒细胞进行鉴定。本研究实验结果显示,机械法和胰酶法这2种方法分离的细胞镜下FSHR的阳性率均达到90%以上,表明这2种方法均可以有效地获得卵巢颗粒细胞。2种方法分离的原代颗粒细胞存活率均>90%,但胰酶法分离的颗粒细胞增殖率峰值出现时间早于机械法24 h,细胞增殖率高于机械法,雌二醇和孕酮的分泌量也大于机械法。由此可见,胰酶法分离的大鼠卵巢颗粒细胞的增殖速度及激素分泌功能优于机械法,其原因可能为细胞分离时,机械法对细胞的损伤大于胰酶法,而胰酶法能够通过更加温和的方式将颗粒细胞从卵巢组织中消化分离下来,从而使细胞获得更强的增殖活力,其具体机制尚需在今后的实验中进一步探讨。
总之,本研究表明机械法和胰酶法均可有效地分离大鼠卵巢颗粒细胞,但胰酶法具有操作简便、设备简单的优点,其分离的细胞增殖活力高、激素分泌量大,更便于实验的高效开展,值得在卵巢早衰的研究中推广使用。
| [1] |
HAVELOCK J C, RAINEY W E, CARR B R. Ovarian granulosa cell lines[J]. Mol Cell Endocrinol, 2004, 228(1/2): 67-78. |
| [2] |
卢翠玲, 杨巍, 胡召元, 刘以训. 颗粒细胞的增殖分化及其在卵泡发育中的作用[J]. 科学通报, 2005, 50: 2341-2347. DOI:10.3321/j.issn:0023-074X.2005.21.002 |
| [3] |
许川, 舒为群, 张亮, 曾佳, 周新. 大鼠卵巢颗粒细胞的原代培养与鉴定[J]. 癌变·畸变·突变, 2009, 21: 234-237. DOI:10.3969/j.issn.1004-616X.2009.03.019 |
| [4] |
张天宝, 杨在昌. 大鼠卵巢细胞体外培养及生殖毒理研究中的应用[J]. 卫生毒理学杂志, 1997, 11: 128-130. |
| [5] |
SUN L, LI D, SONG K, WEI J, YAO S, LI Z, et al. Exosomes derived from human umbilical cord mesenchymal stem cells protect against cisplatin-induced ovarian granulosa cell stress and apoptosis in vitro[J/OL]. Sci Rep, 2017, 7: 2552. doi: 10.1038/s41598-017-02786-x.
|
| [6] |
RUSSINOVA A, VASSILEV A, DAVIDOFF M. Localization and partial characterization of a rat ovarian granulosa cell protein with a monoclonal antibody[J]. Biol Cell, 1993, 79: 259-264. DOI:10.1016/0248-4900(93)90145-5 |
| [7] |
EBRAHIMI M, AKBARI ASBAGH F. Pathogenesis and causes of premature ovarian failure: an update[J]. Int J Fertil Steril, 2011, 5: 54-65. |
| [8] |
CHEN X, WANG Q, LI X, WANG Q, XIE J, FU X. Heat shock pretreatment of mesenchymal stem cells for inhibiting the apoptosis of ovarian granulosa cells enhanced the repair effect on chemotherapy-induced premature ovarian failure[J/OL]. Stem Cell Res Ther, 2018, 9: 240. doi: 10.1186/s13287-018-0964-4.
|
| [9] |
温海霞, 张亚楠. Genistein对雌性大鼠卵巢颗粒细胞FSHR 基因表达的影响[J]. 中国医药导报, 2019, 16: 16-18. |
| [10] |
LOVEKAMP T N, DAVIS B J. Mono-(2-ethylhexyl) phthalate suppresses aromatase transcript levels and estradiol production in cultured rat granulosa cells[J]. Toxicol Appl Pharmacol, 2001, 172: 217-224. DOI:10.1006/taap.2001.9156 |
| [11] |
SIMONI M, GROMOLL J, NIESCHLAG E. The follicle-stimulating hormone receptor: biochemistry, molecular biology, physiology, and pathophysiology[J]. Endocr Rev, 1997, 18: 739-773. |
 2020, Vol. 41
2020, Vol. 41


