2. 上海中医药大学附属第七人民医院皮肤科, 上海 200137
2. Department of Dermatology, Seventh People's Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 200137, China
脓毒症是一种由细菌、病毒或真菌等感染引起的全身炎症反应,可发展为由多因素参与、多器官受累的复杂综合征,是目前世界上ICU及创伤外科等科室最常见的医学治疗难题之一[1]。全球每年患有脓毒症的人口总数约1 800万(约占世界总人口的0.3%),并以每年1.5%的速度增长;每年死于该病的人口总数约20万,且仍逐年增加[2]。因此,积极探索脓毒症相关的新颖且可靠的生物标志物对提高诊断率、促进预后非常必要。
miRNA是一类由19~23个核苷酸组成的非编码RNA,可通过与下游靶基因mRNA 3′端非翻译区结合调控转录后靶基因的表达,从而发挥生物学功能[3]。据报道,miRNA与多种炎症相关疾病的病理生理过程关系密切,且扮演着至关重要的角色[4-5]。miRNA-146a是第1个被发现在免疫应答中具有调节作用的miRNA,位于第5号染色体(5q33.3),能通过降低Toll样受体4信号通路上的白细胞介素1受体相关激酶1(interleukin 1 receptor-associated kinase 1,IRAK1)及肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)负性调控NF-κB介导的炎症通路,从而下调炎性因子的释放[6-7]。此外,大量研究发现miRNA-146a在多种免疫炎症相关的疾病中表达异常,如炎症性肠病、银屑病及狼疮性肾炎等[8-10]。然而,对于常见的全身炎症性疾病脓毒症而言,miRNA-146a的作用尚不明确。本研究旨在评估脓毒症患者血浆miRNA-146a表达水平与患病风险、炎性因子水平及预后的相关性。
1 资料和方法 1.1 研究对象连续纳入2015年10月至2017年3月于海军军医大学(第二军医大学)附属公利医院急诊科和ICU就诊的脓毒症患者132例。纳入标准:(1)符合2001年国际脓毒症定义会议关于脓毒症诊断的标准[11];(2)年龄≥18周岁。排除标准:(1)合并恶性肿瘤、严重心脑血管疾病、HIV或丙型肝炎病毒(hepatitis C virus,HCV)感染、恶性血液系统疾病者;(2)入院前3个月内大剂量服用糖皮质激素(>200 mg/d)或免疫抑制剂者;(3)终末期肝或肾功能衰竭患者;(4)妊娠期或哺乳期患者。纳入131例同期于海军军医大学(第二军医大学)附属公利医院健康体检中心接受健康体检且年龄和性别与脓毒症患者相匹配的健康人群作为健康对照。所有入组的健康对照年龄均≥18周岁,肝肾功能正常,无任何肿瘤、严重感染、免疫系统疾病和血液疾病史,且在体检前3个月内未使用过任何糖皮质激素或免疫抑制剂类药物,同时妊娠期和哺乳期妇女予以排除。本研究通过海军军医大学(第二军医大学)附属公利医院伦理委员会审批,所有受试者或其法定监护人均签署了知情同意书。
1.2 信息收集详细记录所有入组脓毒症患者的人口学信息、临床病理特征及生物化学指标检测结果,包括年龄、性别、BMI、白细胞计数和血肌酐、白蛋白、CRP水平。急性生理功能和慢性健康状况由主治医师依据急性生理功能和慢性健康状况Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分系统评定。健康对照的年龄、性别、BMI等基本信息从健康体检中心获得。
1.3 样本采集所有脓毒症患者在进入ICU后24 h内进行血液样本采集,将采集到的血液样本分为2份,一份直接离心分离获取血清,用于检测炎性因子水平;另一份抗凝后离心分离获取血浆,用于检测miRNA-146a。健康对照在健康体检中心进行血液采集,将采集到的血液样本进行离心分离获取血浆,用于检测miRNA-146a。
1.4 qRT-PCR检测血浆miRNA-146a表达采用TRIzol抽提试剂盒(日本TaKaRa公司)提取血浆总RNA,置于-80 ℃保存(防降解)。采用Primer Script实时反转录试剂盒(日本TaKaRa公司)进行反转录获得cDNA,以cDNA为模板、U6为内参照进行qRT-PCR。反应条件:95 ℃ 3 min;94 ℃ 20 s、62 ℃ 40 s,循环40次。采用2-ΔΔCt法进行结果分析。引物序列:miRNA-146a正义引物5′-ACA CTC CAG CTG GGG AAC TGA ATT CCA TGG G-3′,反义引物5′-TGT CGT GGA GTC GGC AAT TC-3′;U6正义引物5′-CTC GCT TCG GCA GCA CAT A-3′,反义引物5′-CTC GCT TCG GCA GCA CAT A-3′。
1.5 ELISA检测血清炎性因子水平采用ELISA试剂盒(美国R & D公司)检测血清中炎性因子水平,包括CRP、TNF-α、IL-1β、IL-6、IL-8及IL-10。
1.6 统计学处理应用SPSS 22.0软件和GraphPad Prism 6.0软件进行统计学分析。呈正态分布的计量资料以x±s表示,呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,计数资料以例数和百分数表示。脓毒症患者和健康对照基线资料的比较采用独立样本t检验或χ2检验,血浆miRNA-146a表达的比较采用Wilcoxon秩和检验;血浆miRNA-146a表达与患者临床病理特征和生物化学指标的相关性分析采用Spearman相关分析;血浆miRNA-146a表达对脓毒症的诊断效能和预后价值采用ROC曲线及AUC进行评估;血浆miRNA-146a表达对脓毒症风险的预测效能采用单元和多元logistic回归模型进行评估。检验水准(α)为0.05。
2 结果 2.1 两组基线资料比较纳入脓毒症患者132例,男86例(65.2%)、女46例(34.8%),年龄为(57.49±8.05)岁,BMI为(24.91±3.89)kg/m2,血肌酐、白蛋白、CRP水平及白细胞计数分别为120.68(86.29,162.41)μmol/L、26.325(22.665,35.049)g/L、44.800(25.750,61.877)mg/L及11.161(3.588,27.839)×109/L,APACHEⅡ评分为16.0(12.5,20.0)分。健康对照131名,男76名(58.0%)、女55名(42.0%),年龄为(56.76±9.15)岁,BMI为(24.27±3.84)kg/m2。两组在年龄、性别、BMI方面的差异均无统计学意义(P均>0.05)。
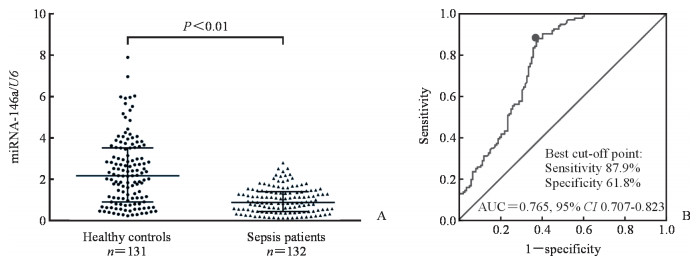
2.2 两组血浆中miRNA-146a的表达及其对脓毒症的诊断价值如图 1A所示,miRNA-146a在脓毒症患者血浆中的表达水平低于健康对照(Z=-7.423,P<0.01)。ROC曲线(图 1B)显示血浆miRNA-146a表达对脓毒症有较好的诊断价值,AUC为0.765(95% CI 0.707~0.823),取约登指数最大值处的界值为最佳诊断界值,此时灵敏度和特异度分别为87.9%和61.8%。
|
图 1 miRNA-146a在脓毒症患者及健康对照血浆中的表达(A)及其对脓毒症的诊断价值(B) Fig 1 Expression of miRNA-146a in plasma of sepsis patients and healthy controls (A) and its diagnostic value for sepsis (B) miRNA: MicroRNA; AUC: Area under curve; CI: Confidence interval |
2.3 脓毒症患病危险因素分析
采用单元logistic回归模型评估影响脓毒症的危险因素,结果显示血浆miRNA-146a表达水平低是脓毒症的危险因素(OR=0.325,95% CI 0.235~0.499,P<0.01)。采用多元logistic回归模型校正年龄、性别和BMI混杂因素后,血浆miRNA-146a表达水平低是脓毒症患病风险的独立预测因素(OR=0.312,95% CI 0.225~0.434,P<0.01)。
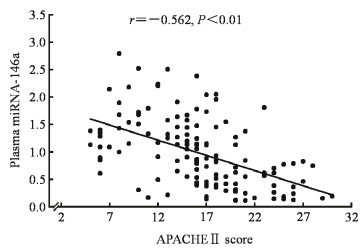
2.4 脓毒症患者血浆miRNA-146a表达与APACHEⅡ评分的相关性分析采用Spearman相关分析评估脓毒症患者血浆miRNA-146a表达和APACHEⅡ评分的相关性,结果(图 2)显示血浆miRNA-146a表达水平与APACHEⅡ评分呈负相关(r=-0.562,P<0.01),表明脓毒症患者血浆miRNA-146a表达水平越高病情越轻。
|
图 2 脓毒症患者血浆miRNA-146a表达和APACHEⅡ评分的Spearman相关分析 Fig 2 Spearman correlation analysis between plasma miRNA-146a and APACHEⅡ score in sepsis patients miRNA: MicroRNA; APACHE Ⅱ: Acute physiology and chronic health evaluation Ⅱ |
2.5 脓毒症患者血浆miRNA-146a表达与血清炎性因子的相关性分析
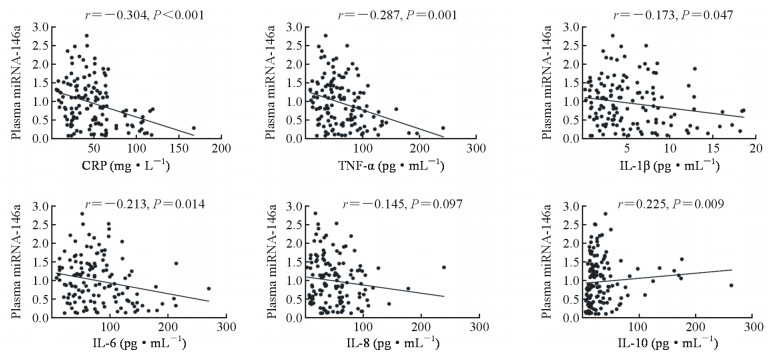
如图 3所示,脓毒症患者血浆miRNA-146a表达水平与血清CRP(r=-0.304,P<0.001)、TNF-α(r=-0.287,P=0.001)、IL-1β(r=-0.173,P=0.047)及IL-6(r=-0.213,P=0.014)呈负相关,与IL-10(r=0.225,P=0.009)呈正相关;脓毒症患者血浆miRNA-146a表达水平与IL-8之间有负相关趋势,但差异无统计学意义(r=-0.145,P=0.097)。
|
图 3 脓毒症患者血浆miRNA-146a表达与血清炎性因子的Spearman相关分析 Fig 3 Spearman correlation analysis between plasma miRNA-146a and serum inflammatory cytokines in sepsis patients miRNA: MicroRNA; CRP: C-reactive protein; TNF-α: Tumor necrosis factor α; IL: Interleukin |
2.6 血浆miRNA-146a表达对脓毒症患者的预后价值
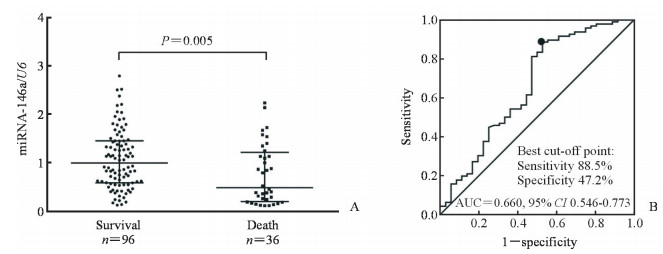
截至2017年4月30日,132例脓毒症患者中96例存活,36例死亡。如图 4A所示,miRNA-146a在脓毒症死亡患者血浆中的表达水平低于存活患者(Z=-2.818,P=0.005)。采用ROC曲线分析血浆miRNA-146a表达对脓毒症患者的预后价值,结果(图 4B)显示血浆miRNA-146a表达在脓毒症患者中具有良好的预后价值,其AUC为0.660(95% CI 0.546~0.773),最佳诊断界值的灵敏度和特异度分别为88.5%和47.2%。
|
图 4 miRNA-146a在存活和死亡脓毒症患者血浆中的表达(A)及其对脓毒症的预后价值(B) Fig 4 Expression of miRNA-146a in plasma of survival and dead sepsis patients (A) and its predictive value for sepsis (B) miRNA: MicroRNA; AUC: Area under curve; CI: Confidence interval |
3 讨论
脓毒症的发病机制非常复杂,可能由于病原体或微生物感染,其内毒素和(或)脂多糖与脂多糖结合蛋白结合形成免疫复合物,随后与单核细胞及巨噬细胞等免疫细胞表面受体结合启动细胞内信号转导通路,促使合成并释放多种炎性介质,继而打破机体促炎和抗炎反应的平衡,导致多器官和多系统病理生理改变,如代谢紊乱、免疫失控和(或)神经-内分泌系统调节异常等[1]。
多种miRNA在炎症反应过程中的各个环节均发挥着重要的调控作用,且其异常表达会导致机体炎性失衡。例如循环miRNA-122a、miRNA-155a、miRNA-29a、miRNA-10a-5p、miRNA-497和miRNA-150等已被证明在脓毒症中表达失调,且部分miRNA可作为脓毒症疾病严重程度或预后的独立预测因子[12-15]。miRNA-146a作为一种内源性非编码小RNA,主要通过促进靶基因的降解和(或)降低靶基因的翻译表达,在免疫和炎症反应调控中发挥着至关重要的作用。其中,miRNA-146a在牛乳腺上皮细胞中可通过抑制TRAF6降低NF-κB的表达水平,从而减少TNF-α、IL-6和IL-8等炎性因子的产生抑制炎症反应[16]。同时,miRNA-146a在巨噬细胞中可通过抑制TRAF6和影响IL-17/细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)信号通路,负向调控多肌炎/皮肌炎(polymyositis/dermatomyositis,PM/DM)的炎性浸润[17]。此外,miRNA-146a可通过减少角质细胞中IL-17的表达降低银屑病中IL-17介导的炎症反应[18]。在人体最重要免疫细胞之一的CD4+ T淋巴细胞中,miRNA-146a还可通过抑制NUMB基因减少甲状腺相关疾病的炎症反应[19]。以上证据表明miRNA-46a可通过调控多种基因或信号通路来减少促炎性因子表达,从而抑制疾病的炎症反应。据报道,血浆miRNA-146a在系统性红斑狼疮患者中的表达水平降低,且与其系统性红斑狼疮疾病活动指数评分、肾脏系统性红斑狼疮疾病活动指数评分均呈负相关[20]。血浆miRNA-146a在骨关节炎患者中的相对表达量也降低,且其在类风湿性关节炎和骨关节炎患者关节滑液中的表达量与关节压痛指数成反比[21-22]。此外,一项动物实验评估了血浆miRNA-146a在脓毒症小鼠模型肺组织中的作用,结果显示体内转染miRNA-146a可减少肺部炎性因子TNF-α的产生,从而减轻肺组织的损伤[23]。以上研究结果提示miRNA-146a可能是多种炎症相关疾病的保护基因。本研究结果也显示,血浆miRNA-146a在脓毒症患者中的表达水平低于健康对照,且其对脓毒症具有良好的诊断价值,可作为低风险患者的独立预测因素;此外,血浆miRNA-146a表达水平与APACHEⅡ评分呈负相关,与促炎细胞因子TNF-α、IL-β、IL-6呈负相关,而与抑炎细胞因子IL-10呈正相关,这可能是由于miRNA-146a可通过调控多种基因和信号通路降低炎性因子表达水平,减轻炎症反应,影响脓毒症的免疫调控。
对于miRNA-146a的预后价值,有研究显示miRNA-146a在多种疾病中可作为良好的预后标志物,如急性早幼粒细胞白血病、非小细胞肺癌或前列腺癌等[24-26]。然而,关于miRNA-146a对免疫系统或炎症相关疾病预后作用的研究却十分稀少,尤其是对于脓毒症的预后价值尚不明确。因此本研究评估了miRNA-146a在脓毒症存活患者及死亡患者血浆中的表达差异及其预后价值,发现miRNA-146a在脓毒症死亡患者血浆中的相对表达量较存活患者降低,且可较好地预测脓毒症患者的预后情况。可能原因是miRNA-146a通过不同的信号通路抑制免疫炎症反应,从而减轻疾病严重程度,使脓毒症患者获得良好预后,甚至减少病死风险。
本研究仍存在一些不足:(1)纳入132例脓毒症患者,样本量相对较小,可能导致统计学效能较低;(2)未涉及miRNA-146a调控脓毒症炎症的具体分子机制,需进一步通过动物模型进行验证;(3)属于单中心研究,有必要纳入更多来自多中心的脓毒症患者以行进一步研究。
综上所述,本研究结果表明血浆miRNA-146a表达水平低是脓毒症患病的独立预测因素,并与疾病严重程度高、炎性因子水平高及预后不良有关。
| [1] |
GOTTS J E, MATTHAY M A. Sepsis: pathophysiology and clinical management[J/OL]. BMJ, 2016, 353: i1585. doi: 10.1136/bmj.i1585.
|
| [2] |
商娜. 脓毒症流行病学研究[J]. 中国急救医学, 2013, 33: 8-12. DOI:10.3969/j.issn.1002-1949.2013.1.003 |
| [3] |
DONG H, LEI J, DING L, WEN Y, JU H, ZHANG X. MicroRNA: function, detection, and bioanalysis[J]. Chem Rev, 2013, 113: 6207-6233. DOI:10.1021/cr300362f |
| [4] |
JIN X, CHEN D, ZHENG R H, ZHANG H, CHEN Y P, XIANG Z. miRNA-133a-UCP2 pathway regulates inflammatory bowel disease progress by influencing inflammation, oxidative stress and energy metabolism[J]. World J Gastroenterol, 2017, 23: 76-86. DOI:10.3748/wjg.v23.i1.76 |
| [5] |
AZIZ F. The emerging role of miR-223 as novel potential diagnostic and therapeutic target for inflammatory disorders[J]. Cell Immunol, 2016, 303: 1-6. DOI:10.1016/j.cellimm.2016.04.003 |
| [6] |
LIU Z, XIAO B, TANG B, LI B, LI N, ZHU E, et al. Up-regulated microRNA-146a negatively modulate Helicobacter pylori-induced inflammatory response in human gastric epithelial cells[J]. Microbes Infect, 2010, 12: 854-863. DOI:10.1016/j.micinf.2010.06.002 |
| [7] |
TAGANOV K D, BOLDIN M P, CHANG K J, BALTIMORE D. NF-κB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses[J]. Proc Natl Acad Sci USA, 2006, 103: 12481-12486. DOI:10.1073/pnas.0605298103 |
| [8] |
BÉRES N J, SZABÓ D, KOCSIS D, SZŰCS D, KISS Z, MÜLLER K E, et al. Role of Altered expression of miR-146a, miR-155, and miR-122 in pediatric patients with inflammatory bowel disease[J]. Inflamm Bowel Dis, 2016, 22: 327-335. DOI:10.1097/MIB.0000000000000687 |
| [9] |
HERMANN H, RUNNEL T, AAB A, BAURECHT H, RODRIGUEZ E, MAGILNICK N, et al. miR-146b probably assists miRNA-146a in the suppression of keratinocyte proliferation and inflammatory responses in psoriasis[J]. J Invest Dermatol, 2017, 137: 1945-1954. DOI:10.1016/j.jid.2017.05.012 |
| [10] |
ZHENG C Z, SHU Y B, LUO Y L, LUO J. The role of miR-146a in modulating TRAF6-induced inflammation during lupus nephritis[J]. Eur Rev Med Pharmacol Sci, 2017, 21: 1041-1048. |
| [11] |
2001年国际脓毒症定义会议关于脓毒症诊断的新标准[J].中国危重病急救医学, 2006, 18: 645.
|
| [12] |
刘志强, 梁璐, 薛华, 于占彪, 瞿海龙, 王子琪, 等. 血浆miRNA-122a miRNA-146a miRNA-155a对脓毒症诊断及预后评估价值的研究[J]. 中国急救医学, 2017, 37: 492-496. DOI:10.3969/j.issn.1002-1949.2017.06.004 |
| [13] |
霍锐, 戴敏, 樊艺, 周竞峥, 李莉, 祖建. miRNA-29a和miRNA-10a-5p对脓毒症所致急性肾损伤患者28 d死亡率的预测[J]. 南方医科大学学报, 2017, 37: 646-651. DOI:10.3969/j.issn.1673-4254.2017.05.13 |
| [14] |
吴忠璟, 陈亚凤, 王海岛, 高芳虹. 血浆miRNA-497在小儿脓毒症心肌损伤中的表达及其临床意义[J]. 中国当代儿科杂志, 2018, 20: 32-36. DOI:10.7499/j.issn.1008-8830.2018.01.007 |
| [15] |
余洁, 乔忠祥, 周汉明, 张剑锋. miRNA-150、miRNA-146a在脓毒症患儿血清中的表达及其临床意义[J]. 医学临床研究, 2017, 34: 444-447. |
| [16] |
WANG X P, LUORENG Z M, ZAN L S, LI F, LI N. Bovine miR-146a regulates inflammatory cytokines of bovine mammary epithelial cells via targeting the TRAF6 gene[J]. J Dairy Sci, 2017, 100: 7648-7658. DOI:10.3168/jds.2017-12630 |
| [17] |
YIN Y, LI F, SHI J, LI S, CAI J, JIANG Y. MiR-146a regulates inflammatory infiltration by macrophages in polymyositis/dermatomyositis by targeting TRAF6 and affecting IL-17/ICAM-1 pathway[J]. Cell Physiol Biochem, 2016, 40: 486-498. DOI:10.1159/000452563 |
| [18] |
SRIVASTAVA A, NIKAMO P, LOHCHAROENKAL W, LI D, MEISGEN F, XU LANDÉN N, et al. MicroRNA-146a suppresses IL-17-mediated skin inflammation and is genetically associated with psoriasis[J]. J Allergy Clin Immunol, 2017, 139: 550-561. DOI:10.1016/j.jaci.2016.07.025 |
| [19] |
HU Z J, HE J F, LI K J, CHEN J, XIE X R. Decreased microRNA-146a in CD4+ T cells promote ocular inflammation in thyroid-associated ophthalmopathy by targeting NUMB[J]. Eur Rev Med Pharmacol Sci, 2017, 21: 1803-1809. |
| [20] |
TANG Y, LUO X, CUI H, NI X, YUAN M, GUO Y, et al. MicroRNA-146A contributes to abnormal activation of the type Ⅰ interferon pathway in human lupus by targeting the key signaling proteins[J]. Arthritis Rheum, 2009, 60: 1065-1075. DOI:10.1002/art.24436 |
| [21] |
杨国红, 闵继康, 杨红航, 李丽琴, 戴利成, 李恒. 血浆微小RNA-146a在骨关节炎早期诊断中的作用及机制[J]. 中华实验外科杂志, 2017, 34: 1589-1592. DOI:10.3760/cma.j.issn.1001-9030.2017.09.048 |
| [22] |
MURATA K, YOSHITOMI H, TANIDA S, ISHIKAWA M, NISHITANI K, ITO H, et al. Plasma and synovial fluid microRNAs as potential biomarkers of rheumatoid arthritis and osteoarthritis[J/OL]. Arthritis Res Ther, 2010, 12: R86. doi: 10.1186/ar3013.
|
| [23] |
张建国, 丁成志, 邵强, 刘芬, 曾振国, 聂成, 等. 体内转染微小RNA-146a对脓毒症小鼠肺的保护作用[J]. 中华危重病急救医学, 2015, 27: 591-594. DOI:10.3760/cma.j.issn.2095-4352.2015.07.010 |
| [24] |
XU L, ZHONG H, WAN H, CHEN F Y, ZHONG J, XIAO F, et al. miR-146a expression level as a novel putative prognostic marker for acute promyelocytic leukemia[J/OL]. Dis Markers, 2014, 2014: 150604. doi: 10.1155/2014/150604.
|
| [25] |
WU C, CAO Y, HE Z, HE J, HU C, DUAN H, et al. Serum levels of miR-19b and miR-146a as prognostic biomarkers for non-small cell lung cancer[J]. Tohoku J Exp Med, 2014, 232: 85-95. DOI:10.1620/tjem.232.85 |
| [26] |
CHEN M, ZHOU Z Y, CHEN J G, TONG N, CHEN S Q, YANG Y, et al. Effect of miR-146a polymorphism on biochemical recurrence risk after radical prostatectomy in southern Chinese population[J]. Genet Mol Res, 2014, 13: 10615-10621. DOI:10.4238/2014.December.18.3 |
 2020, Vol. 41
2020, Vol. 41


