2. 海军军医大学(第二军医大学)长征医院中医科, 上海 200003;
3. 河南大学第一附属医院康复医学科, 开封 475001;
4. 华中科技大学同济医学院附属梨园医院老年病科, 武汉 430077
2. Department of Traditional Chinese Medicine, Changzheng Hospital, Naval Medical University(Second Military Medical University), Shanghai 200003, China;
3. Department of Rehabilitation Medicine, the First Affiliated Hospital of Henan University, Kaifeng 475001, Henan, China;
4. Department of Geriatrics, Liyuan Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430077, Hubei, China
衰老是生物个体正常生理功能出现衰退的过程, 也是老年病发生、发展的重要危险因素[1]。四君子汤是益气健脾的代表方剂, 包含党参、茯苓、白术、甘草4味中药, 能够提高机体免疫力, 我们前期研究发现添加了黄芪组成的加味四君子汤能够延缓小鼠脑组织衰老, 其机制与抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路有关[2]。脾脏是重要的免疫器官, 本研究拟观察加味四君子汤对小鼠脾脏组织的抗衰老作用, 并从mTOR信号通路角度探讨其可能的作用机制。
1 材料和方法 1.1 药物和试剂加味四君子汤由华中科技大学同济医学院附属梨园医院中草药房提供(由白术、党参、茯苓、甘草、黄芪组成, 批号:201512240911), 经水煮醇沉法制备成含生药l g/mL的药液, 然后用蒸馏水配制成分别含生药1.0、0.25 g/mL的溶液, 于4 ℃冰箱保存备用。精确称取适量D -半乳糖粉末, 配成0.02 g/mL的溶液, 置于4℃密封储存。TRIzol试剂盒(货号15596-026)购自美国Invitrogen公司, RevertAid第一链cDNA合成试剂盒(货号K1622)购自美国Thermo公司, FastStart Universal SYBR Green Master(Rox)荧光定量试剂盒(货号04913914001)购自瑞士Roche公司, IgG检测试剂盒购自宁波美康生物科技股份有限公司。
1.2 动物分组及给药40只8周龄SPF级雄性昆明小鼠购自湖北省疾病控制中心[动物使用许可证号:SYXK(鄂)2010-0057]。将小鼠随机分为加味四君子汤低剂量组、加味四君子汤高剂量组、模型组和对照组, 每组10只。加味四君子汤低剂量组和高剂量组每天分别予以加味四君子汤1.6、6.4 g/kg灌胃给药, 同时腹腔注射D-半乳糖溶液0.2 g/kg; 模型组每天予以等体积生理盐水灌胃, 同时腹腔注射D-半乳糖溶液0.2 g/kg; 对照组每天予以等体积生理盐水灌胃。每周称小鼠体重1次, 依据体重调整给药剂量, 连续给药42 d。
1.3 观察指标观察各组小鼠一般状态, 如摄食、饮水情况、体重的增减、行动力、毛色、皮肤弹性等变化。末次给药24 h后, 称小鼠体重, 于尾部采集静脉血并用试管留置血样, 常温下静置后离心取血清, 使用IgG检测试剂盒测定小鼠血清IgG含量。随后断颈处死小鼠, 迅速摘取脾脏, 用电子天平称湿重, 计算脾脏指数:脾脏指数(mg/g)=脾脏湿质量(mg)/体重(g)。将脾脏剖开, 一部分用于qRT-PCR检测; 另一部分放入4%多聚甲醛溶液中固定, 予以常规石蜡包埋并行H-E染色, 光镜下观察脾脏组织形态学变化。
1.4 qRT-PCR检测mTOR信号通路的表达采用TRIzol试剂盒提取样本组织的总RNA, 使用RevertAid第一链cDNA合成试剂盒将RNA反转录成cDNA。使用FastStart Universal SYBR Green Master(Rox)荧光定量试剂盒加样, 样品在qRT-PCR仪(7300型, 美国ABI公司)中进行扩增反应。mTOR信号通路相关因子磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)、p70核糖体蛋白S6激酶(p70 ribosomal protein S6 kinase, p70S6K)、真核细胞翻译起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E binding protein 1, 4E-BP1)及GAPDH引物由美国Invitrogen公司合成。反应体系:2×qRT-PCR Mix 12.5 μL, 7.5 μmol/L基因引物2.0 μL, cDNA模板2.5 μL, ddH2O 8.0 μL; 反应条件:95 ℃预变性10 min, 95 ℃ 15 s、60 ℃ 1 min连续进行40个循环。以GAPDH为内参照, 采用2-ΔΔCt法计算产物相对表达量。
1.5 统计学处理采用SPSS 17.0软件进行统计学分析。呈正态分布的计量资料以x±s表示, 多组间比较采用单因素方差分析, 两两比较采用最小显著性差异法。检验水准(α)为0.05。
2 结果 2.1 各组小鼠一般状态的比较各组小鼠饮食、进水基本正常。对照组小鼠行动敏捷, 毛发浓密、光亮, 皮肤弹性良好。与对照组相比, 模型组和加味四君子汤低剂量组小鼠表现出精神萎靡、行动迟缓、喜欢蜷缩, 毛色暗淡, 腹部有脱毛现象, 皮肤弹性差, 体重下降明显(P<0.05, 表 1)。加味四君子汤高剂量组小鼠在行动、毛色及皮肤状态方面均好于模型组, 体重改变不明显(P>0.05, 表 1)。
|
|
表 1 各组小鼠体重、脾脏指数、IgG及脾脏组织PI3K、p70S6K、4E-BP1 mRNA表达的比较 |
2.2 各组小鼠脾脏组织形态学比较
与对照组相比, 模型组小鼠脾脏组织形态结构紊乱, 白髓和红髓分界不清, 白髓区明显缩小, 红髓区扩张、充血、纤维增多, 淋巴细胞数量减少。与模型组相比较, 加味四君子汤低剂量组和高剂量组小鼠脾脏组织形态均有一定的改善, 白髓区扩大, 淋巴细胞数量增多, 但白髓和红髓分界仍欠清晰(图 1)。
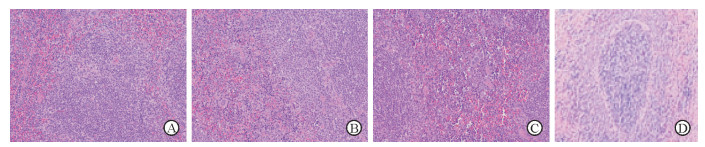
|
图 1 各组小鼠脾脏组织病理形态变化 A:加味四君子汤低剂量组;B:加味四君子汤高剂量组;C:模型组;D:对照组. H-E染色. Original magnification: ×200 |
2.3 各组小鼠脾脏指数和IgG的比较
由表 1可见, 模型组和加味四君子汤低剂量组小鼠的脾脏指数和血清IgG水平均低于对照组(P均<0.05), 而加味四君子汤高剂量组小鼠的脾脏指数和血清IgG水平与对照组相比差异无统计学意义(P均>0.05);加味四君子汤低剂量组小鼠的脾脏指数和血清IgG水平与模型组比较差异无统计学意义(P均>0.05), 而加味四君子汤高剂量组小鼠的脾脏指数和血清IgG水平均高于模型组(P均<0.05)。
2.4 各组小鼠的脾脏组织PI3K、p70S6K、4E-BP1 mRNA表达的比较由表 1可见, 模型组和加味四君子汤低剂量组PI3K和p70S6K mRNA表达水平均高于对照组(P均<0.05), 加味四君子汤高剂量组PI3K和p70S6K mRNA表达水平与对照组相比差异无统计学意义(P>0.05);加味四君子汤低剂量组、加味四君子汤高剂量组脾脏组织PI3K和p70S6K mRNA表达水平均较模型组降低(P<0.05)。各组中脾脏组织4E-BP1 mRNA表达水平差异均无统计学意义(P均>0.05)。
3 讨论现在药理学研究表明, 四君子汤中所含的皂苷、黄酮类、多糖等多种成分可通过调节免疫细胞因子浓度来提高机体免疫力, 延缓衰老[3]。在四君子汤中加入同样具有增强免疫、抗炎和抗肿瘤等作用的黄芪, 可减轻机体的免疫抑制状态, 提高机体抗氧化酶活性, 调节代谢、内分泌及免疫功能等[4]。我们前期研究发现, 加味四君子汤能够延缓小鼠脑组织衰老, 具有抗衰老作用[2]。
脾脏可产生淋巴细胞, 并具有合成和分泌免疫物质如免疫细胞及细胞因子的功能, 在免疫功能调控中起重要作用。本研究采用D-半乳糖诱导小鼠衰老模型, 结果发现模型组小鼠脾脏指数明显降低, 白髓区缩小, 白髓、红髓分界不清, 淋巴细胞数目减少。给予低剂量或高剂量加味四君子汤干预后, 小鼠脾脏组织形态上较模型组有一定的改善, 白髓区扩大, 淋巴细胞数目增多; 并且加味四君子汤高剂量组小鼠脾脏指数和血清IgG水平均较模型组增高。上述结果表明加味四君子汤可改善小鼠脾脏组织的衰老性退化, 促进淋巴细胞分化增殖, 提高机体的体液免疫和细胞免疫水平。这与雷超等[5]的研究结果相符。
mTOR是是细胞生长和增殖的重要调节因子[6], 受上游调控因子PI3K/Akt调控[7-8], 下游主要靶点为p70S6K和4E-BP1[9-11]。mTOR通路在代谢、衰老等过程中起着重要的调控作用[12-13]。本研究结果显示, 模型组小鼠脾脏组织PI3K、p70S6K mRNA表达水平均较对照组升高(P均<0.05), 而加味四君子汤低剂量组、高剂量组脾脏组织PI3K、p70S6K mRNA表达水平均较模型组降低(P均<0.05);4组间小鼠脾脏组织中4E-BP1 mRNA的表达水平差异无统计学意义。该结果表明加味四君子汤可能通过下调PI3K的表达抑制mTOR信号通路, 使p70S6K的表达水平降低, 从而延缓小鼠脾脏衰老; 而4E-BP1可能并不是加味四君子汤抗衰老作用的下游靶蛋白。PI3K和p70S6K可能是抗衰老治疗的潜在靶点, 值得进一步研究。
| [1] |
何琪杨, 刘光慧, 保志军, 孔庆鹏, 陶军, 丁艳秋, 等. 中国衰老与抗衰老专家共识(2019年)[J]. 老年医学与保健, 2019, 25: 551-553. |
| [2] |
沈莹, 高啸, 覃艳琼, 雷超, 柳湘洁, 曾永孝. 加味四君子汤通过mTOR信号通路延缓小鼠脑组织衰老的机制研究[J]. 华中科技大学学报(医学版), 2018, 47: 417-420. DOI:10.3870/j.issn.1672-0741.2018.04.007 |
| [3] |
熊山, 丁晓晨. 四君子汤化学成分和药理作用研究进展[J]. 山东医学高等专科学校学报, 2017, 39: 371-374. DOI:10.3969/j.issn.1674-0947.2017.05.015 |
| [4] |
刘诗泆, 刘素兰, 尹秋林. 黄芪四君子汤联合不同营养方式对肝硬化肝癌大鼠肝部分切除术后营养状态与免疫功能的影响[J]. 中国老年学杂志, 2016, 36: 5807-5809. DOI:10.3969/j.issn.1005-9202.2016.23.015 |
| [5] |
雷超, 张力华, 苏婷. 加味四君子汤对衰老大鼠的脾脏及细胞因子的影响[J]. 中华中医药杂志, 2014, 29: 2941-2944. |
| [6] |
丁亦含, 李玉峰. mTOR信号通路与自噬、凋亡之间的相互关系[J]. 现代医学, 2015, 43: 801-804. |
| [7] |
LEE J E, LIM M S, PARK J H, PARK C H, KOH H C. S6K promotes dopaminergic neuronal differentiation through PI3K/Akt/mTOR-dependent signaling pathways in human neural stem cells[J]. Mol Neurobiol, 2016, 53: 3771-3782. DOI:10.1007/s12035-015-9325-9 |
| [8] |
乔铁, 梁可, 马进, 林蔗茹, 郑冰元, 张立德. 黄芪皂苷对化疗贫血小鼠PI3K/Akt/mTOR信号通路相关基因mRNA表达的影响[J]. 中国中药杂志, 2016, 41: 3828-3832. |
| [9] |
涂玥, 孙伟, 陈涤平, 万毅刚, 吴薇, 姚建. 自噬调控肾脏衰老的分子机制及中药的干预作用[J]. 中国中药杂志, 2016, 41: 3914-3918. |
| [10] |
MEIJER A J, LORIN S, BLOMMAART E F, CODOGNO P. Regulation of autophagy by amino acids and MTOR-dependent signal transduction[J]. Amino Acids, 2015, 47: 2037-2063. DOI:10.1007/s00726-014-1765-4 |
| [11] |
PÓPULO H, LOPES J M, SOARES P. The mTOR signalling pathway in human cancer[J]. Int J Mol Sci, 2012, 13: 1886-1918. DOI:10.3390/ijms13021886 |
| [12] |
贺洁宇, 刘峰. mTOR信号通路与衰老及衰老相关重大疾病[J]. 生物化学与生物物理进展, 2014, 41: 257-265. |
| [13] |
YANG Z, MING X F. mTOR signalling:the molecular interface connecting metabolic stress, aging and cardiovascular diseases[J]. Obes Rev, 2012, 13(Suppl 2): 58-68. |
 2020, Vol. 41
2020, Vol. 41


