钙化性主动脉瓣疾病(calcific aortic valve disease,CAVD)指各种原因引起的、以主动脉瓣钙化为主要病理改变的疾病。CAVD好发于老年人,随着各国人口老龄化程度加剧,其发病率正逐年增加[1]。CAVD发生过程涉及内皮损伤、脂质浸润、慢性炎症、基质重塑、纤维化、细胞分化、进展性钙化及新生血管形成等复杂变化[2-6],其病理改变早期与动脉粥样硬化相似、晚期与骨形成类似[7]。在晚期的进展性钙化过程中,骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)起着重要作用。研究发现,BMP-2可受miRNA-141调控[3, 8-9],但miRNA-141调控BMP-2诱导主动脉瓣钙化的具体机制尚不明确。本研究通过人钙化主动脉瓣检测、人主动脉瓣膜间质细胞(human aortic valve interstitial cell,HAVIC)实验及主动脉瓣钙化小鼠模型实验,探讨miRNA-141通过靶向作用远端缺失同源盒5(distal-less homeobox 5,Dlx5)基因,继而调控BMP-2蛋白诱导的人主动脉瓣钙化的可能机制。
1 材料和方法 1.1 组织标本收集2018年9月至2019年3月在海军军医大学(第二军医大学)长征医院接受主动脉瓣膜置换术的24例CAVD患者的退行性主动脉瓣膜,并通过尸检获得24例正常人主动脉瓣膜。标本使用经海军军医大学(第二军医大学)伦理委员会审批,患者家属均已签署知情同意书。
1.2 正常人主动脉瓣膜HAVIC的原代培养及分组瓣膜经冷PBS清洗、0.25%胰蛋白酶-EDTA溶液消化,刮擦瓣膜内皮细胞层,再将瓣膜剪成3 mm×3 mm大小薄片,置于Ⅱ型胶原酶溶液中,37 ℃培养箱孵育2 h。滤去瓣膜残渣,移入离心管,377.3×g离心5 min,取沉淀。加入1 mL高糖DMEM培养液,混匀,移入培养皿,常规培养,2 d后换液。细胞生长铺满培养瓶底80%左右时传代,每2 d换液1次。选用培养第3~4代细胞进行研究。空白对照组(Con)以标准培养液培养1周;实验组以含10 mmol/L地塞米松、50 mg/L维生素C和10 mmol/L β-甘油磷酸钠(美国Sigma公司)的钙化培养液进行钙化诱导培养1周,并进一步分为单纯钙化培养液组(Cal)、阴性对照组(miR-NC)、miRNA-141模拟组(M-miR-141)和miRNA-141抑制组(I-miR-141),每组5个样本。
1.3 小鼠模型构建与分组选取雄性Dlx5-/-ApoE-/-小鼠45只、雄性Dlx5+/+ApoE-/-小鼠45只[SPF级,海军军医大学(第二军医大学)动物实验中心,实验动物生产许可证号:SCXK(沪)2017-0003],给予0.2%高胆固醇、高脂饮食喂养24周,构建主动脉瓣钙化小鼠模型,并分为空白对照组(Con)、miRNA-141下调(miR-141-)组和miRNA-141上调(miR-141+)组,每组15只。培养3个月后以颈椎脱臼法处死小鼠,收集小鼠主动脉瓣组织。
1.4 qRT-PCR检测miRNA-141、Dlx5 mRNA和BMP-2 mRNA的表达采用miRNA反转录试剂盒进行反转录,利用特异引物进行qRT-PCR检测。反应条件:50 ℃ 2 min、95 ℃ 10 min;95 ℃ 15 s、60 ℃ 1 min、72 ℃ 34 s,共40个循环。miRNA-141的表达以U6为内参,Dlx5、BMP-2的表达以β-actin为内参,基因的相对表达量采用2-ΔΔCt法进行分析。引物序列:U6上游引物5'-CGCTTCGGCAGCACATATACT-3',下游引物5'-GAATTTGCGTGTCATCCTTGC-3';miRNA-141引物5'-GCAGTGTTGGATGGTTGAAGTATG-3';β-actin上游引物5'- AGGCTGTGTTGTCCCTGTA-3',下游引物5'-ATGTCACGCACGATTTCC-3';Dlx5上游引物5'- GCAAGATCACTAGACGGGAATCA-3',下游引物5'-GCATTGTCGAAGTCGGATACAGAG-3';BMP-2上游引物5'-TCATAAAACCTGCAACAGCC-AACTCG-3',下游引物5'-GCTGTACTAGCGAC-ACCCAC-3'。
1.5 蛋白质印迹法检测Dlx5和BMP-2蛋白的表达使用RIPA裂解液(美国Thermo Fisher公司)裂解细胞并提取细胞总蛋白,将蛋白质样品进行凝胶电泳后转膜、封闭,再分别加入工作浓度为1:1 000的一抗(BMP-2抗体,英国Abcam公司;Dlx5抗体,美国Abgent公司)和工作浓度为1:5 000的二抗(辣根过氧化物酶标记的兔源抗体,美国Cell Signaling Technology公司)进行免疫反应。反应完成后使用ECL工作液(美国Thermo Fisher公司)显色,观察目的蛋白的表达情况。以β-actin为内参。
1.6 HAVIC转染选用50 nmol/L的miRNA-141模拟物、miRNA-141抑制物及阴性对照,以DharmaFect转染试剂盒(美国Thermo Fisher Scientific公司)转染单层HAVIC培养物(细胞密度为7.5×104/cm2);用生长培养液(含有10% FBS的DMEM)进一步培养转染后细胞24 h。
1.7 Von Kossa染色及结果判定使用Von Kossa试剂盒(美国Polysciences公司)对细胞及组织进行Von Kossa染色,并进行半定量分析。细胞染色后,综合考虑染色强度和阳性百分比,采用染色指数法计算钙化得分。(1)染色阳性细胞标记指数计分:随机计数500个细胞(高倍镜下),根据标记指数(labeling index,LI;阳性细胞数目所占百分比)分4个等级,完全无着色为0分,LI<25%为1分,LI在25%~50%之间为2分,LI>50%为3分。(2)细胞着色强度计分:按细胞染色后着色的深浅程度计0~3分,与背景色基本一致、细胞没有着色计0分,着色为浅黄色计1分,着色呈棕色计2分,着色为棕褐色计3分。以LI计分和着色强度计分的乘积作为最终得分。
1.8 双荧光素酶报告基因实验应用TargetScan 6.2软件检索miRNA-141靶基因,结果显示Dlx5基因可能是其潜在靶基因。收集第3~4代HAVIC细胞,按每孔1×106个细胞接种于6孔板,利用PCR法获取HAVIC细胞中的cDNA模板,构建包含miRNA-141结合位点的Dlx5基因3'-UTR序列,插入pGL3-basic荧光素酶质粒中,形成报告基因质粒,所有构建获得的表达质粒经酶切和测序鉴定。按照Lipofectamine 2000试剂盒说明书进行操作,将上述重组质粒载体和miRNA-141模拟物、miRNA-141模拟物阴性对照(美国Invitrogen公司)共转染HAVIC 24 h后行双荧光素酶报告基因检测。以荧光素为底物,检测萤火虫荧光素酶活性;加入Stop & Glo试剂(美国Promega公司)检测海肾荧光素酶活性,并以其作为内参照;同时加入抑制荧光素酶催化荧光素发光物质。计算各组细胞内的相对荧光素酶活性。荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。实验操作重复2次。
1.9 统计学处理应用SPSS 21.0软件进行统计学分析。计量资料以x±s表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,以最小显著性差异法进行两两比较。计数资料以例数和百分数表示,组间比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 人钙化主动脉瓣miRNA-141和BMP-2表达变化退行性主动脉瓣膜组24例患者中男14例(58.3%),女10例(41.7%),平均年龄(63.7±4.6)岁;正常主动脉瓣膜组24例中男13例(54.2%)、女11例(45.8%),平均年龄(66.8±6.1)岁;两组间性别比例、平均年龄的差异均无统计学意义(P均>0.05)。qRT-PCR及蛋白质印迹法检测结果显示,与正常瓣膜组织相比,钙化主动脉瓣组织中miRNA-141的表达水平降低(1.00±0.02 vs 0.35±0.06,P=0.01)、BMP-2 mRNA表达水平增高(1.00±0.01 vs 1.72±0.12,P=0.01)、BMP-2蛋白的表达水平增高(1.00±0.01 vs 2.14±0.17,P=0.01,图 1)。
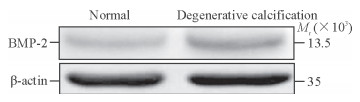
|
图 1 正常主动脉瓣及退行性钙化性主动脉瓣中BMP-2蛋白表达水平 Fig 1 Expression of BMP-2 protein in normal aortic valve and degenerative calcification aortic valve BMP-2: Bone morphogenetic protein-2 |
2.2 HAVIC中miRNA-141与BMP-2、Dlx5的关系
Con组、Cal组、miR-NC组、M-miR-141组和I-miR-141组细胞的钙化得分分别为1.00±0.05、1.54±0.13、1.50±0.14、1.35±0.14、1.96±0.15,与Con组相比,4个实验组的细胞钙化得分均升高(P均<0.05);Cal组与miR-NC组细胞钙化得分差异无统计学意义(P=0.12);M-miR-141组较Cal组、I-miR-141组降低(P=0.02,P=0.01);I-miR-141组较Cal组升高(P=0.01)。
Con组、Cal组、miR-NC组、M-miR-141组和I-miR-141组细胞中Dlx5 mRNA相对表达水平分别为1.00±0.02、0.96±0.02、0.97±0.02、0.76±0.14、1.89±0.16;Con组、Cal组、miR-NC组Dlx5 mRNA表达差异均无统计学意义(P均>0.05);与Con组比较,M-miR-141组的Dlx5 mRNA表达水平降低(P=0.02),而I-miR-141组Dlx5 mRNA表达水平升高(P=0.01),I-miR-141组Dlx5 mRNA表达水平较M-miR-141组升高(P=0.01)。
Con组、Cal组、miR-NC组、M-miR-141组和I-miR-141组细胞中BMP-2蛋白相对表达水平分别为1.00±0.02、0.97±0.02、0.99±0.02、0.71±0.10、1.99±0.16;Con组、Cal组、miR-NC组BMP-2蛋白表达水平差异均无统计学意义(P均>0.05);与Con组比较,M-miR-141组的BMP-2蛋白表达水平降低(P=0.02),而I-miR-141组BMP-2蛋白表达水平升高(P=0.01);I-miR-141组BMP-2蛋白表达水平较M-miR-141组升高(P=0.01)。见图 2。
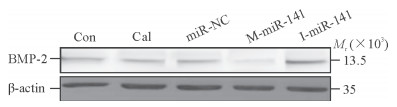
|
图 2 各组原代人主动脉瓣膜间质细胞中BMP-2蛋白表达水平 Fig 2 Expression level of BMP-2 protein in human aortic valve interstitial cells of each group BMP-2: Bone morphogenetic protein-2; Con: Control group; Cal: Calcification group; miR-NC: Negative control group; M-miR-141: miRNA-141 mimic group; I-miR-141: miRNA-141 inhibitor group |
2.3 双荧光素酶报告基因实验确认miRNA-141的直接靶标
与阴性对照(pGL3-2空载体)相比,应用miRNA-141模拟物和pGL3-3′ UTR转染细胞后重组质粒的荧光素酶活性降低(0.90±0.04 vs 0.50±0.09,P=0.02),提示miRNA-141通过与Dlx5的3'UTR相互作用并抑制其表达,验证了Dlx5为miRNA-141的靶基因。
2.4 小鼠主动脉瓣中miRNA-141与BMP-2、Dlx5的关系Von Kossa染色显示,Con组、miR-141-组及miR-141+组小鼠主动脉瓣膜钙化得分分别为1.00±0.02、1.89±0.10及0.62±0.10,miR-141-组钙化得分较Con组增高(P=0.01),miR-141+组钙化得分较Con组降低(P=0.01)。Con组、miR-141-组及miR-141+组Dlx5 mRNA表达分水平别为1.00±0.08、1.98±0.27及0.54±0.07,BMP-2 mRNA表达水平分别为1.00±0.19、1.83±0.23及0.43±0.16,miR-141-组Dlx5和BMP-2 mRNA表达水平较Con组均升高(P均<0.05),而miR-141+组Dlx5和BMP-2的mRNA表达水平较Con组均降低(P均<0.05)。Con组、miR-141-组及miR-141+组Dlx5蛋白表达水平分别为1.00±0.09、1.94±0.21及0.40±0.11,BMP-2蛋白表达水平分别为1.00±0.11、1.90±0.19及0.36±0.07;与Con组相比,miR-141-组Dlx5和BMP-2蛋白表达水平均升高(P均<0.05),而miR-141+组Dlx5和BMP-2蛋白表达水平均降低(P均<0.05)。见图 3。
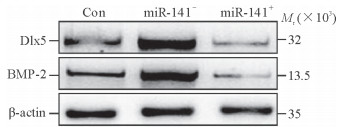
|
图 3 各组小鼠主动脉瓣中Dlx5及BMP-2蛋白表达水平 Fig 3 Expression level of Dlx5 and BMP-2 protein in aortic valve in each group Dlx5: Distal-less homeobox 5; BMP-2: Bone morphogenetic protein-2; Con: Control group; miR-141-: miRNA-141 downregulated group; miR-141+: miRNA-141 up-regulated group |
将Dlx5基因敲除的主动脉瓣钙化小鼠模型进行同样的分组及培养,结果显示Con组、miR-141-组、miR-141+组BMP-2蛋白表达水平分别为1.00±0.04、0.97±0.03、1.02±0.03(图 4),钙化得分分别为1.00±0.05、0.98±0.04、1.03±0.03,各组间差异均无统计学意义(P均>0.05)。

|
图 4 各组Dlx5基因敲除小鼠主动脉瓣中BMP-2蛋白表达水平 Fig 4 Expression level of BMP-2 protein in aortic valve in each Dlx5 knockout mouse group Dlx5: Distal-less homeobox 5; BMP-2: Bone morphogenetic protein-2; Con: Control group; miR-141-: miRNA-141 downregulated group; miRNA-141+: miR-141 up-regulated group |
3 讨论
许多基因通路参与了心脏瓣膜钙化过程,如胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)通路、BMP-2通路等[10-11]。已知经典通路中,BMP-2受到Dlx5的调节,激活一系列下游蛋白并与其他非经典途径共同诱发钙化发生,如Laxman等[9]发现miRNA-203和miRNA-320b通过抑制Dlx5负调控BMP-2诱导的成骨细胞分化,而Dlx5同时抑制下游成骨转录因子Runx2和Osx,共同抑制成骨细胞分化。
miRNA是真核生物中一类内源性的具有调控功能的RNA,可在转录后水平特异性识别靶基因的3'UTR上相应靶点并通过碱基互补配对方式与之结合,从而抑制或加速降解特定靶基因而发挥作用。研究表明,HAVIC高表达或特异表达的miRNA参与调控心脏重构[12]、瓣膜纤维化[13]、瓣膜钙化[14]等多种心脏生理和病理过程。
miRNA-141是miRNA-200家族成员,在成骨及钙化过程中发挥重要调节作用。Yanagawa等[3]发现先天性二叶瓣畸形患者主动脉标本中miRNA-141的表达降低,而BMP-2的表达增高。Itoh等[8]发现在小鼠成骨前细胞系中,miRNA-141通过抑制Dlx5调节BMP-2诱导的前成骨细胞分化。但目前尚无研究阐明miRNA-141通过BMP-2通路调控主动脉瓣钙化的具体机制。
本研究发现,与正常主动脉瓣膜组织相比,人退行性钙化主动脉瓣膜组织中miRNA-141的表达降低,而BMP-2的mRNA及蛋白表达水平增高;在HAVIC中,miRNA-141发挥抑制细胞钙化作用,且Dlx5、BMP-2表达水平与miRNA-141表达水平呈负向关系。双荧光素酶报告基因实验显示Dlx5是miRNA-141的直接靶标;在体水平上调miRNA-141表达可降低小鼠主动脉瓣钙化程度并减少BMP-2表达,下调miRNA-141可起到相反作用;而上/下调miRNA-141对Dlx5基因敲除小鼠主动脉瓣钙化及BMP-2蛋白表达无影响。
CAVD作为一种受遗传与环境因素双重影响、涉及复杂细胞分子学机制的慢性进展性疾病,其确切发病机制尚不明确,目前尚无有效的药物可以预防或延缓其进展,因此接受手术或介入瓣膜置换是晚期CAVD患者唯一的选择。本研究首次证实了miRNA-141通过作用于Dlx5抑制BMP-2诱导主动脉瓣钙化的机制,或可为CAVD患者尤其是晚期患者的靶向治疗提供理论依据和新的治疗靶点。
| [1] |
COFFEY S, COX B, WILLIAMS M J. The prevalence, incidence, progression, and risks of aortic valve sclerosis:a systematic review and meta-analysis[J]. J Am Coll Cardiol, 2014, 63: 2852-2861. DOI:10.1016/j.jacc.2014.04.018 |
| [2] |
MAHMUT A, BOULANGER M C, EL HUSSEINI D, FOURNIER D, BOUCHAREB R, DESPRÉS J P, et al. Elevated expression of lipoprotein-associated phospholipase A2 in calcific aortic valve disease:implications for valve mineralization[J]. J Am Coll Cardiol, 2014, 63: 460-469. DOI:10.1016/j.jacc.2013.05.105 |
| [3] |
YANAGAWA B, LOVREN F, PAN Y, GARG V, QUAN A, TANG G, et al. miRNA-141 is a novel regulator of BMP-2-mediated calcification in aortic stenosis[J]. J Thorac Cardiovasc Surg, 2012, 144: 256-262. DOI:10.1016/j.jtcvs.2011.10.097 |
| [4] |
PESCATORE L A, GAMARRA L F, LIBERMAN M. Multifaceted mechanisms of vascular calcification in aging[J]. Arterioscler Thromb Vasc Biol, 2019, 39: 1307-1316. DOI:10.1161/ATVBAHA.118.311576 |
| [5] |
RADDATZ M A, MADHUR M S, MERRYMAN W D. Adaptive immune cells in calcific aortic valve disease[J]. Am J Physiol Heart Circ Physiol, 2019, 317: H141-H155. DOI:10.1152/ajpheart.00100.2019 |
| [6] |
OHUKAINEN P, RUSKOAHO H, RYSA J. Mechanisms of valvular thickening in early and intermediate calcific aortic valve disease[J]. Curr Cardiol Rev, 2018, 14: 264-271. DOI:10.2174/1573403X14666180820151325 |
| [7] |
BERTAZZO S, GENTLEMAN E. Aortic valve calcification:a bone of contention[J]. Eur Heart J, 2017, 38: 1189-1193. |
| [8] |
ITOH T, NOZAWA Y, AKAO Y. MicroRNA-141 and -200a are involved in bone morphogenetic protein-2-induced mouse pre-osteoblast differentiation by targeting distalless homeobox 5[J]. J Biol Chem, 2009, 284: 19272-19279. DOI:10.1074/jbc.M109.014001 |
| [9] |
LAXMAN N, MALLMIN H, NILSSON O, KINDMARK A. miR-203 and miR-320 regulate bone morphogenetic protein-2-induced osteoblast differentiation by targeting distal-less homeobox5(Dlx5)[J]. Genes (Basel), 2016, 8: 4-18. DOI:10.3390/genes8010004 |
| [10] |
CHOI B, LEE S, KIM S M, LEE E J, LEE S R, KIM D H, et al. Dipeptidyl peptidase-4 induces aortic valve calcification by inhibiting insulin-like growth factor-1 signaling in valvular interstitial cells[J]. Circulation, 2017, 135: 1935-1950. DOI:10.1161/CIRCULATIONAHA.116.024270 |
| [11] |
WU M, CHEN G, LI Y. TGF-β and BMP signaling in osteoblast, skeletal development, and bone formation, homeostasis and disease[J/OL]. Bone Res, 2016, 4: 16009. doi: 10.1038/boneres.2016.9.
|
| [12] |
WANG Q, YU X, DOU L, HUANG X, ZHU K, GUO J, et al. miR-154-5p functions as an important regulator of angiotensin Ⅱ-mediated heart remodeling[J/OL]. Oxid Med Cell Longev, 2019, 2019: 8768164. doi: 10.1155/2019/8768164.
|
| [13] |
GOETTSCH C, RAUNER M, PACYNA N, HEMPEL U, BORNSTEIN S R, HOFBAUER L C. miR-125b regulates calcification of vascular smooth muscle cells[J]. Am J Pathol, 2011, 179: 1594-1600. DOI:10.1016/j.ajpath.2011.06.016 |
| [14] |
LU P, YIN B, LIU L. MicroRNA-138 suppresses osteoblastic differentiation of valvular interstitial cells in degenerative calcific aortic valve disease[J]. Int Heart J, 2019, 60: 136-144. DOI:10.1536/ihj.18-086 |
 2020, Vol. 41
2020, Vol. 41


