患者女,49岁,2020年2月10日因发热就诊于我院急诊科。患者最高体温38.4 ℃,无明显腹痛,血常规示白细胞计数5.1×109/L、中性粒细胞比例0.825,甲型及乙型流感病毒检测阴性。肺部CT提示:右肺上叶小结节,炎性可能,随访;急性胰腺炎,结合临床实验室检查;脾稍大。进一步完善上腹部CT提示:胰腺饱满,胰周脂肪间隙模糊,胰管无扩张(图 1),考虑急性胰腺炎。查血淀粉酶242 U/L,随机血糖6.5 mmol/L,尿葡萄糖阴性,诊断为急性胰腺炎,予抗感染、抑酸等治疗。2 d后复查血淀粉酶177 U/L、血糖3.7 mmol/L。5 d后患者出现腹痛、伴恶心呕吐,查随机血糖19.2 mmol/L,血淀粉酶148 U/L,予抗感染、抑酸及生物合成胰岛素注射液(诺和灵R)皮下注射。2020年2月20日复查胰腺CT提示原急性胰腺炎已好转吸收(图 2),随机血糖27.4 mmol/L,动脉血pH 7.177,尿酮体30 mmol/L,诊断为糖尿病酮症酸中毒。予小剂量胰岛素持续皮下注射、补液、纠酸等治疗。复查尿酮体阴性后,遂将胰岛素持续皮下注射调整为餐时-基础胰岛素治疗,即门冬胰岛素注射液联合地特胰岛素注射液强化降糖方案。患者自急诊出院后,监测发现血糖波动大,为进一步诊治于内分泌科门诊就诊。门诊于2020年4月1日收入内分泌科。
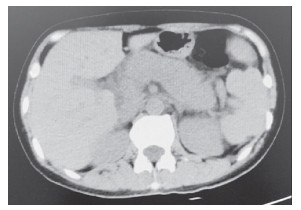
|
图 1 上腹部64排螺旋CT平扫示胰腺饱满,胰周脂肪间隙模糊,胰管无扩张 |
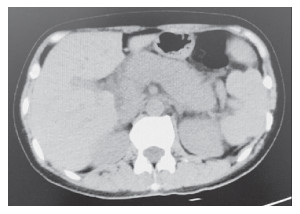
|
图 2 上腹部64排螺旋CT平扫示原急性胰腺炎已好转 |
患者身高158 cm,体重49 kg,BMI 19.6 kg/m2,自发病以来近50 d体重下降4 kg。入院后查糖化血红蛋白6.4%,糖化白蛋白24%;馒头餐试验空腹、餐后1 h及餐后2 h C肽均<0.01 μg/L,空腹、餐后1 h及餐后2 h胰岛素水平均<0.2 mIU/L;抗胰岛素抗体阳性(124.6 IU/mL)、抗谷氨酸脱羧酶抗体(anti-glutamic acid decarboxylase antibody,GADAb)阴性(5.93 IU/mL);尿酮体阴性、尿葡萄糖60 mmol/L,血淀粉酶100 U/L,血清低密度脂蛋白胆固醇2.48 mmol/L、高密度脂蛋白胆固醇2.08 mmol/L、三酰甘油0.69 mmol/L、总胆固醇4.63 mmol/L,尿微量白蛋白/尿肌酐3 mg/g;肝、肾功能未见异常;颈动脉超声示双侧颈动脉内膜毛糙、内中膜增厚伴右侧斑块形成。诊断为“暴发性1型糖尿病(fulminant type 1 diabetes,FT1D)”,予胰岛素泵治疗,胰岛素用量为0.5 U/(kg • d)。患者血糖稳定后于2020年4月10日出院。出院后予门冬胰岛素注射液(早餐及午餐前各4 U、晚餐前5 U)联合德谷胰岛素(睡前10 U)皮下注射强化降糖治疗。嘱患者密切监测血糖、血尿酮体等,定期复查肝、肾功能及筛查糖尿病并发症。
2 讨论FT1D是一种因胰岛β细胞破坏导致体内胰岛素绝对缺乏的疾病,患者需长期胰岛素治疗。FT1D的临床特点是高血糖和酮症酸中毒症状发展急骤,糖化血红蛋白水平无明显升高,伴胰岛β细胞衰竭[1]。在日本,FT1D约占1型糖尿病病例的19.4%[2],发病高峰年龄为30~40岁,大多数患者发病年龄≥20岁。国内研究发现,FT1D的发病率在以酮症或糖尿病酮症酸中毒起病的1型糖尿病中约占10.3%[3]。
2.1 FT1D病因及发病机制最初在FT1D患者血清中未检测到胰岛相关自身抗体及自身免疫反应特征,因此FT1D被归类于1B型糖尿病[4]。随着研究进展,有学者发现4.8%的FT1D患者GADAb阳性[5],FT1D发生后胰腺组织中大量的T细胞浸润及巨噬细胞释放炎性细胞因子[6],提示T细胞介导的免疫应答在FT1D发生中发挥重要作用。也有研究发现人类白细胞抗原(human leucocyte antigen,HLA)-Ⅱ相关基因与FT1D发病相关,日本人中HLA-DR4-DQ4(通常由DRB1*0405-DQB1*0401编码)和DR9-DQ3(由DRB1*0901-DQB1*0303编码)基因型FT1D易感性有关[7]。全基因组关联研究证实了HLA对多个位点的单核苷酸多态性与FT1D密切相关,并识别了染色体12q13.13上的变异与FT1D易感性有关[8]。还有研究发现,大多数FT1D患者起病前2周内有过前驱感染病史,因此推测FT1D发生与病毒感染有关[9-10]。研究者从FT1D患者血清中可检测到柯萨奇病毒、轮状病毒、巨细胞病毒、EB病毒、人类疱疹病毒、腮腺炎病毒、B型流感病毒抗体等病毒感染证据[9-10],并从胰腺组织学检测中发现CD3+T细胞和CD68+巨噬细胞浸润,提示病毒感染的继发反应可能参与FT1D的发病[11]。近年来,越来越多的证据支持肠病毒与1型糖尿病发病相关,胰岛感染肠病毒后引发β细胞中干扰素γ和CXC趋化因子配体10(CXC chemokine ligand 10,CXCL10)共表达,CXCL10激活后引起自身免疫性T细胞和巨噬细胞到达胰岛,释放包括干扰素γ在内的炎性因子,破坏β细胞并加速残留β细胞中CXCL10的生成,通过一个闭合通路进一步激活细胞介导的自身免疫,直至β细胞完全丧失[12]。
最初在FT1D患者血清中未检测到胰岛相关自身抗体及自身免疫反应特征,因此FT1D被归类于1B型糖尿病[4]。随着研究进展,有学者发现4.8%的FT1D患者GADAb阳性[5],FT1D发生后胰腺组织中大量的T细胞浸润及巨噬细胞释放炎性细胞因子[6],提示T细胞介导的免疫应答在FT1D发生中发挥重要作用。也有研究发现人类白细胞抗原(human leucocyte antigen,HLA)-Ⅱ相关基因与FT1D发病相关,日本人中HLA-DR4-DQ4(通常由DRB1*0405-DQB1*0401编码)和DR9-DQ3(由DRB1*0901-DQB1*0303编码)基因型FT1D易感性有关[7]。全基因组关联研究证实了HLA对多个位点的单核苷酸多态性与FT1D密切相关,并识别了染色体12q13.13上的变异与FT1D易感性有关[8]。还有研究发现,大多数FT1D患者起病前2周内有过前驱感染病史,因此推测FT1D发生与病毒感染有关[9-10]。研究者从FT1D患者血清中可检测到柯萨奇病毒、轮状病毒、巨细胞病毒、EB病毒、人类疱疹病毒、腮腺炎病毒、B型流感病毒抗体等病毒感染证据[9-10],并从胰腺组织学检测中发现CD3+T细胞和CD68+巨噬细胞浸润,提示病毒感染的继发反应可能参与FT1D的发病[11]。近年来,越来越多的证据支持肠病毒与1型糖尿病发病相关,胰岛感染肠病毒后引发β细胞中干扰素γ和CXC趋化因子配体10(CXC chemokine ligand 10,CXCL10)共表达,CXCL10激活后引起自身免疫性T细胞和巨噬细胞到达胰岛,释放包括干扰素γ在内的炎性因子,破坏β细胞并加速残留β细胞中CXCL10的生成,通过一个闭合通路进一步激活细胞介导的自身免疫,直至β细胞完全丧失[12]。
目前FT1D病因不明,可能与遗传因素(HLA基因型)、环境因素(病毒感染)和自身免疫等因素相关。本例患者可能是病毒感染首先导致胰腺外分泌功能损伤,胰淀粉酶升高,继而很快胰岛β细胞功能迅速衰竭,出现糖尿病酮症酸中毒。
2.2 FI1D的诊断要点对于FT1D的诊断标准,日本糖尿病学会认为需同时符合以下3点:(1)高血糖症状出现后迅速(1周内)发生糖尿病酮症或糖尿病酮症酸中毒;(2)首诊时血浆葡萄糖≥16.0 mmol/L,且糖化血红蛋白<8.5%;(3)尿C肽<10 μg/d或空腹C肽<0.1 nmol/L,餐后血清C肽<0.17 nmol/L[13]。FT1D的其他特征还包括:(1)胰岛相关自身抗体(GADAb、胰岛相关抗炎抗体和胰岛素抗体)通常为阴性;(2)发病至起始胰岛素治疗常在1周之内,但也有患者在1~2周;(3)98%的患者血清胰酶(包括淀粉酶、脂肪酶、弹性蛋白酶1)升高;(4)70%的患者有发热、上呼吸道感染等流感样症状或上腹部疼痛、恶心呕吐等胃肠道前驱症状[13]。本例患者在以发热起病至发现血糖升高共5 d,发现血糖升高2 d后随即确诊糖尿病酮症酸中毒,测糖化血红蛋白6.4%,抗胰岛素抗体阳性、GADAb阴性,血清中未检测到C肽及胰岛素,提示胰岛功能衰竭,符合FT1D诊断。
2.3 FT1D的治疗新发FT1D合并糖尿病酮症酸中毒的患者须小剂量胰岛素持续静脉滴注、补液、纠正酸中毒、改善电解质紊乱,必要时予以抗感染等治疗,治疗原则与1A型糖尿病出现酮症酸中毒相同,并根据血糖情况调整静脉胰岛素用量,同时要严密监测血糖、血尿酮体、肝肾功能、电解质、胰酶等相关指标。酮症酸中毒纠正后,可改用餐时-速效胰岛素联合长效或超长效基础胰岛素强化降糖治疗,胰岛素治疗需终生维持。Sayama等[14]通过胰腺细胞组织学观察发现,FT1D患者的胰岛β细胞面积是正常对照组的0.4%,同时胰岛α细胞也严重受损,减少到33.1%;且在1~5个月内胰岛β细胞完全丧失。国内方六一等[15]报道1例FT1D患者,完全丧失的胰岛功能给予足量胰岛素治疗后曾短暂部分恢复,但仅仅维持15 d后再次丧失,提示胰岛β细胞功能迅速衰退总体趋势不可避免。因为FT1D患者胰岛功能衰竭,与1A型糖尿病相比,需要外源性胰岛素的剂量更大且血糖控制难度更大[5]。
| [1] |
IMAGAWA A, HANAFUSA T, MIYAGAWA J, MATSUZAWA Y. A novel subtype of type 1 diabetes mellitus characterized by a rapid onset and an absence of diabetes-related antibodies. Osaka IDDM Study Group[J]. N Engl J Med, 2000, 342: 301-307. DOI:10.1056/NEJM200002033420501 |
| [2] |
IMAGAWA A, HANAFUSA T, UCHIGATA Y, KANATSUKA A, KAWASAKI E, KOBAYASHI T, et al. Fulminant type 1 diabetes:a nationwide survey in Japan[J]. Diabetes Care, 2003, 26: 2345-2352. DOI:10.2337/diacare.26.8.2345 |
| [3] |
LIU L, MAO J, LU Z, YAN X, YE Y, JIANG F. Clinical analysis of fulminant type 1 diabetes in China and comparison with a nationwide survey in Japan[J]. Ann Endocrinol (Paris), 2013, 74: 36-39. DOI:10.1016/j.ando.2012.11.006 |
| [4] |
IMAGAWA A, HANAFUSA T. Fulminant type 1 diabetes[J]. Nihon Rinsho, 2002, 60(Suppl 7): 418-422. |
| [5] |
MURASE Y, IMAGAWA A, HANAFUSA T, IWAHASHI H, UCHIGATA Y, KANATSUKA A, et al. Fulminant type 1 diabetes as a high risk group for diabetic microangiopathy-a nationwide 5-year-study in Japan[J]. Diabetologia, 2007, 50: 531-537. DOI:10.1007/s00125-006-0575-y |
| [6] |
KOTANI R, NAGATA M, IMAGAWA A, MORIYAMA H, YASUDA H, Miyagawa J, et al. T lymphocyte response against pancreatic beta cell antigens in fulminant type 1 diabetes[J]. Diabetologia, 2004, 47: 1285-1291. DOI:10.1007/s00125-004-1441-4 |
| [7] |
TSUTSUMI C, IMAGAWA A, IKEGAMI H, MAKINO H, KOBAYASHI T, HANAFUSA T, et al. Class Ⅱ HLA genotype in fulminant type 1 diabetes:a nationwide survey with reference to glutamic acid decarboxylase antibodies[J]. J Diabetes Investig, 2012, 3: 62-69. DOI:10.1111/j.2040-1124.2011.00139.x |
| [8] |
KAWABATA Y, NISHIDA N, AWATA T, KAWASAKI E, IMAGAWA A, SHIMADA A, et al. Genome-wide association study confirming a strong effect of HLA and identifying variants in CSAD/Lnc-ITGB7-1 on chromosome 12q13.13 associated with susceptibility to fulminant type 1 diabetes[J]. Diabetes, 2019, 68: 665-675.
|
| [9] |
IMAGAWA A, HANAFUSA T, MAKINO H, MIYAGAWA J I, JUTO P. High titres of IgA antibodies to enterovirus in fulminant type-1 diabetes[J]. Diabetologia, 2005, 48: 290-293. DOI:10.1007/s00125-004-1624-z |
| [10] |
SANO H, TERASAKI J, TSUTSUMI C, IMAGAWA A, HANAFUSA T. A case of fulminant type 1 diabetes mellitus after influenza B infection[J/OL]. Diabetes Res Clin Pract, 2008, 79: e8-e9. doi: 10.1016/j.diabres.2007.10.030.
|
| [11] |
HOSOKAWA Y, HANAFUSA T, IMAGAWA A. Pathogenesis of fulminant type 1 diabetes:genes, viruses and the immune mechanism, and usefulness of patient-derived induced pluripotent stem cells for future research[J]. J Diabetes Investig, 2019, 10: 1158-1164. DOI:10.1111/jdi.13091 |
| [12] |
TANAKA S, NISHIDA Y, AIDA K, MARUYAMA T, SHIMADA A, SUZUKI M, et al. Enterovirus infection, CXC chemokine ligand 10(CXCL10), and CXCR3 circuit:a mechanism of accelerated beta-cell failure in fulminant type 1 diabetes[J]. Diabetes, 2009, 58: 2285-2291. DOI:10.2337/db09-0091 |
| [13] |
IMAGAWA A, HANAFUSA T, AWATA T, IKEGAMI H, UCHIGATA Y, OSAWA H, et al. Report of the committee of the Japan Diabetes Society on the Research of Fulminant and Acute-onset Type 1 Diabetes Mellitus:new diagnostic criteria of fulminant type 1 diabetes mellitus (2012)[J]. J Diabetes Investig, 2012, 3: 536-539. DOI:10.1111/jdi.12024 |
| [14] |
SAYAMA K, IMAGAWA A, OKITA K, UNO S, MORIWAKI M, KOZAWA J, et al. Pancreatic beta and alpha cells are both decreased in patients with fulminant type 1 diabetes:a morphometrical assessment[J]. Diabetologia, 2005, 48: 1560-1564. DOI:10.1007/s00125-005-1829-9 |
| [15] |
方六一, 倪学健, 狄红杰, 刘超. 胰岛素分泌功能短暂恢复的爆发性1型糖尿病一例[J]. 江苏医药, 2016, 4: 486-487. |
 2020, Vol. 41
2020, Vol. 41


