2. 浙江大学医学院附属第二医院心内科, 杭州 310009
2. Department of Cardiology, the Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310009, Zhejiang, China
经导管主动脉瓣置入术(transcatheter aortic valve implantation,TAVI)是主动脉瓣狭窄治疗方法的一项重大变革。TAVI是通过介入导管将人工心脏瓣膜输送至主动脉瓣区使瓣膜功能得以恢复的技术,具有创伤小、术后恢复快等优势,目前已成为传统外科手术高风险主动脉瓣狭窄患者的首选治疗策略[1]。TAVI虽能明显改善患者的瓣膜功能,但新发左束支传导阻滞(new-onset left bundle branch block,new-LBBB)仍是TAVI术后最常见的并发症[2],其对患者的影响目前观点并不一致,有研究发现TAVI术后new-LBBB增加患者死亡率[3],也有学者认为其对死亡率没有影响[4]。本研究通过分析TAVI术后new-LBBB患者的临床、心电图及超声心动图资料,评估其对患者血流动力学及预后的影响。
1 资料和方法 1.1 研究对象回顾性分析浙江大学医学院附属第二医院2013年3月至2018年4月住院行TAVI手术重度主动脉瓣狭窄患者的资料。纳入标准:(1)经超声心动图确诊为重度主动脉瓣狭窄;(2)年龄≥61岁;(3)NYHA心功能分级Ⅱ~Ⅳ级,外科手术高风险或存在外科主动脉瓣置换术禁忌证;(4)心电图、超声心动图、CT检查结果完整;(5)至少随访1年。排除标准:(1)14 d内发生急性心肌梗死;(2)严重心力衰竭[左心室射血分数(left ventricular ejection fraction,LVEF)<20%];(3)血液动力学不稳定或呼吸功能不稳定;(4)急性感染或心内膜炎;(5)主动脉瓣单叶瓣、四叶瓣等畸形或瓣环无钙化;(6)混合型主动脉瓣环病变,如伴有主动脉缩窄等;(7)梗阻性肥厚型心肌病;(8)大量二尖瓣反流;(9)严重心律失常;(10)不能耐受抗凝治疗;(11)恶性肿瘤病史;(12)非心脏因素导致的预计生存时间<12个月;(13)术前已存在完全性左束支传导阻滞者。本研究通过浙江大学医学院附属第二医院伦理委员会审批并备案。
1.2 临床资料收集通过浙江大学医学院附属第二医院电子住院病历系统收集患者的人口学资料(年龄、性别、体重、身高、入院时血压及心率)、基础心脏疾病史、伴随疾病(高血压、糖尿病、脑卒中、慢性阻塞性肺疾病、心房颤动、室性心律失常)、入院时NYHA心功能分级、入院时主要临床症状及术后心电图的动态变化资料。患者常规于入院次日清晨抽空腹静脉血,静脉血标本均在采血后2 h内送检。血液检测项目包括血常规、肝肾功能、血糖、血肌酐、氨基末端脑钠肽前体(N-terminal pro B type natriuretic peptide,NT-proBNP)等。
1.3 经胸超声心动图检查所有研究对象均由有5年以上工作经验心脏超声科主治医师或副主任医师检查。受检者取平卧位或左侧卧位,应用EPIQ7C型彩色多普勒心脏超声诊断仪(荷兰Philips公司)进行检测,探头频率为1.0~5.0 MHz,二维图像采用S5-1探头、三维图像采用X5-1探头。于胸骨旁长轴切面在放大模式下测量心脏收缩中期瓣叶根部附着点连线距离,并将其作为主动脉瓣环内径,同时测量主动脉窦部内径、窦管交界处内径、升主动脉内径。于心尖五腔心切面测量主动脉瓣跨瓣压差,根据连续方程计算主动脉瓣口面积(aortic valve area,AVA):AVA=左心室流出道横截面积×左心室流出道血流速度时间积分/主动脉瓣血流速度时间积分[5],见图 1。应用双平面Simpson法[6]测量LVEF。根据欧洲超声心动图学会指南[7-8],采用积分法评估心脏瓣膜反流程度,瓣膜无反流或轻微反流为0分,少量反流为1分,少至中等量反流或中等量反流为2分,中等量至大量反流为3分,大量反流为4分。肺动脉收缩压(pulmonary artery systolic pressure,PASP)用三尖瓣反流压差法估测。
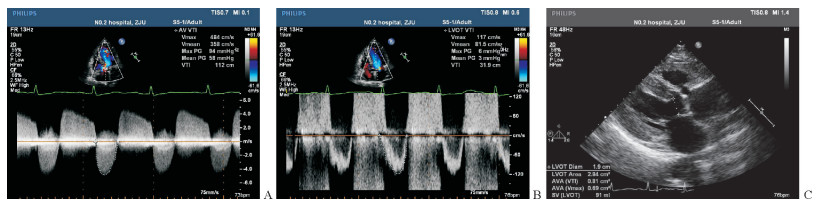
|
图 1 经胸超声心动图测量AVA Fig 1 Measurement of AVA by transthoracic echocardiography A: Velocity-time integral (VTI) of aortic valve (AV); B: VTI of left ventricular outflow tract (LVOT); C: Cross-sectional area of LVOT. AVA: Aortic valve area; Vmax: Maximum flow velocity; Vmean: Mean flow velocity; Max PG: Maximum pressure gradient; Mean PG: Mean pressure gradient |
1.4 TAVI方法及随访
患者均在杂交手术室全身麻醉下行TAVI,术前常规插入食管超声探头,并预防性置入临时起搏器。术中根据主动脉根部及升主动脉解剖学特征、CT及超声心动图测量值与通过球囊扩张时的“腰征”和造影剂反流程度选择合适的人工瓣膜。术后12个月在我院门诊的超声心动图室复查经胸超声心动图,评估AVA、主动脉瓣跨瓣压差、LVEF、瓣膜反流及瓣周漏等,同时随访心电图、NT-proBNP等资料。new-LBBB诊断标准:TAVI术中或术后新发的持久性左束支传导阻滞。研究终点为全因死亡,随访截止时间为2019年4月30日。
1.5 统计学处理采用SPSS 25.0软件进行数据处理和分析。计数资料以例数和百分数表示,组间比较采用χ2检验或Fisher确切概率法;计量资料通过Kolmogorov-Smirnov检验进行正态性检验,正态分布的计量资料以x±s表示,组间比较采用独立样本t检验;偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用Mann-Whitney U检验。生存分析采用Kaplan-Meier法和log-rank检验。所有检验均采用双侧检验,检验水准(α)为0.05。
2 结果 2.1 两组一般资料比较最终纳入重度主动脉瓣狭窄患者245例,年龄为76.53(71.69,80.26)岁,男151例(61.63%)、女94例(38.37%)。置入Edwards瓣膜22例、CoreValve瓣膜69例、Venus A瓣膜99例、MP瓣膜24例、Lotus瓣膜19例、其他类型瓣膜12例。245例患者中57例(23.27%)发生术后永久new-LBBB,其中Edward瓣膜置入术后new-LBBB发生率为22.7%(5/22),自膨胀型CoreValve瓣膜置入术后为23.2%(16/69),Venus A瓣膜置入术后为21.2%(21/99),MP瓣膜置入术后为20.8%(5/24),Lotus瓣膜置入术后为31.6%(6/19),其他类型瓣膜置入术后为33.3%(4/12),各组瓣膜类型new-LBBB发生率差异无统计学意义(χ2=2.049,P=0.855)。57例发生永久new-LBBB的患者纳入new-LBBB组,其中2例在出院后出现心源性晕厥,心电图提示长间歇,植入永久起搏器;1例在术后1个月因发生恶性室性心律失常死亡。余188例纳入对照组,包括2例术后1个月随访心电图提示new-LBBB消失患者。由表 1可见,两组年龄、性别、BMI、伴随疾病(高血压、冠心病、糖尿病、慢性阻塞性肺疾病、术前卒中、心房颤动)、入院时NYHA心功能分级、瓣膜病变类型(二叶式主动脉瓣畸形、三叶瓣)差异均无统计学意义(P均>0.05)。
|
|
表 1 两组重度主动脉瓣狭窄患者TAVI术前一般资料比较 Tab 1 General data of severe aortic stenosis patients before TAVI in two groups |
2.2 两组术前及术后12个月超声心动图资料和NT-proBNP比较
由表 2可见,术前new-LBBB组主动脉瓣峰值跨瓣压差、主动脉瓣平均跨瓣压差、主动脉瓣最大血流速度均低于对照组,差异均有统计学意义(t=-2.570、t=-2.532、Z=-2.275,P均<0.05);两组术前超声心动图测得的其他指标差异均无统计学意义(P均>0.05)。209例患者有术后12个月的超声心动图资料和NT-proBNP结果,其中new-LBBB组53例。术后12个月new-LBBB组LVEF低于对照组,二尖瓣反流积分高于对照组,差异均有统计学意义(Z=-4.267、-2.668,P均<0.01)。
|
|
表 2 两组重度主动脉瓣狭窄患者TAVI术前及术后12个月超声心动图资料及NT-proBNP比较 Tab 2 Echocardiographic parameters and NT-proBNP before TAVI and 12-month after TAVI of severe aortic stenosis patients in two groups |
2.3 两组患者全因死亡率比较
以全因死亡作为观察终点,随访35.77(23.80,45.88)个月,new-LBBB组全因死亡率为10.5%(6/57),对照组全因死亡率为5.9%(11/188),差异无统计学意义(χ2=1.48,P=0.238)。Kaplan-Meier生存分析结果显示,两组总生存期差异无统计学意义(log-rank检验,P=0.25;图 2)。
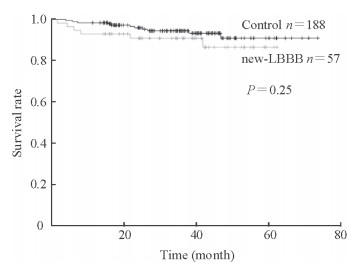
|
图 2 两组重度主动脉瓣狭窄患者TAVI术后Kaplan-Meier生存分析 Fig 2 Kaplan-Meier survival analysis of severe aortic stenosis patients after TAVI in two groups TAVI: Transcatheter aortic valve implantation; new-LBBB: New-onset left bundle branch block |
3 讨论
左束支位于主动脉右、后半月瓣交界处下方的心内膜下,由此沿室间隔左侧面向下走行,左束支主干宽短并且几乎全程皆位于心内膜下,术中容易受损。既往报道显示球囊扩张型Edward瓣膜置入术后完全性左束支传导阻滞发生率为7%~18%,自膨胀型CoreValve瓣膜置入术后为30%~83%[9]。本中心Edward瓣膜置入术后new-LBBB发生率为22.7%(5/22),自膨胀型CoreValve瓣膜置入术后为23.2%(16/69),Venus A瓣膜置入术后为21.2%(21/99),MP瓣膜置入术后为20.8%(5/24),Lotus瓣膜置入术后为31.6%(6/19),其他类型瓣膜置入术后为33.3%(4/12),各组瓣膜类型new-LBBB发生率差异无统计学意义。推测与球囊扩张或人工瓣膜释放时诱发的炎症反应或高压扩张机械性损伤传导组织有关。既往研究表明置入瓣膜尺寸越大、位置越低、基线QRS时间越长、左心室流出道越小,对希氏束及左束支造成直接创伤或机械损伤的风险越大[10]。左束支传导阻滞时心室除极和复极顺序改变,心室激动完全靠右束支传导,最先在右心室由心内膜向心包脏层除极,然后从右心室经室间隔传入左心室心肌,由于心肌本身传导缓慢,致使左心室除极过程显著延长,其超声心动图表现为左心室游离壁收缩明显延迟,室间隔矛盾运动及搏幅低平,这些病理改变导致心室收缩不同步,使每搏输出量及射血分数降低[11];同时左束支传导阻滞可引起左心室内激动和收缩延迟,导致左心室充盈时间缩短、左心室等容收缩时间延长,易使二尖瓣发生反流,使心功能进一步降低[12]。
在行TAVI的人群中,Urena等[13]证实术后持续性左束支传导阻滞患者LVEF明显受损,与无LBBB组相比心功能较差,但对总死亡率无影响。本研究中,new-LBBB组在术后12个月时LVEF低于对照组、二尖瓣反流积分高于对照组,考虑与左束支阻滞导致的心室收缩不同步及左心室等容收缩时间延长相关。生存分析提示两组总生存期差异无统计学意义,与上述报道一致。但Houthuizen等[3]认为TAVI诱发的左束支传导阻滞是患者死亡的独立预测因素;Zannad等[14]发现TAVI术后左束支传导阻滞可增加患者心力衰竭发生率及死亡率,是进展至心力衰竭的独立危险因素;Tabrizi等[15]发现在已有左心功能受损的患者中,左束支传导阻滞会导致死亡率增加。因此,左束支传导阻滞对死亡率的长期影响及是否需要后续再同步化治疗,尚需进一步观察及随访。Meguro等[16]报道部分接受TAVI的患者因术后反复心力衰竭而接受心脏再同步化治疗后心功能改善,但目前尚无相关指南。
部分患者在TAVI术中球囊扩张或人工瓣膜释放后即刻发生左束支传导阻滞,少数患者在TAVI术后数天才发生,但大部分发生在围手术期,少数患者在出院后出现new-LBBB[17]。新发持续性左束支传导阻滞QRS>160 ms的患者发生心源性猝死的风险更高[18]。部分患者在术后1年随访中左束支传导阻滞可消失[19]。在本研究中,2例患者术后1个月复诊,随访心电图提示左束支传导阻滞已消失,提示传导系统功能恢复正常;2例在出院后出现心源性晕厥,心电图提示长间歇,置入永久起搏器;1例在术后1个月因发生恶性室性心律失常猝死。因此,术后1个月内密切随访心电图及动态心电图非常重要。
本研究也存在局限性。首先,本研究为单中心经验,术后new-LBBB患者样本量小,对置入不同类型人工主动脉瓣所致的new-LBBB未进行分层分析,未采用超声心动图对左心室收缩不同步性进行评价。其次,部分患者随访时间较短,随访期可能还不足以确定new-LBBB对死亡率、射血分数及瓣膜反流的长期影响。此外,本研究中两组间术前主动脉瓣峰值跨瓣压差、主动脉瓣平均跨瓣压差、主动脉瓣最大血流速度差异均有统计学意义,提示对照组术前主动脉瓣狭窄较严重。主动脉瓣狭窄程度是否影响术者对瓣膜尺寸的选择,以及狭窄较严重的主动脉瓣组织是否对置入的瓣架固定性较好,并有利于瓣体固定于较高的位置、减少瓣体对低位区希氏束及左束支造成直接创伤或机械损伤,均有待于扩大样本量进行更长期深入细致的研究。
| [1] |
BAUMGARTNER H, FALK V, BAX J J, DE BONIS M, HAMM C, HOLM P J, ESC Scientific Document Group, et al. ESC Scientific Document Group. 2017 ESC/EACTS guidelines for the management of valvular heart disease[J]. Eur Heart J, 2017, 38: 2739-2791. DOI:10.1093/eurheartj/ehx391 |
| [2] |
MUNTANÉ-CAROL G, GUIMARAES L, FERREIRANETO A N, WINTZER-WEHEKIND J, JUNQUERA L, DEL VAL D, et al. How does new-onset left bundle branch block affect the outcomes of transcatheter aortic valve repair?[J]. Expert Rev Med Devices, 2019, 16: 589-602. DOI:10.1080/17434440.2019.1624161 |
| [3] |
HOUTHUIZEN P, VAN GARSSE L A, POELS T T, DE JAEGERE P, VAN DER BOON R M, SWINKELS B M, et al. Left bundle-branch block induced by transcatheter aortic valve implantation increases risk of death[J]. Circulation, 2012, 126: 720-728. DOI:10.1161/CIRCULATIONAHA.112.101055 |
| [4] |
ESCHALIER R, MASSOULLIÉ G, NAHLI Y, JEAN F, COMBARET N, PLOUX S, et al. New-onset left bundle branch block after TAVI has a deleterious impact on left ventricular systolic function[J]. Can J Cardiol, 2019, 35: 1386-1393. DOI:10.1016/j.cjca.2019.05.012 |
| [5] |
BAUMGARTNER H, HUNG J, BERMEJO J, CHAMBERS J B, EVANGELISTA A, GRIFFIN B P, et al; EAE/ASE. Echocardiographic assessment of valve stenosis: EAE/ASE recommendations for clinical practice[J/OL]. Eur J Echocardiogr, 2009, 10: 1-25. doi: 10.1093/ejechocard/jen303.
|
| [6] |
中华医学会超声医学分会超声心动图学组. 中国成年人超声心动图检查测量指南[J]. 中华超声影像学杂志, 2016, 25: 645-666. DOI:10.3760/cma.j.issn.1004-4477.2016.08.001 |
| [7] |
LANCELLOTTI P, TRIBOUILLOY C, HAGENDORFF A, MOURA L, POPESCU B A, AGRICOLA E, et al. European Association of Echocardiography. European Association of Echocardiography recommendations for the assessment of valvular regurgitation. Part 1:aortic and pulmonary regurgitation (native valve disease)[J]. Eur J Echocardiogr, 2010, 11: 223-244. DOI:10.1093/ejechocard/jeq030 |
| [8] |
LANCELLOTTI P, MOURA L, PIERARD L A, AGRICOLA E, POPESCU B A, TRIBOUILLOY C, et al. European Association of Echocardiography. European Association of Echocardiography recommendations for the assessment of valvular regurgitation. Part 2:mitral and tricuspid regurgitation (native valve disease)[J]. Eur J Echocardiogr, 2010, 11: 307-332. DOI:10.1093/ejechocard/jeq031 |
| [9] |
沈卫峰, 张凤如. 心血管疾病并发症防治进展[M]. 上海: 上海科学技术出版社, 2013: 371-377.
|
| [10] |
NISHIYAMA T, TANOSAKI S, TANAKA M, YANAGISAWA R, YASHIMA F, KIMURA T, et al. Predictive factor and clinical consequence of left bundle-branch block after a transcatheter aortic valve implantation[M]. Int J Cardiol, 2017, 227: 25-29.
|
| [11] |
尹立雪. 现代超声心脏电生理学[M]. 北京: 人民军医出版社, 2007: 359-364.
|
| [12] |
陈新. 临床心律失常学[M]. 2版. 北京: 人民卫生出版社, 2009: 1263-1266.
|
| [13] |
URENA M, MOK M, SERRA V, DUMONT E, NOMBELA-FRANCO L, DELAROCHELLIÈRE R, et al. Predictive factors and long-term clinical consequences of persistent left bundle branch block following transcatheter aortic valve implantation with a balloon-expandable valve[J]. J Am Coll Cardiol, 2012, 60: 1743-1752. DOI:10.1016/j.jacc.2012.07.035 |
| [14] |
ZANNAD F, HUVELLE E, DICKSTEIN K, VAN VELDHUISEN D J, STELLBRINK C, KØBER L, et al. Left bundle branch block as a risk factor for progression to heart failure[J]. Eur J Heart Fail, 2007, 9: 7-14. DOI:10.1016/j.ejheart.2006.04.011 |
| [15] |
TABRIZI F, ENGLUND A, ROSENQVIST M, WALLENTIN L, STENESTRAND U. Influence of left bundle branch block on long-term mortality in a population with heart failure[J]. Eur Heart J, 2007, 28: 2449-2455. DOI:10.1093/eurheartj/ehm262 |
| [16] |
MEGURO K, LELLOUCHE N, TEIGER E. Cardiac resynchronization therapy improved heart failure after left bundle branch block during transcatheter aortic valve implantation[J]. J Invasive Cardiol, 2012, 24: 132-133. |
| [17] |
MCCAFFREY J A, ALZAHRANI T, DATTA T, SOLOMON A J, MERCADER M, MAZHARI R, et al. Outcomes of acute conduction abnormalities following transcatheter aortic valve implantation with a balloon expandable valve and predictors of delayed conduction system abnormalities in follow-up[J]. Am J Cardiol, 2019, 123: 1845-1852. DOI:10.1016/j.amjcard.2019.02.050 |
| [18] |
URENA M, WEBB J G, ELTCHANINOFF H, MUÑOZ-GARCÍA A J, BOULETI C, TAMBURINO C, et al. Late cardiac death in patients undergoing transcatheter aortic valve replacement:incidence and predictors of advanced heart failure and sudden cardiac death[J]. J Am Coll Cardiol, 2015, 65: 437-448. DOI:10.1016/j.jacc.2014.11.027 |
| [19] |
MIURA M, SHIRAI S, UEMURA Y, HAYASHI M, TAKIGUCHI H, ITO S, et al. Clinical impact of intraventricular conduction abnormalities after transcatheter aortic valve implantation with balloonexpandable valves[J]. Am J Cardiol, 2019, 123: 297-305. DOI:10.1016/j.amjcard.2018.10.005 |
 2020, Vol. 41
2020, Vol. 41


