2. 华中科技大学同济医学院附属协和医院胸外科, 武汉 430027;
3. 中国医学科学院阜外医院成人心脏外科, 北京 100037
2. Department of Thoracic Surgery, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430027, Hubei, China;
3. Department of Adult Cardiac Surgery, Fuwai Hospital, Chinese Academy of Medical Sciences, Beijing 100037, China
心力衰竭因缺少有效的防治措施导致其发病率和死亡率不断上升,已成为全球健康防治领域的重要难题。研究发现,随病程延长,心力衰竭患者病情加重,健存的心肌细胞数目也越来越少,提示心肌细胞凋亡是心脏衰老的基础[1-3]。心肌细胞的凋亡启动了代偿性结构重构,包括心肌细胞肥大、心脏成纤维细胞增殖,进一步发展则导致病理性重构,引发心肌肥厚、心肌僵硬度增加和心脏顺应性下降,最终造成心脏舒张功能不全,发展为心力衰竭[4]。但目前对于心力衰竭的发病机制尚不清楚。钙离子/钙调素依赖性蛋白激酶Ⅱ(Ca2+/calmodulin-dependent protein kinase Ⅱ,CaMKⅡ)是一种多功能的丝氨酸-苏氨酸蛋白激酶,它可以通过自身磷酸化并磷酸化其底物造成级联效应[5]。研究显示,CaMKⅡ能促进心肌肥大并引起心脏功能异常[6],但抑制CaMKⅡ是否能够抑制压力负荷引起的病理性心肌细胞肥大及凋亡仍不清楚,其相关下游机制仍需进一步探索。本研究旨在探讨抑制CaMKⅡ调控压力负荷心力衰竭小鼠心肌细胞肥大和凋亡的作用及机制。
1 材料和方法 1.1 实验动物与试剂6~8周龄雄性C57BL/6小鼠24只,北京百奥赛图基因生物技术有限公司,实验动物生产许可证号:SCXK(京)2015-0008。异氟醚,河北一品制药有限公司;CaMKⅡ抑制剂KN-93,美国Selleck Chemicals公司;心房钠尿肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)、β肌球蛋白重链(β-myosin heavy chain,β-MHC)、活化的Caspase 3、活化的Caspase 9、Bcl-2、B淋巴细胞瘤2相关X蛋白(B-cell lymphoma-2-related X protein,Bax)一抗,美国Cell signaling公司;沉默调节蛋白3(sirtuin 3,Sirt3),英国Abcam公司;磷酸化钙离子/钙调素依赖性蛋白激酶Ⅱ(phosphorylated-Ca2+/calmodulin-dependent protein kinaseⅡ,p-CaMKⅡ)、GAPDH一抗和cDNA合成试剂盒、SYBR Green qPCR Master Mix试剂盒,美国Thermo Fisher Scientific公司;麦胚凝集素(triticum vulgaris lectin,WGA),美国Sigma公司;TUNEL染色试剂盒,美国Roche公司;Vevo2100型高分辨率小动物超声系统,加拿大VisualSonics公司;Masson染色试剂盒,南京建成生物工程研究所有限公司;抗生素,西安顶尖生物有限公司。
1.2 方法 1.2.1 模型建立及实验分组小鼠术前胸部脱毛并禁食12 h,然后经2%异氟醚吸入麻醉,参照文献[7]进行主动脉缩窄术(transverse aortic constriction,TAC)。根据实验目的将小鼠分为4组:假手术组、假手术+KN-93组、TAC组、TAC+KN-93组,每组6只。假手术组除分离小鼠主动脉弓但不结扎外,其他处理与TAC组相同。手术后连续肌内注射抗生素3 d。KN-93给药方式:术前3 d予小鼠腹腔注射KN-93 5 mg/kg,每天注射1次,连续注射至术后21 d。
1.2.2 心脏质量指数(heart weight index,HWI)测定称小鼠体重,经2%异氟醚吸入麻醉后仰卧固定,摘取心脏,放入预冷的PBS中洗涤,滤纸吸干PBS后称心脏质量并计算HWI,HWI=心脏质量(mg)/体重(g)。
1.2.3 超声心动图检测小鼠心脏结构变化小鼠胸部脱毛,经高分辨率小动物超声系统评价小鼠心脏结构和功能。通过M模式测定5个心动周期左心室舒张末期直径(left ventricular end-diastolic diameter,LVEDD)、左心室收缩末期直径(left ventricular end-systolic diameter,LVESD)评价心脏结构。通过计算左心室射血分数(left ventricular ejection fraction,LVEF)和左心室短轴缩短率(left ventricular fraction shortening,LVFS)评价收缩功能。LVEF(%)=(LVEDD3-LVESD3)/LVEDD3×100%,LVFS(%)=(LVEDD-LVESD)/LVEDD×100%。
1.2.4 WGA、Masson及TUNEL染色检测小鼠心肌组织变化取小鼠新鲜心肌组织置于4%多聚甲醛溶液固定48 h,进行石蜡包埋及切片。切片脱蜡后使用双蒸水洗涤5 min,PBS洗涤3次,每次2 min,然后分别进行WGA、Masson及TUNEL染色。
WGA染色:20 µg/mL蛋白酶K孵育0.5 h,PBS多次洗涤;20 µg/mL WGA于37 ℃避光孵育1 h。PBS再次充分漂洗3次。用倒置荧光显微镜观察、拍照,用ImageJ软件测量心肌细胞横截面积。
Masson染色:严格按照Masson染色试剂盒说明书进行染色,用倒置荧光显微镜观察、拍照,用ImageJ软件测量Masson染色心肌纤维化面积。
TUNEL染色:20 µg/mL蛋白酶K孵育30 min,PBS多次洗涤;参照TUNEL染色试剂盒说明书加入TUNEL染色液,室温避光孵育2 h,PBS多次洗涤;DAPI 1 µg/mL室温避光孵育15 min,PBS漂洗。用倒置荧光显微镜观察、拍照,用ImageJ软件进行TUNEL染色图片分析。
1.2.5 qRT-PCR检测小鼠心肌组织ANP mRNA表达取各组小鼠心肌组织10 mg,用TRIzol法提取总RNA,以总体积20 μL、RNA 500 ng的反应体系进行反转录,合成cDNA。然后利用SYBR Green qPCR Master Mix试剂盒进行qRT-PCR。引物序列:ANP上游引物5′-GATAACAGCCAGGGA GGACAA-3′,下游引物5′-CTGCAGCTTAGATGG GATGA-3′;GAPDH上游引物5′-TGTGTCCGTCGTGGATCTGA-3′,下游引物5′-TTGCTGTTGAAGTCGCAGGAG-3′。以GAPDH为内参照,通过2-ΔΔCt法计算ANP mRNA相对表达量。
1.2.6 蛋白质印迹法检测小鼠心肌组织蛋白表达称取100 mg小鼠心肌组织,加入RIPA裂解液(强)0.3 mL提取总蛋白。以每孔道25 μg蛋白上样进行电泳,转膜后用50 g/L脱脂奶粉溶液封闭2 h。一抗4 ℃孵育过夜,TBST漂洗;二抗室温孵育90 min,TBST漂洗;ECL化学发光显色。以GAPDH为内参照,计算各目的蛋白相对表达量。
1.3 统计学处理应用SPSS 18.0软件进行统计学分析。所有实验至少重复3次。数据以x±s表示,多组间比较采用单因素方差分析,若差异有统计学意义则使用最小显著性差异法进行两两比较。检验水准(α)为0.05。
2 结果 2.1 各组小鼠心脏结构与功能假手术组、假手术+KN-93组、TAC组、TAC+KN-93组小鼠体重差异无统计学意义(F=1.834,P=0.181 5)。与假手术组相比,TAC组小鼠HWI、LVEDD和LVESD均增加(t=-5.156、-15.385、-19.646,P均<0.05),LVEF与LVFS均降低(t=18.102、16.207,P均<0.05)。给予CaMKⅡ抑制剂KN-93处理后,与TAC组相比,TAC+KN-93组小鼠HWI、LVEDD、LVESD均降低(t=3.081、8.339、11.825,P均<0.05),LVEF、LVFS均升高(t=-10.898、-11.702,P均<0.05)。见图 1。

|
图 1 各组小鼠心脏结构与功能 Fig 1 Cardiac geometry and function of mice in each group KN-93 is an inhibitor of CaMKⅡ. TAC: Transverse aortic constriction; HWI: Heart weight index; LVEDD: Left ventricular end-diastolic diameter; LVESD: Left ventricular end-systolic diameter; LVEF: Left ventricular ejection fraction; LVFS: Left ventricular fraction shortening; CaMKⅡ: Ca2+/calmodulin-dependent protein kinase Ⅱ. *P < 0.05 vs sham group; △P < 0.05 vs TAC group. n=6, x±s |
2.2 各组小鼠心肌细胞横截面积
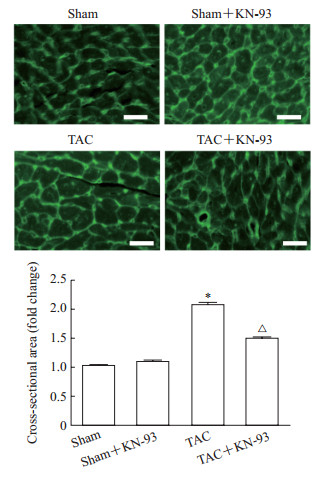
WGA染色结果显示,与假手术组相比,TAC组小鼠心肌细胞横截面积增大(t=-22.826,P<0.05);给予KN-93抑制CaMKⅡ后,TAC+KN-93组小鼠心肌细胞横截面积较TAC组减小(t=12.428,P<0.05)。见图 2。
|
图 2 WGA染色检测各组小鼠心肌细胞横截面积 Fig 2 Cross-sectional area of mouse cardiomyocytes in each group detected by WGA staining KN-93 is an inhibitor of CaMKⅡ. WGA: Triticum vulgaris lectin; TAC: Transverse aortic constriction; CaMKⅡ: Ca2+/calmodulin-dependent protein kinase Ⅱ. Scale bar=50 μm. *P < 0.05 vs sham group; △P < 0.05 vs TAC group. n=6, x±s |
2.3 各组小鼠心肌纤维化程度
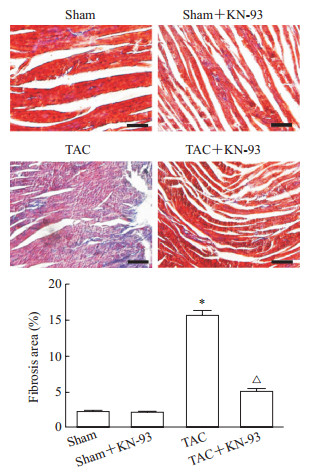
Masson染色结果显示,假手术组小鼠心肌纤维呈红色,TAC组小鼠心肌纤维间可见蓝染的胶原纤维,提示TAC组小鼠发生心肌纤维化,纤维化程度与假手术组相比差异有统计学意义(t=-22.618,P<0.05);而给予KN-93抑制CaMKⅡ后,TAC+KN-93组小鼠心肌纤维化程度较TAC组降低(t=17.685,P<0.05)。见图 3。
|
图 3 Masson染色检测各组小鼠心肌纤维化程度 Fig 3 Fibrosis of mouse myocardial in each group detected by Masson staining KN-93 is an inhibitor of CaMKⅡ. TAC: Transverse aortic constriction; CaMKⅡ: Ca2+/calmodulin-dependent protein kinase Ⅱ. Scale bar=50 μm. *P < 0.05 vs sham group; △P < 0.05 vs TAC group. n=6, x±s |
2.4 各组小鼠心肌组织ANP、BNP及β-MHC表达
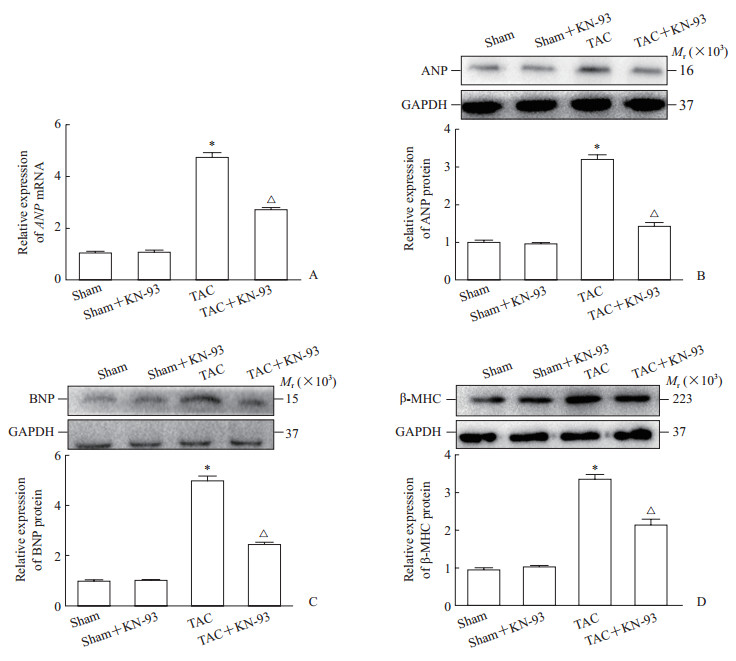
qRT-RCR和蛋白质印迹法检测结果显示,与假手术组相比,TAC组小鼠心肌组织ANP mRNA及蛋白表达均增加(t=-23.448、-19.161,P均<0.05);给予KN-93抑制CaMKⅡ后,TAC+KN-93组ANP mRNA及蛋白表达均较TAC组下降(t=12.786、15.422,P均<0.05)。与ANP蛋白表达相似,TAC组小鼠心肌组织BNP和β-MHC蛋白表达均较假手术组增加(t=-23.975、-16.417,P均<0.05);而TAC+KN-93组BNP和β-MHC蛋白表达均较TAC组下降(t=15.182,8.154,P均<0.05)。见图 4。
|
图 4 各组小鼠心肌组织中ANP、BNP及β-MHC表达 Fig 4 Expression of ANP, BNP and β-MHC in myocardial tissues of mice in each group A: qRT-PCR detecting the mRNA expression of ANP; B-D: Western blotting detecting the protein expressions of ANP (B), BNP (C) and β-MHC (D). KN-93 is an inhibitor of CaMKⅡ. ANP: Atrial natriuretic peptide; BNP: Brain natriuretic peptide; β-MHC: β-myosin heavy chain; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; TAC: Transverse aortic constriction; CaMKⅡ: Ca2+/calmodulin-dependent protein kinase Ⅱ; qRT-PCR: Quantitative real-time polymerase chain reaction. *P < 0.05 vs sham group; △P < 0.05 vs TAC group. n=6, x±s |
2.5 各组小鼠心肌细胞凋亡情况
TUNEL染色结果显示,假手术组小鼠心肌组织未见黄色荧光细胞核,而TAC组可见部分黄色荧光细胞核,心肌细胞凋亡指数高于假手术组,差异有统计学意义(t=-23.412,P<0.05);给予KN-93抑制CaMKⅡ后,TAC+KN-93组仅有极少数黄色荧光细胞核,心肌细胞凋亡指数较TAC组降低,差异有统计学意义(t=18.263,P<0.05)。见图 5。

|
图 5 TUNEL染色检测各组小鼠心肌细胞凋亡情况 Fig 5 Apoptosis of mouse cardiomyocytes in each group detected by TUNEL staining KN-93 is an inhibitor of CaMKⅡ. TUNEL: Terminal dexynucleotidyl transferase-mediated dUTP nick end labeling; DAPI: 4, 6-diamino-2-phenylindole; TAC: Transverse aortic constriction; CaMKⅡ: Ca2+/calmodulin-dependent protein kinase Ⅱ. Scale bar=50 μm. *P < 0.05 vs sham group; △P < 0.05 vs TAC group. n=6, x±s |
2.6 各组小鼠心肌组织凋亡相关蛋白表达
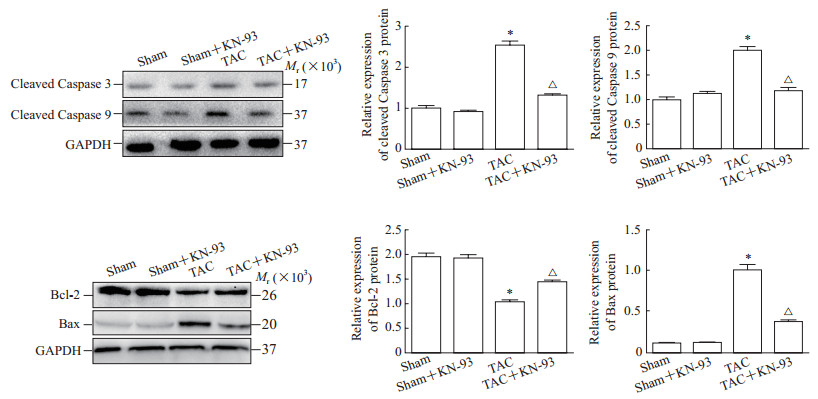
蛋白质印迹法检测结果显示,与假手术组相比,TAC组小鼠心肌组织中凋亡蛋白活化的Caspase 3、活化的Caspase 9和Bax相对表达量均增加(t=-22.658、-11.717、-18.098,P均<0.05),抗凋亡蛋白Bcl-2相对表达量降低(t=14.148,P<0.05)。给予KN-93抑制CaMKⅡ后,TAC+KN-93组活化的Caspase 3、活化的Caspase 9和Bax相对表达量均较TAC组降低(t=18.442、9.586、12.723,P均<0.05),Bcl-2相对表达量较TAC组增加(t=-6.426,P<0.05)。见图 6。
|
图 6 蛋白质印迹法检测各组小鼠心肌组织凋亡相关蛋白表达 Fig 6 Apoptosis-related protein expression in mouse myocardial tissues in each group detected by Western blotting KN-93 is an inhibitor of CaMKⅡ. TAC: Transverse aortic constriction; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase; Bcl-2: B-cell lymphoma-2; Bax: B-cell lymphoma-2-related X protein; CaMKⅡ: Ca2+/calmodulin-dependent protein kinase Ⅱ. *P < 0.05 vs sham group; △P < 0.05 vs TAC group. n=6, x±s |
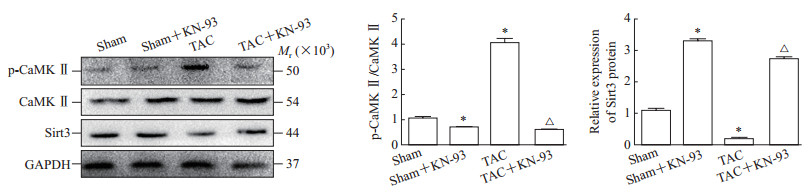
2.7 各组小鼠心肌组织p-CaMKⅡ和Sirt3表达
蛋白质印迹法检测结果显示,与假手术组相比,给予KN-93抑制CaMKⅡ后,假手术+KN-93组小鼠心肌组织p-CaMKⅡ/CaMKⅡ比值下降(t=2.633,P<0.05),Sirt3相对表达量增加(t=-29.413,P<0.05)。TAC组小鼠心肌组织p-CaMKⅡ/CaMKⅡ比值与假手术组相比升高(t=-22.679,P<0.05),Sirt3相对表达量与假手术组相比减少(t=12.643,P<0.05)。然而TAC+KN-93组小鼠心肌组织p-CaMKⅡ/CaMKⅡ比值较TAC组下降(t=26.083,P<0.05),Sirt3相对表达量增加(t=-34.384,P<0.05)。见图 7。
|
图 7 蛋白质印迹法检测各组小鼠心肌组织中p-CaMKⅡ和Sirt3表达 Fig 7 Expression of p-CaMKⅡ and Sirt3 in mouse myocardial tissues in each group detected by Western blotting KN-93 is an inhibitor of CaMKⅡ. p-CaMKⅡ: Phosphorylated-Ca2+/calmodulin dependent protein kinase Ⅱ; Sirt3: Sirtuin 3; TAC: Transverse aortic constriction; CaMKⅡ: Ca2+/calmodulin-dependent protein kinase Ⅱ; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. *P < 0.05 vs sham group; △P < 0.05 vs TAC group. n=6, x±s |
3 讨论
2010年WHO流行病学调查显示,当前全球心力衰竭患者数量逐年增加,已超过2 250万例以上[8]。高血压、肥胖、糖尿病及吸烟等因素均能促进心肌缺血、病理性重构,从而导致心脏收缩功能障碍、心肌肥厚及心室重构,最终发展为心力衰竭。心力衰竭的诊断和治疗水平不断提高,但心力衰竭5年死亡率仍高达45%[9]。因此阐明心力衰竭的发病机制并寻找改善心力衰竭患者心脏功能方法是亟待解决的问题。
CaMKⅡ是介导病理性心肌重构的重要分子,在心肌细胞中通过使其底物广泛磷酸化而引起心肌肥大,最终导致心力衰竭及心律失常[5, 10]。Hoch等[11]研究发现,CaMKⅡ在心力衰竭患者左心室心肌组织中的表达增加。2003年一项发表在Circ Res的研究显示,CaMKⅡ表达和活性的升高与心力衰竭转化有关[12]。CaMKⅡ在心肌肥厚小鼠模型心肌组织中表达上调,CaMKⅡ基因敲除可减轻血管紧张素Ⅱ诱导的心肌肥厚,还可抑制心肌细胞凋亡[13-14]。以上结果提示,CaMKⅡ可能是一个潜在的心力衰竭治疗靶点。但能否通过抑制CaMKⅡ改善压力负荷引起的病理性心肌细胞肥大与损伤,及相关分子信号通路改变仍需进一步研究。
本实验采用TAC建立压力负荷小鼠心力衰竭模型,并在TAC术后3周利用超声心动图评价小鼠心脏结构及功能。结果显示,TAC组小鼠出现心脏肥厚,左心室扩大,LVEF下降,提示压力负荷致小鼠心力衰竭。本研究还观察到TAC组小鼠心肌细胞肥大,部分心肌组织发生了纤维化改变,并且心肌细胞凋亡增加,凋亡蛋白表达增加,抗凋亡蛋白表达减少,p-CaMKⅡ/CaMKⅡ比值上升。但给予CaMKⅡ抑制剂KN-93后,上述改变均被逆转。表明抑制CaMKⅡ能改善小鼠心力衰竭模型心肌细胞凋亡与肥大。
Sirt3是沉默调节蛋白家族成员之一,是一种位于线粒体的应激反应性脱乙酰酶,在心、肝、脑、肾等高代谢器官表达丰富,主要调控细胞代谢、凋亡和生长等[15]。研究表明,Sirt3能够通过调节线粒体相关蛋白质参与代谢、氧化应激,抑制心肌肥大、抵抗应激介导的细胞死亡,从而改善心力衰竭相关心功能不全[16]。研究发现,Sirt3与冠状动脉粥样硬化、心肌肥厚和心肌梗死等心血管疾病的发生、发展有关,其在心力衰竭和糖尿病心肌病患者血液中的表达低于正常患者[17-18]。本研究结果也证实了这一观点,TAC组小鼠心肌组织中Sirt3表达较假手术组降低,提示心脏Sirt3表达下调参与了心力衰竭的发生、发展。此外,Ren等[19]研究发现,在神经元中线粒体Ca2+超载调节Sirt3的表达。CaMKⅡ作为细胞内Ca2+感受器反馈调节Ca2+浓度,在心脏受损后,激活的CaMKⅡ通过促进线粒体发生Ca2+泄漏而触发心肌细胞肥大与凋亡[20]。但在心肌细胞中CaMKⅡ能否调控Sirt3的表达,以及心力衰竭小鼠激活的CaMKⅡ与Sirt3上调是否存在相关性,还需进一步研究。本研究通过蛋白质印迹法检测发现,使用KN-93抑制CaMKⅡ后小鼠心肌细胞Sirt3表达上调,小鼠心功能改善,提示抑制CaMKⅡ可通过促进Sirt3表达减轻压力负荷心力衰竭小鼠的心肌细胞肥大及凋亡,从而改善心功能。
总之,压力负荷诱导的心力衰竭小鼠心肌细胞肥大及凋亡伴随CaMKⅡ激活和Sirt3表达降低。抑制CaMKⅡ激活能通过上调Sirt3表达,降低ANP、BNP和β-MHC蛋白表达,抑制凋亡蛋白Bax、活化的Caspase 3和活化的Caspase 9表达,促进抗凋亡蛋白Bcl-2表达,从而介导心肌细胞肥大与凋亡,减轻压力负荷诱导的心力衰竭小鼠的心功能不全。这为心力衰竭的防治提供了新的靶点和治疗策略。但本研究未深入探讨Sirt3与下游信号通路的关系,并且CaMKⅡ/Sirt3信号通路在心力衰竭小鼠心肌组织中的作用机制仍需体外实验进一步研究。
| [1] |
NISHIDA K, YAMAGUCHI O, OTSU K. Crosstalk between autophagy and apoptosis in heart disease[J]. Circ Res, 2008, 103: 343-351. DOI:10.1161/CIRCRESAHA.108.175448 |
| [2] |
GUREVICH M R, MUSTAPHA S, KIRSHENBAUM A L. Molecular mechanisms of apoptosis in heart failure[J]. Heart Fail Rev, 1999, 4: 1-7. |
| [3] |
BROWN D A, PERRY J B, ALLEN M E, SABBAH H N, STAUFFER B L, SHAIKH S R, et al. Expert consensus document:mitochondrial function as a therapeutic target in heart failure[J]. Nat Rev Cardiol, 2017, 14: 238-250. DOI:10.1038/nrcardio.2016.203 |
| [4] |
SHIRAKABE A, IKEDA Y, SCIARRETTA S, ZABLOCKI D K, SADOSHIMA J. Aging and autophagy in the heart[J]. Circ Res, 2016, 118: 1563-1576. DOI:10.1161/CIRCRESAHA.116.307474 |
| [5] |
BECKENDORF J, VAN DEN HOOGENHOF M M G, BACKS J. Physiological and unappreciated roles of CaMKⅡ in the heart[J/OL]. Basic Res Cardiol, 2018, 113: 29. doi: 10.1007/s00395-018-0688-8.
|
| [6] |
LI S, NONG Y, GAO Q, LIU J, LI Y, CUI X, et al. Astragalus granule prevents Ca2+ current remodeling in heart failure by the downregulation of CaMKⅡ[J/OL]. Evid Based Complement Alternat Med, 2017, 2017: 7517358. doi: 10.1155/2017/7517358.
|
| [7] |
EICHHORN L, WEISHEIT C K, GESTRICH C, PEUKERT K, DUERR G D, AYUB M A, et al. A closed-chest model to induce transverse aortic constriction in mice[J/OL]. J Vis Exp, 2018(134): 57397. doi: 10.3791/57397.
|
| [8] |
DUNLAY S M, ROGER V L. Understanding the epidemic of heart failure:past, present, and future[J]. Curr Heart Fail Rep, 2014, 11: 404-415. DOI:10.1007/s11897-014-0220-x |
| [9] |
VERRIER R L. Assessing risk for rehospitalization and cardiac death in patients with heart failure:can the dynamic duo of heart rate turbulence and T-wave alternans help?[J]. J Cardiovasc Electrophysiol, 2018, 29: 1265-1267. DOI:10.1111/jce.13660 |
| [10] |
FENG Y, CHENG J, WEI B, WANG Y. CaMK Ⅱ inhibition reduces isoproterenol-induced ischemia and arrhythmias in hypertrophic mice[J]. Oncotarget, 2017, 8: 17504-17509. DOI:10.18632/oncotarget.15099 |
| [11] |
HOCH B, MEYER R, HETZER R, KRAUSE E G, KARCZEWSKI P. Identification and expression of delta-isoforms of the multifunctional Ca2+/calmodulindependent protein kinase in failing and nonfailing human myocardium[J]. Circ Res, 1999, 84: 713-721. DOI:10.1161/01.RES.84.6.713 |
| [12] |
ZHANG T, MAIER L S, DALTON N D, MIYAMOTO S, ROSS J Jr, BERS D M, et al. The δC isoform of CaMK Ⅱ is activated in cardiac hypertrophy and induces dilated cardiomyopathy and heart failure[J]. Circ Res, 2003, 92: 912-919. DOI:10.1161/01.RES.0000069686.31472.C5 |
| [13] |
GRIMM M, LING H, WILLEFORD A, PEREIRA L, GRAY C B, ERICKSON J R, et al. CaMKⅡδ mediates β-adrenergic effects on RyR2 phosphorylation and SR Ca2+ leak and the pathophysiological response to chronic β-adrenergic stimulation[J]. J Mol Cell Cardiol, 2015, 85: 282-291. DOI:10.1016/j.yjmcc.2015.06.007 |
| [14] |
CAI K, CHEN H. MiR-625-5p inhibits cardiac hypertrophy through targeting STAT3 and CaMKⅡ[J]. Hum Gene Ther Clin Dev, 2019, 30: 182-191. DOI:10.1089/humc.2019.087 |
| [15] |
徐丽群, 刘冬, 狄守印, 马志强, 范崇熙, 张晓雁, 等. 沉默信息调控因子3及氧化应激介导姜黄素抗心肌缺血再灌注损伤的机制研究[J]. 中国分子心脏病学杂志, 2018, 18: 2364-2367. |
| [16] |
KOENTGES C, BODE C, BUGGER H. SIRT3 in cardiac physiology and disease[J/OL]. Front Cardiovasc Med, 2016, 3: 38. doi: 10.3389/fcvm.2016.00038.
|
| [17] |
孙宇, 刘宁, 张林雪, 张伟华. SIRT3调控线粒体蛋白去乙酰化参与心肌保护[J]. 解剖科学进展, 2017, 23: 212-215, 217. |
| [18] |
SPADARI R C, CAVADAS C, DE CARVALHO A E T S, ORTOLANI D, DE MOURA A L, VASSALO P F. Role of β-adrenergic receptors and sirtuin signaling in the heart during aging, heart failure, and adaptation to stress[J]. Cell Mol Neurobiol, 2018, 38: 109-120. DOI:10.1007/s10571-017-0557-2 |
| [19] |
REN T, ZHANG H, WANG J, ZHU J, JIN M, WU Y, et al. MCU-dependent mitochondrial Ca2+ inhibits NAD+/SIRT3/SOD2 pathway to promote ROS production and metastasis of HCC cells[J]. Oncogene, 2017, 36: 5897-5909. DOI:10.1038/onc.2017.167 |
| [20] |
FIENI F, JOHNSON D E, HUDMON A, KIRICHOK Y. Mitochondrial Ca2+ uniporter and CaMKⅡ in heart[J/OL]. Nature, 2014, 513: E1-E2. doi: 10.1038/nature13626.
|
 2020, Vol. 41
2020, Vol. 41


